
- •1.1. Предмет аналитической химии
- •1.2. Принцип, метод и методика анализа
- •1.3. Виды анализа
- •2.1. Аналитические реакции
- •2.2. Систематический и дробный анализ
- •3.1. Общая характеристика химического равновесия. Константа химического равновесия
- •3.2. Активность и коэффициент активности
- •3.3. Отклонения от идеальности в растворах сильных электролитов
- •3.5. Общие принципы расчёта состава равновесных систем
- •4.1. Важнейшие теории кислот и оснований
- •4.3. Влияние растворителя на кислотно-основные свойства растворённого вещества
- •4.4. Нивелирующее и дифференцирующее действие растворителя. Сильные и слабые кислоты и основания
- •4.6. Расчёт состава равновесных смесей протолитов при заданном значении рН
- •4.7. Кислотно-основные буферные растворы
- •5.1. Понятие о комплексном соединении
- •5.2. Классификация комплексных соединений
- •5.5. Применение органических реагентов в аналитической химии
- •6.1. Произведение растворимости малорастворимого электролита
- •6.2. Растворимость
- •6.3. Влияние различных факторов на растворимость
- •7.1. Общая характеристика окислительно-восста- новительных реакций
- •7.2. Количественная оценка окислительно-восстано- вительной способности веществ
- •7.3. Влияние различных факторов на протекание окислительно-восстановительных реакций
- •8.1. Отбор пробы
- •8.2. Разложение пробы
- •9.1. Общая характеристика и классификация
- •9.2. Жидкость - жидкостная экстракция
- •10.1. Приближённые вычисления и значащие цифры
- •10.2. Понятие об аналитическом сигнале
- •10.4. Неопределённость и погрешности измерений
- •10.6. Пример статистической обработки результатов измерений. Исключение промахов
- •10.7. Основные характеристики методики анализа
- •11.1. Общая характеристика
- •11.2. Виды гравиметрических определений
- •11.3. Понятие о механизме образования осадка
- •11.4. Коллоидная стадия образования осадка
- •11.6. Основные этапы методики гравиметрического определения методом осаждения
- •12.1. Основные понятия титриметрии
- •12.2. Классификация титриметрических методов анализа и способов титрования
- •ГЛАВА 13 Кислотно-основное титрование
- •13.1. Титранты и стандартные вещества
- •13.2. Обнаружение конечной точки титрования. Ки- слотно-основные индикаторы
- •13.3. Кривые титрования
- •13.5. Погрешности титрования
- •13.6. Некоторые случаи практического применения кислотно-основного титрования в водных растворах
- •14.1. Ограничения возможностей кислотно-основного основного титрования в водных растворах
- •14.3. Применение в фармацевтическом анализе
- •ГЛАВА 15 Комплексометрическое титрование
- •15.1. Общая характеристика
- •15.2. Меркуриметрическое титрование
- •15.3. Комплексонометрическое титрование
- •15.3.1. Понятие о комплексонах
- •15.3.2. Свойства этилендиаминтетрауксусной кислоты и её взаимодействие с катионами металлов
- •15.3.3. Кривые титрования
- •15.3.4. Способы обнаружения конечной точки титрования. Металлоиндикаторы
- •15.3.5. Индикаторные погрешности
- •15.3.6. Титранты и стандартные вещества
- •15.3.7. Способы комплексонометрического титрования и его применение
- •ГЛАВА 16 Осадительное титрование
- •16.1. Общая характеристика
- •16.2. Аргентометрическое титрование
- •16.2.1. Кривые титрования
- •16.2.2. Способы обнаружения конечной точки титрования
- •16.2.3. Титранты и стандартные вещества
- •16.2.4. Применение в фармацевтическом анализе
- •16.3. Меркурометрическое титрование
- •17.1. Общая характеристика и классификация
- •17.2. Кривые титрования
- •18.1. Иодометрическое титрование
- •18.2. Хлориодометрическое титрование
- •18.3. Иодатометрическое титрование
- •18.4. Броматометрическое титрование
- •18.5. Нитритометрическое титрование
- •18.6. Перманганатометрическое титрование
- •18.7. Дихроматометрическое титрование
- •18.8. Цериметрическое титрование
- •20.3. Атомно-абсорбционная спектроскопия
- •20.3.1. Процессы, приводящие к появлению аналитического сигнала
- •20.3.2. Измерение аналитического сигнала
- •20.3.3. Практическое применение
- •20.4.2. Измерение аналитического сигнала
- •20.5. ИК-спектроскопия
- •20.5.1. Процессы, приводящие к появлению аналитического сигнала
- •20.5.2. Общая характеристика ИК-спектров
- •20.5.3. Измерение аналитического сигнала
- •20.5.4. Практическое применение
- •21.1. Атомно-эмиссионная спектроскопия
- •21.1.1. Процессы, приводящие к появлению аналитического сигнала
- •21.1.2. Измерение аналитического сигнала
- •21.1.3. Практическое применение
- •21.2. Люминесцентная спектроскопия
- •20.2.1 Классификация видов люминесценции
- •21.2.4. Влияние различных факторов на интенсивность флуоресценции растворов
- •21.2.5. Измерение аналитического сигнала
- •22.1. Общая характеристика
- •22.2. Классификация хроматографических методов
- •22.3. Хроматографические параметры
- •22.4. Теории хроматографического разделения
- •ГЛАВА 23 Газовая хроматография
- •23.1. Общая характеристика
- •23.2. Устройство газового хроматографа
- •23.3. Особенности газотвёрдофазной хроматографии
- •23.4. Особенности газожидкостной хроматографии
- •23.5. Индексы удерживания Ковача
- •23.6. Практическое применение
- •ГЛАВА 24 Жидкостная хроматография
- •24.1. Общая характеристика
- •24.2. Плоскостная хроматография
- •24.2.1. Методика получения плоскостной хроматограммы
- •24.2.2. Анализ плоскостной хроматограммы
- •24.2.3. Практическое применение
- •24.3. Колоночная жидкостная хроматография
- •24.3.1. Устройство жидкостного хроматографа
- •24.3.2. Практическое применение
- •24.4. Характеристика отдельных видов жидкостной хроматографии
- •24.4.1. Ионообменная хроматография
- •24.4.2. Эксклюзионная хроматография
- •25.2. Классификация электрохимических методов анализа
- •25.3. Кондуктометрия
- •25.3.1. Теоретические основы и классификация
- •25.3.2. Измерение аналитического сигнала
- •25.3.4. Практическое применение
- •25.3.5. Понятие о высокочастотной кондуктометрии
- •26.1. Потенциометрический метод анализа
- •26.1.1. Общая характеристика и классификация
- •26.1.2. Условия измерения аналитического сигнала
- •26.1.3. Индикаторные электроды
- •26.1.4. Прямая потенциометрия
- •26.1.5. Потенциометрическое титрование
- •26.2. Кулонометрический метод анализа
- •26.2.1. Общая характеристика и классификация
- •26.2.2. Прямая кулонометрия
- •26.2.3. Кулонометрическое титрование
- •27.1. Принцип измерения аналитического сигнала.
- •27.2. Вольтамперограмма
- •27.4. Практическое применение вольтамперометрии. Амперометрическое титрование
- •ЛИТЕРАТУРА
- •Общая
- •Справочная
- •Дополнительная литература к отдельным темам
- •Химические методы обнаружения неорганических веществ
- •Хемометрика
- •Химические методы анализа
- •Инструментальные методы анализа (общая литература)
- •Спектроскопические методы анализа
- •Хроматографические методы анализа
- •Электрохимические методы анализа
Химические методы анализа
S O
H2N C NH2 + H2O → H2N C NH2+ H2S  Cu2+
Cu2+
тиомочевина
H3C |
C |
O |
H3C |
C |
N OH |
|
|
+ 2NH2OH → |
|
||||
|
C |
|
|
Ni2+ |
||
H3C |
O |
H3C |
C |
N OH |
||
|
|
|
|
диацетил
диметилглиоксим
Метод «возникающих реагентов» позволяет получать кристаллические осадки таких веществ, которые при обычном осаждении образуют лишь аморфные осадки.
После охлаждения кристаллические осадки оставляют на 2 - 24 часа для «старения». При этом происходит растворение мелких кристаллов, укрупнение и самоочищение кристаллов. Созревший осадок является более чистым и легко отделяется от маточного раствора при фильтровании.
11.4. Коллоидная стадия образования осадка
По мере адсорбции на первичных зародышах всё большего и большего количества ионов размер частиц осадка увеличивается. Коллоидной степени дисперсности соответствует размер частиц дисперсной фазы в среднем 1-100 нм. Образование коллоидных частиц неблагоприятно отражается на результатах гравиметрического анализа, поскольку такие частицы вследствие достаточно малого размера не задерживаются обычными фильтрами. Это ведёт к потере осаждаемого вещества.
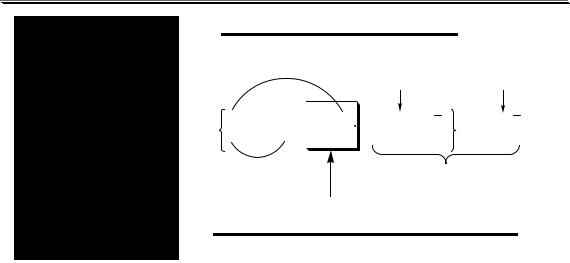
Коллоидные системы являются устойчивыми. Частицы дисперсной фазы в них могут сколь угодно долго находиться во взвешенном состоянии. Главной причиной устойчивости является наличие у коллоидных частиц электрического заряда, который не позволяет им объединяться друг с другом, превращаясь в более крупные образования, оседающие под действием силы тяжести. Возможное строение коллоидной частицы показано на рис. 11.3.
Потенциалопределяющие ионы и соответствующие им противоионы, остающиеся в растворе, образуют двойной электрический слой (ДЭС) – тонкий электрический слой, образующийся из пространственно разделённых зарядов противоположного знака на границе раздела агрегата и раствора. Благодаря наличию двойного электрического слоя коллоидные системы не слипаются друг с другом.
131
Раздел 2
ГРАНУЛА
ядро |
адсорбционный |
диффузионный |
|
слой |
слой |
[AgCl]m nAg+ (n-x)NO3 x+xNO3
nAg+ (n-x)NO3 x+xNO3
агрегат
противоионы
потенциалопределяющие
ионы
МИЦЕЛЛА
Рис. 11.3. Строение коллоидной частицы хлорида серебра, образованной при добавлении к раствору NaCl избытка AgNO3 (показаны потенциалопреде-
ляющие ионы и соответствующие им противоионы)
Процесс объединения частиц дисперсной фазы в более крупные частицы называется коагуляцией. Коагуляцию можно вызвать нагреванием или добавлением к коллоидной системе сильного электролита. Процесс обратный коагуляции называется пептизацией. В результате протекания данного процесса скоагулированный осадок возвращается в исходное коллоидно-дисперсное состояние. Пептизация может происходить при промывании осадка водой. По этой причине осадок вещества, склонного к образованию коллоидных растворов, следует отмывать от адсорбированных на нём примесей не чистой водой, а раствором сильного электролита.
11.5. Причины загрязнения осадка и способы их устранения
Осадок, образующийся в процессе гравиметрического определения, всегда содержит то или иное количество посторонних примесей. Примеси могут попадать в осадок по различным причинам. Вид примесей, загрязняющих осадок, и их количество зависят от условий выполнения анализа и характера образующегося осадка.
Загрязнение осадка может быть вызвано соосаждением приме-
сей либо, реже, совместным или последующим их осаждением. При соосаждении образование осадка приводит к выпадению
в осадок соединений, которые в данных условиях либо хорошо растворимы, либо находятся в таких малых концентрациях, что не достигается величина их произведения растворимости.
Различают следующие виды соосаждения:
132
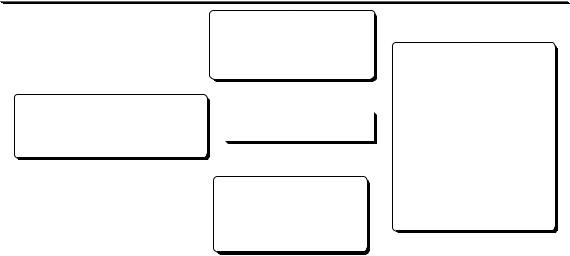
Химические методы анализа
адсорбция
|
осаждение примеси |
|
изоморфное |
|||
|
на поверхности осадка |
|
||||
|
|
|
|
|
|
соосаждение |
|
|
|
|
|
|
|
окклюзия |
|
|
|
|
|
вид окклюзии, при |
|
|
|
|
|
котором осадок |
|
|
СООСАЖДЕНИЕ |
|
||||
попадание адсорбированной |
|
|
||||
|
|
загрязнён соединением, |
||||
|
|
|||||
примеси внутрь осадка |
|
|
|
|
|
образованным ионами |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
инклюзия |
|
|
|
близкими по размеру |
|
|
|
|
|
и свойствам ионам |
||
|
механический захват |
|
осадка |
|||
|
растущим осадком |
|
|
|||
|
части раствора |
|
|
|||
Адсорбция примесей на осадке приводит к увеличению его массы по сравнению с ожидаемой и, следовательно, к завышению результатов анализа. Процесс адсорбции ионов на осадках подчиняется пра-
вилу Фаянса-Панета-Хана.
На осадке адсорбируются ионы, образующие с противоположным по заряду ионом осадка малорастворимое соединение.
Например, на осадке AgCl будут адсорбироваться ионы серебра и хлорид-ионы, на осадке BaSO4 – Ba2+ и SO42- и т.д.
Адсорбирующиеся ионы могут отличаться от собственных ионов осадка. Например, на осадке AgCl могут адсорбироваться ионы Br- или I- Такая адсорбция называется специфической.
Степень адсорбции иона на осадке зависит от его концентрации в растворе и заряда. При прочих равных условиях адсорбируются те ионы, концентрация которых больше. При увеличении заряда иона его адсорбционная способность повышается. Адсорбция является экзотермическим процессом. При увеличении температуры она уменьшается. Количество адсорбированных примесей прямо пропорционально площади поверхности осадка, поэтому такой вид загрязнения особенно характерен для аморфных осадков с большой удельной поверхностью. Все действия, ведущие к увеличению размера частиц осадка, приводят и к уменьшению количества адсорбированных примесей. Для уменьшения количества адсорбированных ионов используют нагревание раствора. Адсорбированные примеси можно удалить путём замещения их другими ионами, от которых можно затем легко избавиться при прокаливании осадка. Для этого осадок промывают разбавленным раствором летучего электролита (например, NH4NO3).
Окклюзия подчиняется тем же закономерностям, что и адсорбция. Окклюдированные примеси в той или иной степени удаляются в процессе «старения» осадка и при его переосаждении.
133
Раздел 2
На процесс изоморфного соосаждения влияет размер частиц осадка и скорость установления равновесия между осадком и раствором. Изоморфное соосаждение это самый трудный с точки зрения устранения последствий вид соосаждения. Предотвратить его можно лишь путём предварительного удаления мешающих ионов из раствора.
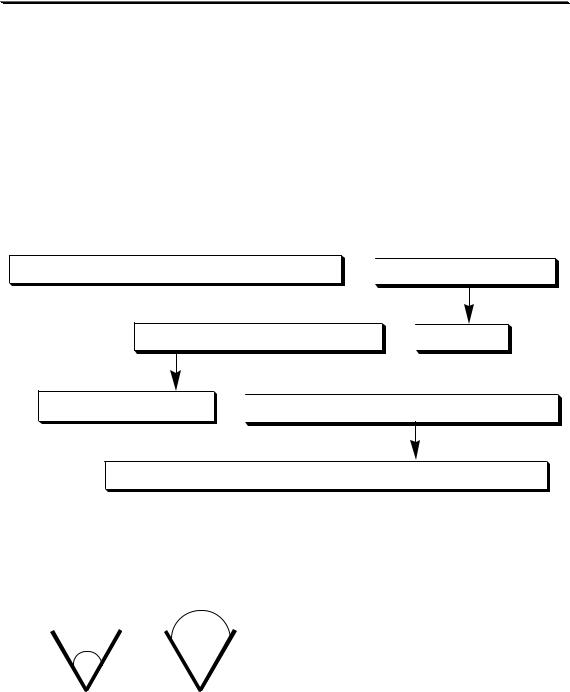
11.6. Основные этапы методики гравиметрического определения методом осаждения
Типичная методика гравиметрического определения методом осаждения включает в себя следующие этапы:
взятие навески анализируемого образца 
 растворение навески
растворение навески
отделение осадка от раствора 
 осаждение
осаждение
промывание осадка 
 получение гравиметрической формы
получение гравиметрической формы
измерение массы гравиметрической формы, расчёты
Взятие навески
Оптимальная масса навески зависит от величины неопределённости измерения массы с помощью аналитических весов (±1 10-4 г) и от характера образующегося осадка.
 необходимо много времени, чтобы отфильтровать, промыть, высушить
необходимо много времени, чтобы отфильтровать, промыть, высушить
и прокалить такое количество осадка
☺
Аморфный осадок занимает больший объём, чем имеющий такую же массу кристаллический осадок, поэтому оптимальная масса аморфных осадков меньше, чем у кристаллических. Обычно массу навески берут такой, чтобы масса аморфного осадка была равна примерно 0,1 г, а масса кристаллического – от 0,1 г (лёгкий осадок типа CaCO3) до 0,5 г (очень тяжёлый осадок типа PbSO4).
Растворение навески
Навеску растворяют в дистиллированной воде. Раствор нагревают и добавляют к нему необходимые вспомогательные реагенты.
134
Химические методы анализа
Осаждение
Осадитель всегда добавляют в некотором избытке: больше на 30-50%, если осадитель нелетучий, и 2-3 кратный избыток, если он летучий. При получении кристаллических осадков осадитель добавляют медленно, по каплям. Раствор непрерывно перемешивают. Для того чтобы получить скоагулированный аморфный осадок, осаждения проводят быстро, используя концентрированный раствор осадителя.
Полученные кристаллические осадки оставляют в растворе на 2- 24 часа для «созревания» («старения»). Аморфные осадки оставляют лишь на короткое время в горячем растворе для уплотнения.
Отделение осадка от раствора
Обычно осадок отделяют от раствора фильтрованием через бумажный беззольный фильтр. Для большинства осадков используют фильтры со средним размером пор («белая лента»). Для мелкокристаллических осадков используют плотные фильтры («синяя лента»). Для того чтобы фильтрование происходило с приемлемой скоростью, вначале через фильтр пропускают прозрачную надосадочную жидкость и только затем количественно переносят
осадок на фильтр с помощью стеклянной палочки с резиновым наконечником (рис. 11.4.).
Промывание осадка
Состав жидкости, которую используют для промывания, зависит от свойств осадка. Малорастворимые кристаллические осадки промывают горячей дистиллированной водой. Для уменьшения растворимости осадка к промывной жидкости может быть добавлен осадитель. Если осадок склонен к пептизации, к промывной жидкости прибавляют летучий сильный электролит (NH4NO3, NH4Cl). Осадок обычно промывают несколько раз малыми порциями (10-20 мл) промывной жидкости.
Получение гравиметрической формы
Гравиметрическую форму получают из осаждаемой путём высушивания либо высушивания и прокаливания. Процесс ведут до постоянной массы – до тех пор, пока разность между двумя взвешиваниями не будет превышать 2 10-4 г
135

Раздел 2
Осадки органических соединений или осадки, полученные в результате реакций с органическими осадителями, обычно высушивают в сушильном шкафу при определённой температуре. Осадки неорганических веществ, как правило, прокаливают. При высушивании до постоянной массы вещество помещают в бюкс. При проведении прокаливания осадок вместе с фильтром помещают в тигель. Прокаливание проводится в муфельной печи.
Используемая посуда (тигли, бюксы, выпарительные чашки) должна быть предварительно доведена до постоянной массы.
Измерение массы гравиметрической формы
Измерение массы гравиметрической формы проводят после того, как температура осадка сравняется с температурой окружающей среды. До достижения этого момента тигель (бюкс) с осадком должен находиться в эксикаторе.
Расчёт результата анализа
Пример 11.1. Навеску мази массой 2,3426 г, содержащей ZnO, обработали кислотой. Ионы Zn2+, перешедшие в раствор, осадили в виде ZnNH4PO4. При прокаливании полученного осадка был получен Zn2P2O7 массой 0,4450 г. Рассчитайте массовую долю ZnO в мази.
В основу данного гравиметрического определения положен следующий процесс
81,39 |
304,72 |
|
|
|
|
|
|||||
г/моль |
г/моль |
|
|
|
|
|
|||||
2ZnO → Zn2P2O7 |
|
|
|
|
|||||||
определяемое вещество |
гравиметрическая форма (a = 0,4450 г) |
||||||||||
ω(ZnO) = |
2 0,4450 81,39 |
100% = 10,15% |
|
||||||||
304,72 2,3426 |
|
||||||||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
||
или в общем виде |
ω= |
νопр Mопр |
a |
100% = |
F a |
100% |
, |
||||
νгрм Mгрм g |
g |
||||||||||
|
|
|
|
|
|
|
|||||
где F = |
νопр |
Mопр |
– фактор пересчёта |
|
|
||||||
νгрм |
Mгрм |
|
|
||||||||
|
|
|
|
|
|
|
|||||
Чем меньше величина этого фактора, тем выше чувствительность гравиметрического определения.
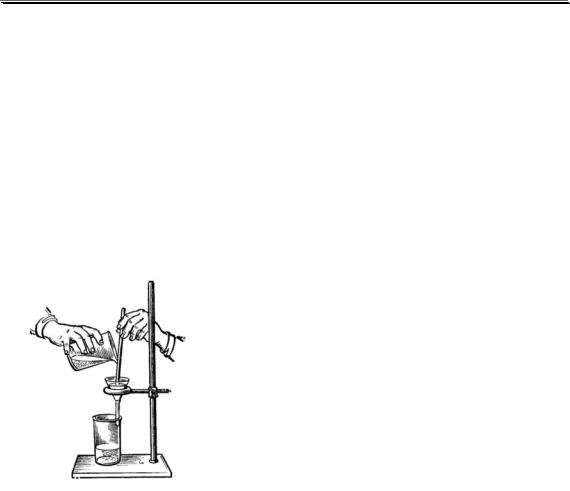
11.7. Гравиметрия в фармацевтическом анализе
Гравиметрические методики положены в основу определения влажности и зольности лекарственных веществ и лекарственного рас-
136
Химические методы анализа
тительного сырья. В фитохимическом анализе гравиметрически (метод выделения) определяют экстрактивные вещества в лекарственном растительном сырье. Гравиметрическое определение Na2SO4 (данное вещество используется в качестве слабительного средства) основано на реакции получения BaSO4.
Известны методики гравиметрического определения органических лекарственных веществ, основанные на проведении различных химических реакций. Например:
|
HO |
N |
|
|
|
O |
|
|
|
|
|
||
|
H3CO |
|
фенобарбитал- HCl |
H |
N |
C6H5 |
хинина |
NaOH |
|
|
C2H5 |
||
|
натрий |
|
|
|||
гидрохлорид |
N |
|
O |
|
N O |
|
|
|
|
||||
|
получение осадка |
|
получение осадка |
|
H |
|
|
основания |
|
кислоты |
|
|
|
кислотно-основные реакции
ГРАВИМЕТРИЧЕСКИЕ ОПРЕДЕЛЕНИЯ В ФАРМАЦЕВТИЧЕСКОМ АНАЛИЗЕ
|
образование малорастворимых |
реакции синтеза |
|
||
|
|
|
солей |
|
|
|
|
|
|
|
|
|
пиперазина |
|
прогестерон |
|
|
|
|
адипинат |
|
2,4-динитрофенилгидразин |
|
|
|
|
|
||
|
|
пикриновая кислота |
|
|
|
H |
H |
O2N |
|
N NH |
NO2 |
|
N |
|
|
|
|
|
N |
O |
NO2 |
O2N |
|
|
|
|
|
|
|
H |
H |
O2N |
2 |
|
|
N
NH NO2
O2N
137
