- •119 Общие вопросы аналитической химии раздел 1
- •Глава 1
- •1.1. Предмет аналитической химии
- •1.2. Принцип, метод и методика анализа
- •1.3. Виды анализа
- •1.4. Методы аналитической химии
- •Глава 2
- •Первая аналитическая группа катионов
- •Вторая аналитическая группа катионов
- •Систематический анализ смеси Cl-, Br-, I- - ионов
- •Глава 3
- •3.2. Активность и коэффициент активности
- •Активность (a) -такая концентрация вещества в растворе, при использовании которой свойства данного раствора могут быть описаны теми же уравнениями, что и свойства идеального раствора.
- •0,100 Моль/л
- •0,100 Моль/л
- •3.4. Виды констант химического равновесия, используемые в аналитической химии в аналитической химии используются
- •3.5. Общие принципы расчёта состава равновесных систем
- •Уравнение материального баланса основано на том, что число атомов определённого элемента (или групп атомов определённого вида) в изолированной системе остаётся неизменным.
- •Глава 4
- •4.1. Важнейшие теории кислот и оснований
- •4.3. Влияние растворителя на кислотно-основные свойства растворённого вещества
- •4.4. Нивелирующее и дифференцирующее действие растворителя. Сильные и слабые кислоты и основания
- •Растворы амфолитов
- •4.6. Расчёт состава равновесных смесей протолитов при заданном значении рН
- •4.7. Кислотно-основные буферные растворы
- •Глава 5
- •5.1. Понятие о комплексном соединении
- •5.2. Классификация комплексных соединений
- •5.3. Равновесия в растворах комплексных соединений
- •Природа комплексообразователя и лигандов
- •Концентрация реагентов
- •Ионная сила
- •Температура
- •Побочные реакции
- •Глава 6
- •6.1. Произведение растворимости малорастворимого электролита
- •6.2. Растворимость
- •7,210-4Моль/л
- •6.3. Влияние различных факторов на растворимость Природа растворяемого вещества и растворителя
- •Температура
- •Ионная сила
- •Общий (одноименный) ион
- •Побочные реакции
- •6.4. Общие принципы растворения осадков малорастворимых электролитов
- •Глава 7
- •Электродные потенциалы
- •Уравнение Нернста
- •7.3. Влияние различных факторов на протекание окислительно-восстановительных реакций Температура
- •Посторонние ионы
- •Влияние рН
- •Образование малорастворимых соединений
- •7.4. Расчёт различных констант с использованием электродного потенциала
- •Глава 8
- •8.1. Отбор пробы
- •8.2. Разложение пробы
- •Глава 9
- •9.2. Жидкость - жидкостная экстракция
- •9.2.2. Экстракционные системы и экстрагенты
- •9.2.4. Влияние различных факторов на процесс экстракции
- •Слабые основания
- •Амфолиты
- •Присутствие сильных электролитов
- •Сложение и вычитание
- •Деление и умножение
- •Другие операции
- •10.2. Понятие об аналитическом сигнале
- •10.3. Методы расчёта концентрации вещества по величине аналитического сигнала
- •Метод градуировочного графика
- •Метод стандартов
- •10.4. Неопределённость и погрешности измерений
- •10.5. Некоторые основные положения математической статистики, используемые в аналитической химии
- •10.7. Основные характеристики методики анализа
- •Воспроизводимость
- •Правильность
Первая аналитическая группа катионов
К первой аналитической группе катионов относятся катионы K+,Na+,NH4+,Li+. Группового реагента данные катионы не имеют. Ионы аммония и калия образуют малорастворимые гексанитрокобальтаты, перхлораты, хлорплатинаты, а также малорастворимые соединения с некоторыми крупными органическими анионами, например, дипикриламином, тетрафенилборатом, гидротартратом и др. Водные растворы солей катионовIгруппы, за исключением солей, образованных окрашенными анионами, бесцветны.
Гидратированные ионы K+,Na+,Li+являются очень слабыми кислотами, более выражены кислотные свойства уNH4+(рКa= 9,24). Несклонны к реакциям комплексообразования. В окислительно-восстановительных реакциях ионыK+,Na+,Li+не участвуют, так как имеют постоянную и устойчивую степень окисления, ионыNH4+обладают восстановительными свойствами.
Обнаружение катионов Iаналитической группы проводят по следующей схеме
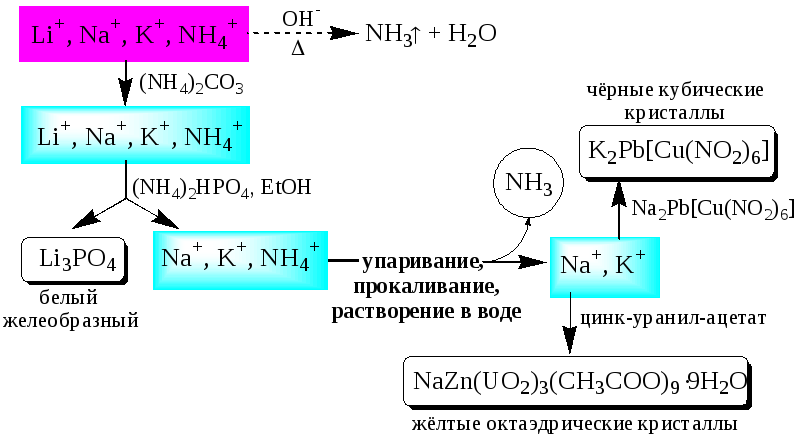
Обнаружению K+,Na+,Li+мешают катионы р- иd-элементов, которые удаляют, осаждая их (NH4)2CO3. ОбнаружениюK+ мешаетNH4+, который удаляют прокаливанием сухого остатка или связыванием с формальдегидом:
4 NH4+ + 6CHOH + 4ОН- (CH2)6N4 + 10H2O
Вторая аналитическая группа катионов
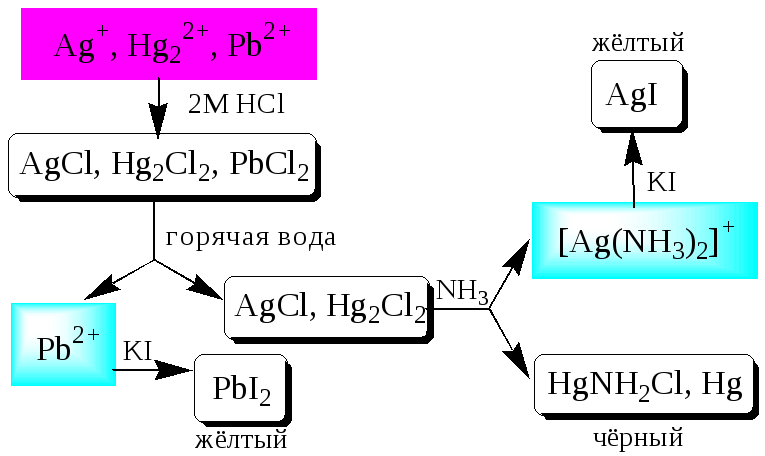
Ко второй аналитической группе относятся катионы Ag+,Pb2+иHg22+. Катионы данной группы образуют малорастворимые гидроксиды, хлориды, хроматы, карбонаты, сульфаты, сульфиды, иодиды, арсенаты, арсениты. Большинство солей в растворе бесцветны. Окрашены хроматы, дихроматы, иодиды, сульфиды и др. В присутствии восстановителей ионыAg+иHg22+восстанавливаются до элементарного состояния. Сильные окислители окисляютPb2+вPb(IV),Hg22+ вHg2+. Катионы данной группы склонны к образованию комплексных соединений. Групповым реагентом является хлороводородная кислота, осаждающаяAg+,Pb2+иHg22+в виде белых осадковAgCl,Hg2Cl2,PbCl2. ОсадокAgClтемнеет на свету в результате восстановленияAg+доAg. ОсадокAgClрастворим в концентрированных растворахHClи хлоридов и легко растворяется в раствореNH3. ОсадокHg2Cl2 при действииNH3 чернеет вследствие образованияHg. ОсадокPbCl2растворяется в избыткеHClи хлорид-ионов, а также в горячей воде.
Схема систематического анализа:
Третья аналитическая группа катионов
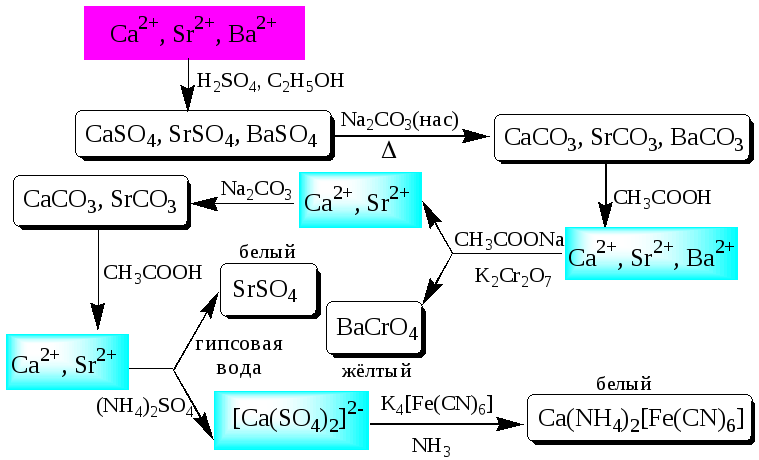
К третьей аналитической группе относятся катионы Ca2+,Sr2+иBa2+. Образуют малорастворимые карбонаты, сульфаты, хроматы, фосфаты, оксалаты, фториды. В водных растворах бесцветны. К реакциям комплексообразования несклонны. Степень окисления постоянна и равна +2. Групповым реагентом является разбавленнаяH2SO4. Осадки сульфатов не растворяются в кислотах и щелочах. Для полноты осаждения к раствору прибавляют этанол.
Схема систематического анализа:
Четвёртая аналитическая группа катионов
К четвёртой аналитической группе относятся катионы Al3+,Cr3+,Zn2+. Образуют малорастворимые гидроксиды, фосфаты, карбонаты, сульфиды. Сульфиды и карбонаты алюминия и хрома при взаимодействии с водой образуют гидроксид металла иH2S(сульфиды) илиCO2(карбонаты). В водных растворах катионы данной группы, за исключением [Cr(H2O)6]3+, бесцветны. Гидратированные катионы четвёртой группы обладают выраженными кислотными свойствами. Образуют комплексные соединения, например, [Al(OH)4]-. ИоныAl3+иZn2+имеют постоянную степень окисления. ИоныCr3+могут участвовать в окислительно-восстановительных реакциях. Групповым реагентом являетсяNaOH, в избытке которого гидроксиды катионов четвёртой аналитической группы, обладающие амфотерными свойствами, растворяются с образованием комплексных соединений типа [Al(OH)4]-, [Cr(OH)4]-, [Zn(OH)4]2-.
Схема систематического анализа
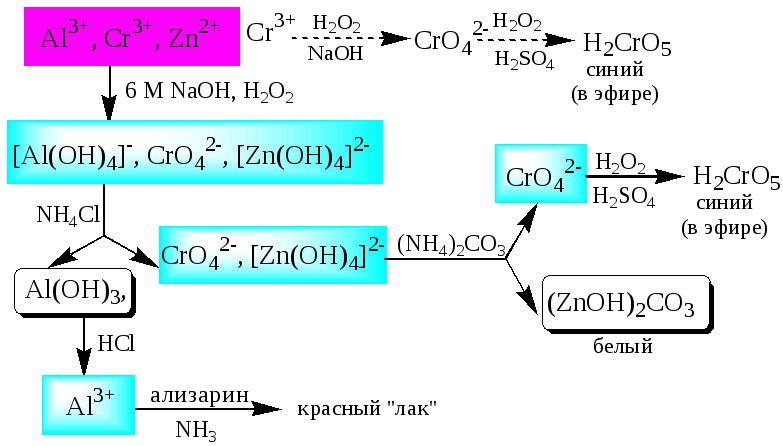
Пятая аналитическая группа катионов
К пятой аналитической группе относятся катионы Mg2+,Mn2+,Fe2+,Fe3+,Bi3+,Sb(III) иSb(V). Образуют малорастворимые гидроксиды, карбонаты, сульфиды (кромеMg2+), фосфаты. Растворы солей магния, висмута (III) и сурьмы (III,V) бесцветны. Растворы солейFe(II) имеют бледно-зелёную окраску,Fe(III) - от жёлтой до коричневой (вследствие образования гидроксокомплексов) иMn(II) - бледно-розовую окраску. Разбавленные растворы солейFe(II) иMn(II) бесцветны. ИоныFe2+,Fe3+,Bi3+,Sb(III) иSb(V) способны образовывать комплексные соединения, например, [Fe(CN)6]3-,Fe(CN)6]4-, [SbCl6]3-, [SbCl6]-, [BiI4]-. Все катионы данной группы (кромеMg2+) проявляют окислительно-восстановительные свойства:Fe3+,Bi3+,Sb(V) - окислители;Fe2+,Sb(III) - восстановители. Групповым реагентом является растворNH3, от действия которого выпадают в осадок гидроксиды: белыеMg(OH)2,Mn(OH)2,Fe(OH)2,Bi(OH)3,Sb(OH)3,SbO(OH)3и красно-бурыйFe(OH)3. ОкраскаFe(OH)2cтечением времени изменяется до зелёной, а затем образуется красно-бурыйFe(OH)3. Осадки гидроксидов растворяются в кислотах и не растворяются в избытке щёлочи и аммиака.
Схема систематического анализа
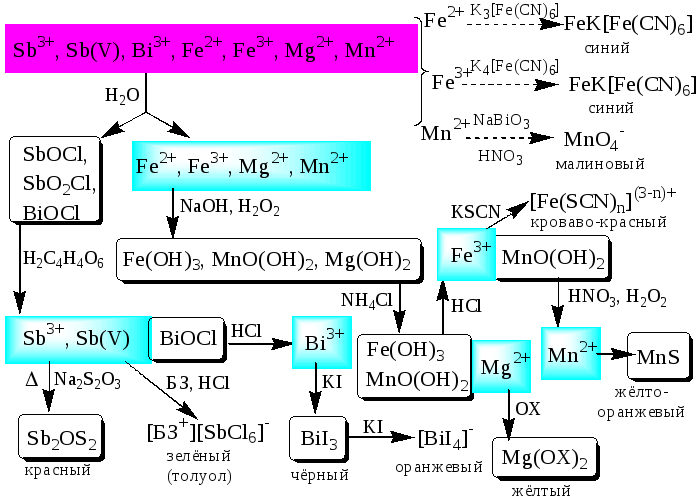
Шестая аналитическая группа катионов
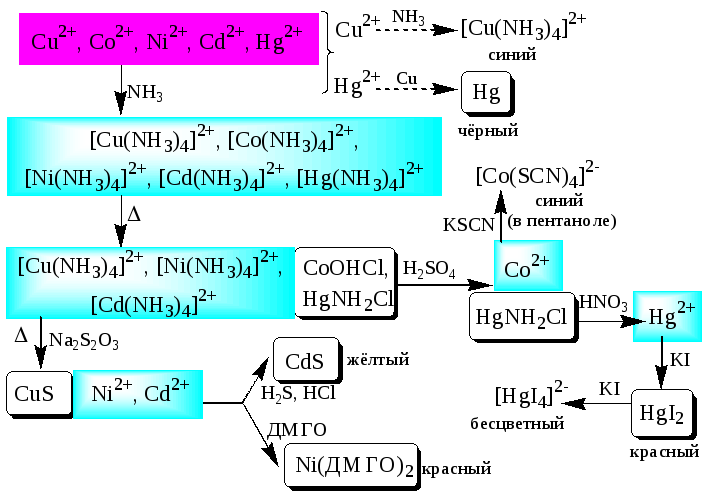
К шестой аналитической группе относятся катионы Cu2+,Co2+,Cd2+,Ni2+иHg2+. Образуют малорастворимые сульфиды, карбонаты, оксалаты, фосфаты, арсенаты, силикаты, хроматы, иодиды меди (I) и ртути (II). Большинство растворимых в воде солей окрашены: соли никеля - зелёные, кобальта - красные, меди - синие. Характерным свойством катионовVIгруппы является способность образовывать комплексные соединения, в том числе внутрикомплексные соединения с органическими реагентами. Все катионыVIаналитической группы, за исключениемCd2+, участвуют в реакциях окисления-восстановления. ИоныHg2+иCu2+проявляют себя как окислители, ионыCo2+иNi2+- как восстановители. Групповым реагентом является растворNH3. Гидроксиды катионов данной группы растворяются в избытке аммиака с образованием окрашенных аммиачных комплексов (катион тетраамминртути – бесцветный).
Схема систематического анализа
2.4. Общая характеристика, классификация и способы обнаружения анионов
Реакции обнаружения анионов могут быть основаны на их окислительно-восстановительных свойствах, способности образовывать малорастворимые соединения, а также на взаимодействии с кислотами с образованием газообразных продуктов. Классификации анионов не является строго установленными. Например, в зависимости от растворимости солей бария и серебра анионы разделяют на:
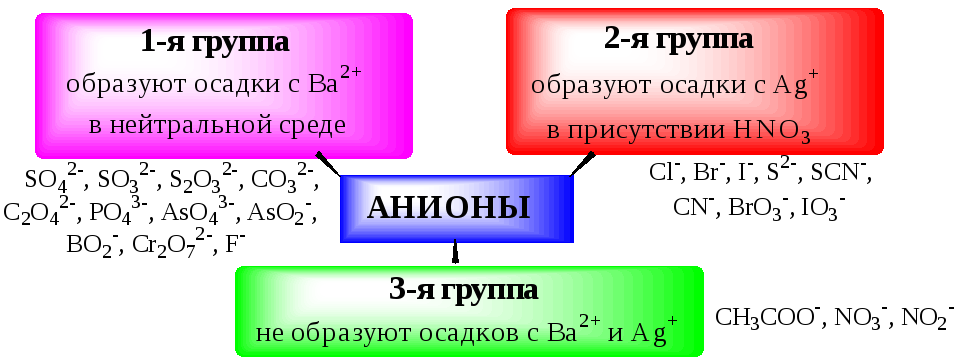
По окислительно-восстановительным свойстваманионы можно разделить на следующие группы:

Анионы обычно обнаруживают дробным методом, и групповые реагенты используют только для установления наличия или отсутствия анионов той или иной группы. Обнаружение некоторых анионов может проводиться систематическим методом:
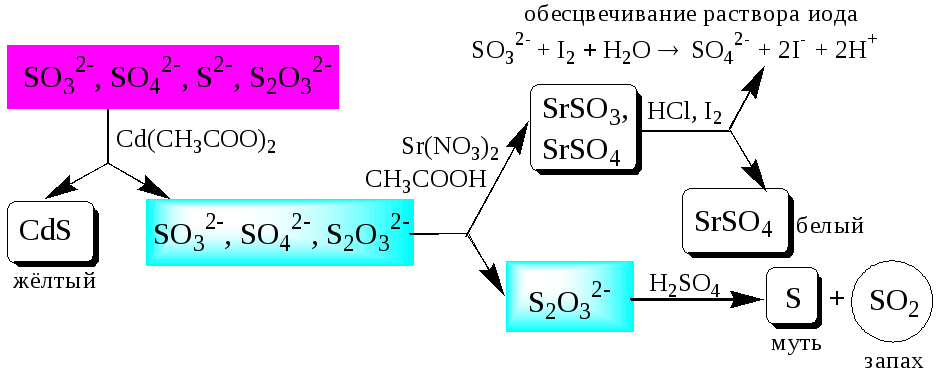
Систематический анализ смеси серусодержащих анионов