
- •119 Общие вопросы аналитической химии раздел 1
- •Глава 1
- •1.1. Предмет аналитической химии
- •1.2. Принцип, метод и методика анализа
- •1.3. Виды анализа
- •1.4. Методы аналитической химии
- •Глава 2
- •Первая аналитическая группа катионов
- •Вторая аналитическая группа катионов
- •Систематический анализ смеси Cl-, Br-, I- - ионов
- •Глава 3
- •3.2. Активность и коэффициент активности
- •Активность (a) -такая концентрация вещества в растворе, при использовании которой свойства данного раствора могут быть описаны теми же уравнениями, что и свойства идеального раствора.
- •0,100 Моль/л
- •0,100 Моль/л
- •3.4. Виды констант химического равновесия, используемые в аналитической химии в аналитической химии используются
- •3.5. Общие принципы расчёта состава равновесных систем
- •Уравнение материального баланса основано на том, что число атомов определённого элемента (или групп атомов определённого вида) в изолированной системе остаётся неизменным.
- •Глава 4
- •4.1. Важнейшие теории кислот и оснований
- •4.3. Влияние растворителя на кислотно-основные свойства растворённого вещества
- •4.4. Нивелирующее и дифференцирующее действие растворителя. Сильные и слабые кислоты и основания
- •Растворы амфолитов
- •4.6. Расчёт состава равновесных смесей протолитов при заданном значении рН
- •4.7. Кислотно-основные буферные растворы
- •Глава 5
- •5.1. Понятие о комплексном соединении
- •5.2. Классификация комплексных соединений
- •5.3. Равновесия в растворах комплексных соединений
- •Природа комплексообразователя и лигандов
- •Концентрация реагентов
- •Ионная сила
- •Температура
- •Побочные реакции
- •Глава 6
- •6.1. Произведение растворимости малорастворимого электролита
- •6.2. Растворимость
- •7,210-4Моль/л
- •6.3. Влияние различных факторов на растворимость Природа растворяемого вещества и растворителя
- •Температура
- •Ионная сила
- •Общий (одноименный) ион
- •Побочные реакции
- •6.4. Общие принципы растворения осадков малорастворимых электролитов
- •Глава 7
- •Электродные потенциалы
- •Уравнение Нернста
- •7.3. Влияние различных факторов на протекание окислительно-восстановительных реакций Температура
- •Посторонние ионы
- •Влияние рН
- •Образование малорастворимых соединений
- •7.4. Расчёт различных констант с использованием электродного потенциала
- •Глава 8
- •8.1. Отбор пробы
- •8.2. Разложение пробы
- •Глава 9
- •9.2. Жидкость - жидкостная экстракция
- •9.2.2. Экстракционные системы и экстрагенты
- •9.2.4. Влияние различных факторов на процесс экстракции
- •Слабые основания
- •Амфолиты
- •Присутствие сильных электролитов
- •Сложение и вычитание
- •Деление и умножение
- •Другие операции
- •10.2. Понятие об аналитическом сигнале
- •10.3. Методы расчёта концентрации вещества по величине аналитического сигнала
- •Метод градуировочного графика
- •Метод стандартов
- •10.4. Неопределённость и погрешности измерений
- •10.5. Некоторые основные положения математической статистики, используемые в аналитической химии
- •10.7. Основные характеристики методики анализа
- •Воспроизводимость
- •Правильность
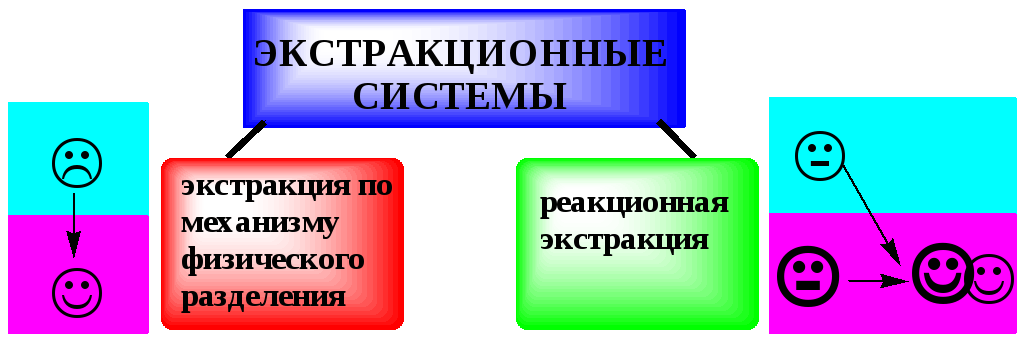
9.2.2. Экстракционные системы и экстрагенты
Все экстракционные системы можно разделить на 2 группы
В первом типе экстракционных систем разделение происходит в результате разности энергий сольватации и гидратации экстрагирующегося вещества. В органическую фазу переходят вещества, которые плохо гидратируются в водных растворах. Обычно это незаряженные соединения с крупными неполярными молекулами. Наличие гидрофильных групп в молекуле вещества уменьшает его способность экстрагироваться неполярным органическим растворителем, в то время как крупные углеводородные остатки увеличивают эту способность.
В гомологическом ряду с увеличением числа атомов углерода (n) способность вещества экстрагироваться неполярным растворителем повышается, причёмlgP0линейно зависит отn(рис. 9.1).
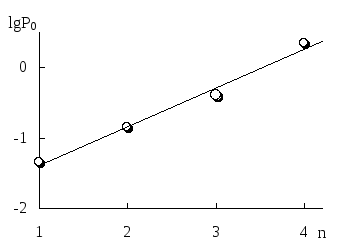
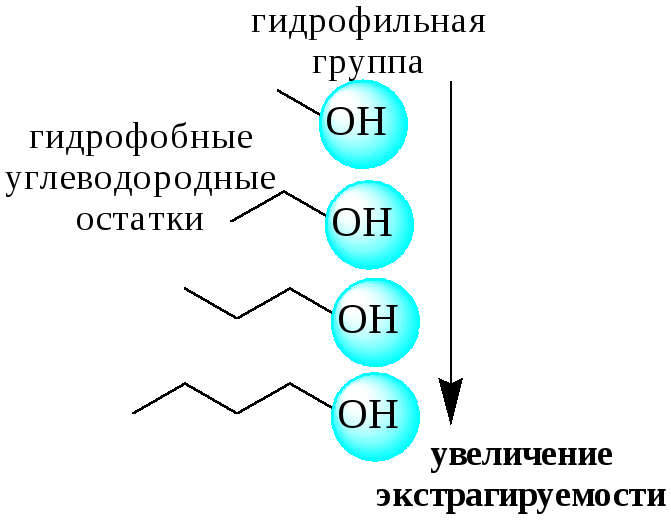
Рис. 9.1. Изменение экстрагируемости в гомологическом ряду н-алканолов в системе хлороформ-вода
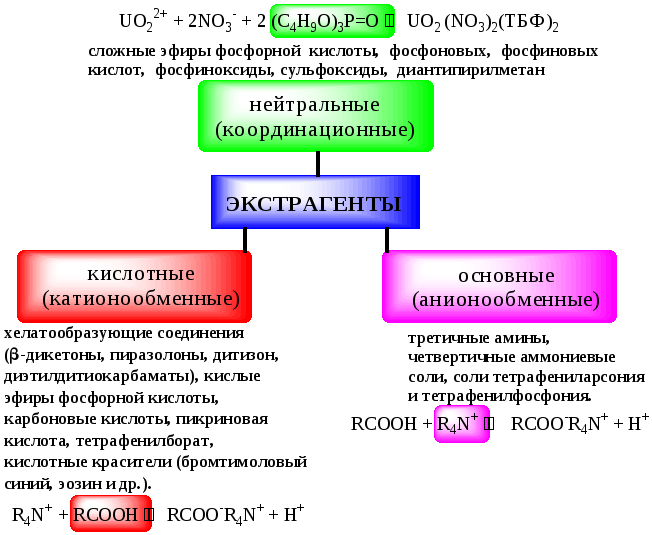
В основе реакционной экстракции лежит взаимодействие вещества с экстрагентом с образованием соединения, которое экстрагируется лучше, чем исходное вещество. В зависимости от кислотно-основных свойств экстракционные реагенты обычно разделяют на
9.2.4. Влияние различных факторов на процесс экстракции
Основными факторами, влияющими на процесс экстракции, являются:
![]() природа
экстрагируемого вещества и экстрагента,
природа
экстрагируемого вещества и экстрагента,
![]() температура,
температура,
![]() рН,
рН,
![]() соотношение
объёмов водной и органической фаз,
соотношение
объёмов водной и органической фаз,
![]() методика
проведения экстракции,
методика
проведения экстракции,
![]() присутствие
электролитов в водной фазе.
присутствие
электролитов в водной фазе.
рН
Величина рН влияет на экстракцию соединений, склонных к ионизации. Заряженные частицы гидратируются значительно лучше, чем нейтральные молекулы, а последние, в свою очередь, лучше сольватируются неполярными органическими растворителями. Поэтому, как правило, нейтральные молекулы экстрагируются значительно лучше, чем ионы.
Слабые кислоты
![]()
![]()
При рН < pKa- 2 более 99% кислоты будет находиться в неионизированном состоянии (DP0), поэтому при таких значениях рН кислота будет хорошо экстрагироваться неполярным растворителем. При рН > pKa+ 2 более 99% кислоты будет находиться в ионизированном состоянии. Эта область рН неблагоприятна для экстракции.
Слабые основания
![]()
![]()
Максимальная экстракция происходит при рН > pKBH+ + 2, а при рН < pKBH+ - 2 слабые основания будут плохо экстрагироваться неполярным растворителем.
Амфолиты
![]()
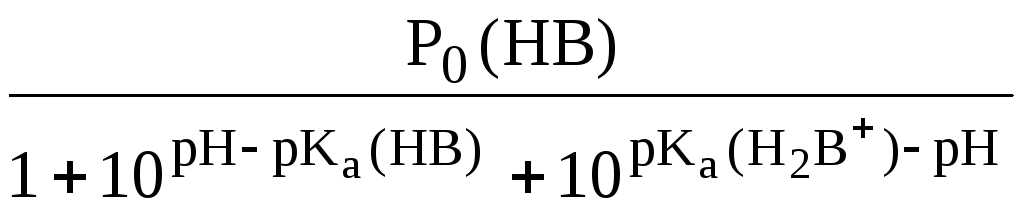
Экстракция амфолита максимальна в изоэлектрической точке.
Примеры зависимости коэффициентов распределения слабых кислот, оснований и амфолитов от рН показаны на рис. 9.2.
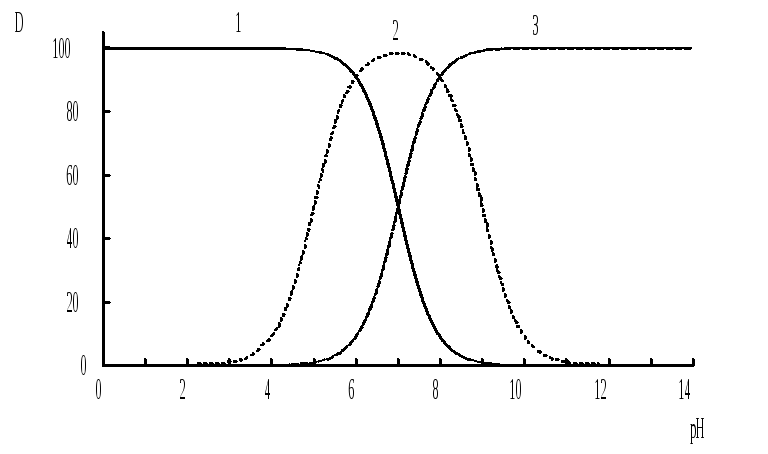
Рис. 9.2 Зависимость коэффициента распределения слабой кислоты (1), амфолита (2) и слабого основания (3) от рН
Po(неионизированной формы) =100, Po(ионизированной формы) 0;
pKa =7, pKBH+ = 7; амфолит (pKa =5, pKBH+ = 9).
Объём экстрагента
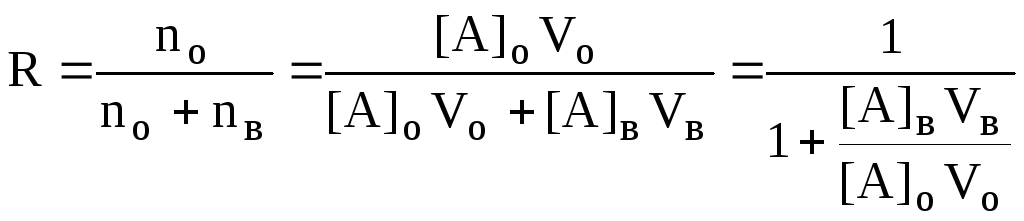
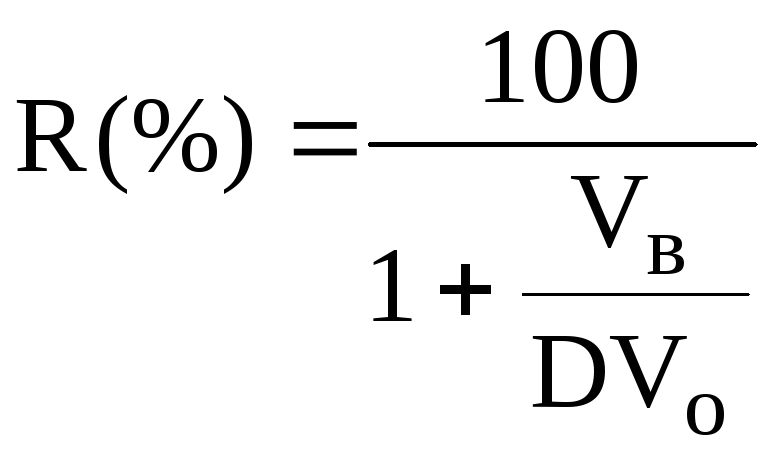
При увеличении соотношения Vв/Voстепень однократной экстракции уменьшается. Например, для того чтобы при однократной экстракции экстрагировалось 99% вещества, имеющего D = 5, объём экстрагента должен быть приблизительно в 20 раз больше объёма водной фазы. Если их объёмы будут равными, величинаRсоставит 83%.
Экстрагент можно добавлять не одномоментно, а в виде нескольких порций. В этом случае эффективность экстрагирования будет повышаться. Пусть к водной фазе добавлена первая порция экстрагента. После первой экстракции останется непроэкстрагированным
![]() =
=
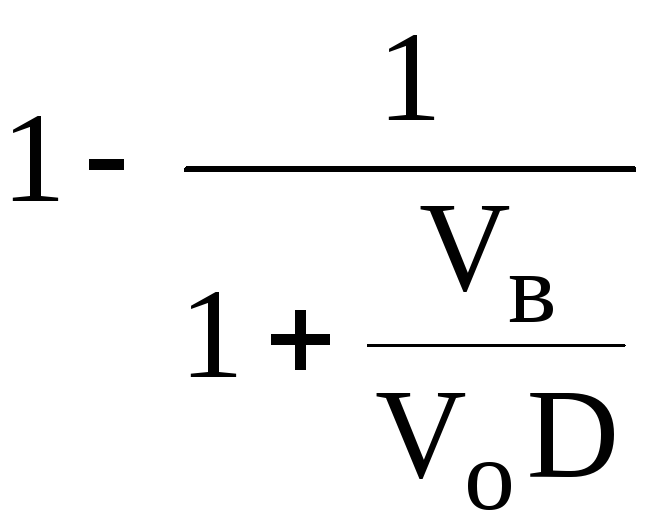 =
=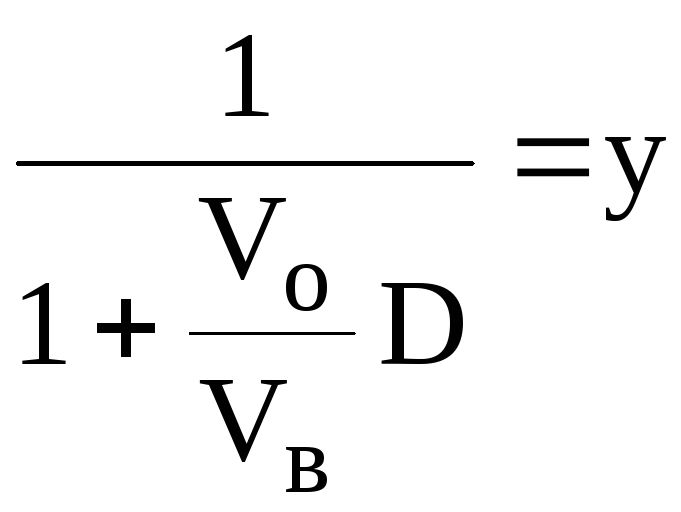
После второй экстракции останется (1-R) от y, т.е. y2. После n-экстракции yn.
![]() =
=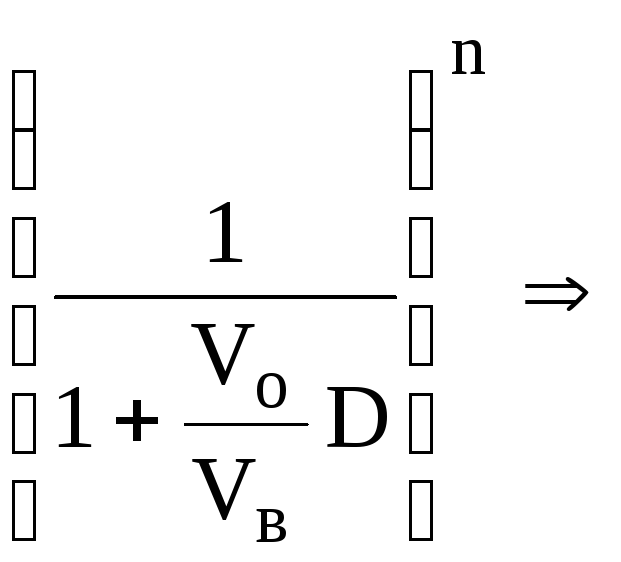 Rn= 1 -
Rn= 1 -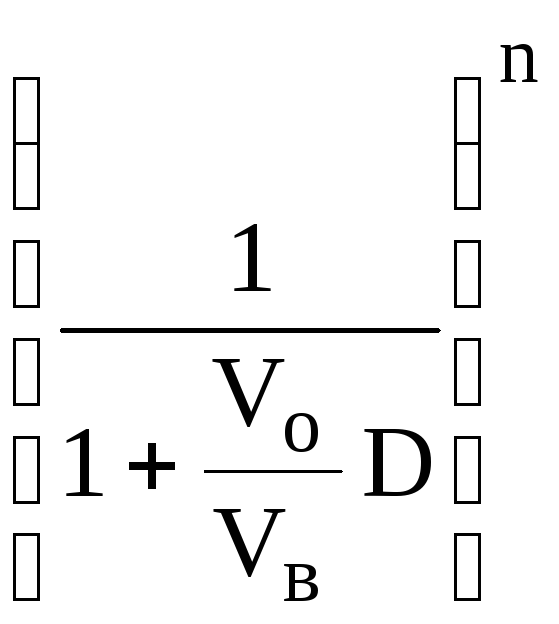
Для того чтобы экстрагировать 99% вещества, имеющего D = 5, из 10 мл водной фазы, необходимо провести 3 экстракции порциями экстрагента по 10 мл (т.е. затратить всего лишь 30 мл экстрагента, что в 6 раз меньше, чем при однократной экстракции).
Выбор приёма экстракции (однократная большим объёмом экстрагента или многократная малыми объёмами) зависит от конкретных условий. Если необходимо сэкономить экстрагент, то предпочтительнее второй вариант, если время (или важна хорошая воспроизводимость результатов), то первый.
