
Методички и вопросы по истории / Методички / Рухляда Н.Я., Прокурат Т.Э., Станковский А.Ю
..pdfe Eуск λ << ∆E2 ,
где λ – характерная длина свободного пробега электрона, Eуск – напряженность ускоряющего электрического поля между катодом и сеткой. Если это условие выполняется, то электроны в промежутках между столкновениями не успевают набрать энергию, необходимую для перехода на второй возбужденный уровень.
Данная лабораторная работа конструктивно реализована в двух вариантах, которые отличаются как используемым в лампе инетрным газом, так и способом снятия вольтамперной характеристики. Далее описание установки и выполнение измерений приводятся отдельно для лампы с аргоном (вариант А), и отдельно для лампы с криптоном (вариант Б).
Выполнение работы на установке А Описание установки
Принципиальная схема установки показана на рис. 3. Манометрическая лампа ПМИ-2 наполнена аргоном с давлением P ≈ 1 мм. рт. ст. Прямонакальный катод лампы подключен к источнику постоянного тока Б5-47 с напряжением накала 7.1 В (переменное напряжение накала вносило бы дополнительные флуктуации в анодный ток). Напряжение 50 В подается с источника Б5-49. С помощью резисторов R1 и R2 можно плавно менять ускоряющее напряжение между катодом и сеткой от 0 до 50 В (второй резистор необходим для плавной регулировки напряжения). Задерживающее напряжение, подаваемое с источника УИП-2 с помощью резистора R3 , можно менять в пределах от 0 до 6 В.
Порядок выполнения работы
Внимание! Режим работы установки – прерывистый. Через каждые 1,5–2 ч делается перерыв на 10–15 мин.
Собрать установку в соответствии со схемой, показанной на рис. 3. Подключить вольтметр к клеммам 2–5 и установить при помощи сопротивления R3 значение задерживающего напряжения по указанию преподавателя (в пределах 3–6 В). Перебросить проводник с клеммы 5 на клемму 1 (для измерения Uуск ) и меняя плавно с помощью резисторов R1 и R2 ускоряющее напряжение, убедиться в наличии минимумов в ВАХ.
21
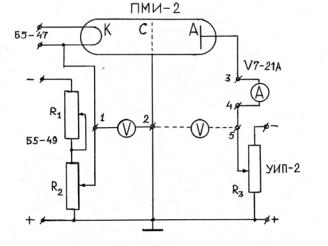
Рис. 3. Принципиальная схема лабораторной установки (вариант А)
Снять зависимость анодного тока от ускоряющего напряжения, изменяя Uуск на 1 В в пределах от 0 до 50 В, записывая значения анодного тока и напряжения в таблицу. Особенно тщательно следует определить положение максимумов и минимумов на ВАХ.
Проделать измерения еще раз для другого рекомендованного значения Uз.
Обработка результатов измерений
Построить график зависимости анодного тока от ускоряющего напряжения. Вычислить 1-й потенциал возбуждения аргона по положениям максимумов и минимумов согласно рис. 2 в. Оценить погрешность измерения потенциала возбуждения аргона и сравнить полученное значение со справочными данными.
Построить аналогичный график и вычислить потенциал возбуждения для другого значения, задерживающего напряжения.
Выполнение работы на установке Б
Описание установки
В этом варианте установка состоит из следующих элементов: трехэлектродной лампы ПМИ-2, заполненной криптоном и помещенной в металлический кожух; электронного блока управления и индикации напряжения; электронного осциллографа. Принципи-
22
альная схема установки аналогична изображенной на рис. 3 с тем отличием, что все необходимые напряжения формируются в блоке управления, и по кабелю подаются на лампу. Схематическое изображение соединения блоков установки показано на рис. 4.
Объект
исследования
Устройство из- |
|
|
|
Осциллограф |
|
мерительное |
|
|
|
|
|
Рис. 4. Блок-схема установки Б
Блок управления формирует пилообразное напряжение, выполняющего роль переменного ускоряющего напряжения, подаваемого на участок лампы катод-сетка. Кроме этого, блок управления подает фиксированное задерживающее напряжение на участок сеткаанод, а также формирует переменное напряжение, мгновенное значение которого пропорционально силе анодного тока в каждый момент времени. Это напряжение подается на вход Y осциллографа, на экране которого формируется график вольтамперной характеристики. На лицевой панели блока управления размещены две ручки потенциометра «метка» ГРУБО и ТОЧНО, регулирующие на экране осциллографа положение короткого вертикального импульса – метки, а также цифровой индикатор напряжения между катодом и сеткой, при котором формируется метка. С помощью ручек ГРУБО и ТОЧНО можно перемещать маркер по осциллограмме, при совмещении левого края маркера с характерными точками (максимумами или минимумами) можно на цифровом индикаторе напряжения измерить соответствующее значение ускоряющего напряжения между катодом и сеткой.
Порядок выполнения работы
1. Вход Y осциллографа необходимо подключить к блоку управления. На осциллографе задать режим внешней синхронизации и подключить вход синхронизации осциллографа к блоку управления. Газонаполненная лампа подключена к блоку управления стационарно и дополнительные подключения не нужны.
23
2.Включить блок управления кнопкой «сеть» и дать установке прогреться не менее 5 мин.
3.Установить на осциллографе развертку 5 ms/дел. и усиление
0.5В/дел. Включить осциллограф, добиться устойчивого изображения вольтамперной характеристики лампы. На вольтамперной характеристике должны появиться три четко выраженных максимума и три минимума.
4.С помощью ручек ГРУБО и ТОЧНО переместить маркер по осциллограмме до совпадения левого края маркера с положением первого максимума, записать значение ускоряющего напряжения по индикатору напряжения на панели блока управления. Далее аналогичным образом снять показание для положения первого минимума и значения ускоряющих напряжений для последующих максимумов и минимумов. После проведения первой серии измерений для вольтамперной характеристики в таблице должны быть записаны шесть значений ускоряющего напряжения, с указанием номера соответствующего максимума и минимума. Далее следует повторить еще четыре раза серию измерений положений экстремумов, в результате измерений в таблице для каждого экстремума должно быть пять значений ускоряющего напряжения.
Обработка результатов измерений
Для каждого максимума и минимума вычислить среднее значение напряжения. Используя средние значения напряжений для положений соседних максимумов вычислить два значения первого потенциала возбуждения и среднее по этим значениям. Аналогично вычислить потенциал возбуждения по положениям минимумов. Сравнить вычисленные значения с табличной величиной первого потенциала возбуждения для криптона.
Контрольные вопросы
1.Сформулируйте постулаты Бора для атома водорода.
2.Какое состояние в атоме называется основным? Какие состояния называются возбужденными? Что называется энергией перехода? Сформулируйте определение потенциала возбуждения.
3.Какие столкновения называются упругими и какие неупругими? Как меняется энергия свободного электрона при упругом и неупругом столкновениях с атомом? Почему в формуле (2) можно
24
пренебречь кинетической энергией, полученной атомом при столкновении?
4.Что такое ускоряющее напряжение? Для чего в данном опыте
влампе должна быть область с задерживающим напряжением?
5.Объяснить, почему идеальная ВАХ газонаполненной лампы (рис. 2 б), отличается от ВАХ вакуумной лампы (рис. 2 а).
6.Почему на экспериментальной кривой ВАХ (рис. 2 в), максимумы и минимумы более сглажены по сравнению с кривой на рис. 2 б? Какие факторы приводят к сдвигу ВАХ вдоль горизонтальной оси? Как можно определить первый потенциал возбуждения по измеренной в опыте ВАХ?
7.Вывести формулу (1), используя законы сохранения энергии и импульса.
Литература
1.Савельев И.В. Курс общей физики. − М.: Наука, 1988. Т.3, §15.
2.Иродов И.Е. Квантовая физика. Основные законы. − М.− С.-Пб.:
Физматлит, 2001. (§2.3).
3.Матвеев А.Н. Атомная физика. − М.: Высшая школа, 1989. §12.
4.Сивухин Д.В. Общий курс физики. − М.: Наука,1983. – Т.V,
Ч. 1, §14.
5. Шпольский Э.В. Атомная физика. − М.: Наука,1974. – Т.1, §§91–93.
25

Работа № 3. ДУБЛЕТНОЕ РАСЩЕПЛЕНИЕ В СПЕКТРЕ АТОМА НАТРИЯ
ПРИБОРЫ И ПРИНАДЛЕЖНОСТИ:
гониометр-спектрометр ГС2, натриевая лампа, дифракционная решетка (d = 600 штрихов /мм).
ЦЕЛЬ РАБОТЫ
•Зная постоянную дифракционной решетки и измерив углы дифракции с помощью гониометра, определить длины волн желтых дублетных линий в спектре атома натрия.
•Используя значение энергии для уровня 3S, а также полученные длины волн желтого дублета вычислить энергию уровня 3P,
ридберговские поправки к уровням 3S, 3P и величину дублетного расщепления уровня 3P на подуровни 32P1/2 и 32P3/2 .
Краткая теория
Самой простой задачей атомной физики является задача о движении электрона в кулоновском поле ядра. С такой задачей мы встречаемся в атоме водорода. Обозначая заряд ядра через eZ, где e − элементарный заряд, а Z − номер элемента в системе Менделеева, мы получим, что потенциальная энергия электрона в поле такого ядра на расстоянии r от него будет равна
U (r) = − Z e2 . 4πε0r
Чтобы найти уровни энергии для рассматриваемого движения, нужно решить уравнение Шредингера для волновой функции ψ(r):
2Ψ(rr) + 2m [E −U (r)]Ψ(rr) = 0 , |
(1) |
h2 |
|
где m − масса электрона, E −− полная энергия. Конечное, непрерывное и однозначное решение ψ(r) уравнения (1) существует при следующих значениях энергии электрона
E |
= − |
Z 2e4m 1 |
= |
E1 |
, |
n=1, 2, 3,… |
(2) |
|||
|
|
|
|
|||||||
32πε0h2 n2 |
n2 |
|||||||||
n |
|
|
|
|
|
|||||
Число n называется главным квантовым числом и определяет энергию электрона, а E1=-13,6 эВ (1 эв=1,6 10-19 Дж) – величина энергии электрона на первом уровне. Систему энергетических
26

уровней принято называть и иначе – системой термов. Терм T(n) –
это величина, определяемая как T (n) = |
|
|
En |
|
|
. В отличие от энергии |
|
|
|||||
|
|
h |
|
|
||
|
|
|
|
|
|
En, терм – величина положительная. Терм имеет ту же размерность, что и частота. Частота света ω, излучаемого при переходе с уровня En1 на уровень En2 определяется из условия hω= En1 − En2 . Перехо-
дя от частоты к длине волны |
λ = |
2πc |
, получим |
|
||
ω |
|
|||||
2πc |
|
|
|
|
|
|
= |
1 |
(En1 − En2 ) . |
(3) |
|||
λ |
|
h |
|
|
|
|
Каждому квантовому уровню En принадлежат различные состояния, описываемые волновой функцией ψnlm(r). Орбитальное квантовое число l определяет момент импульса электрона
Ml = h l(l +1) и принимает значения l=0, 1, …, n-1. Магнитное
квантовое число m определяет проекцию момента импульса на некоторую ось и пробегает при заданном l значения m=0,±1, ±2,… ±l.
Смеханическим моментом электрона связан магнитный момент
µl = −µB Ml , где µB = 2emch − магнетон Бора.
Вщелочных металлах атом имеет один валентный электрон, а остальные Z-1 электронов образуют оболочку, имеющую сферическую симметрию. Внешний валентный электрон движется в цен- трально-симметричном поле ядра и оболочки U(r). Решение уравнения Шредингера для электрона в поле U(r) дает результат, аналогичный для водородного атома, но с тем отличием, что энергетические уровни зависят не только от главного квантового числа n, но и квантового числа l
Enl = − |
E1 |
|
(n +σ(l))2 . |
(4) |
Поправка σ(l) носит название ридберговской. При возбуждении атома щелочного металла и при испускании им света изменяется только состояние валентного электрона. Поэтому спектры атомов щелочных металлов и спектр атома водорода по внешнему виду сходны. Длины волн в этих спектрах описываются выражением (3), но для щелочных металлов в качестве энергии уровня необходимо
27

брать выражение (4). Момент импульса щелочного металла также равен моменту импульса его валентного электрона, так как момент импульса атомного остатка (остальных электронов) равен нулю.
На рис. 1 приведена схема уровней атома натрия. Величина орбитального момента обозначена буквами S(l=0), P(l=1), D(l=2), F(l=3). Уровень энергии (а также терм) в спектроскопии обозначается соответственно nS, nP, nD, nF. Излучение происходит в результате перехода валентного электрона с одного энергетического уровня En1l2 на другой уровень En2l2 :
|
|
|
2πc |
= |
1 |
(E |
|
− E |
|
|
) . |
(5) |
||||
|
|
|
λ |
h |
n1l1 |
n2l 2 |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
S |
|
|
|
P |
|
|
|
|
D |
|
F |
|||
L= |
0 |
|
|
|
|
1 |
|
|
|
|
2 |
3 |
|
|||
0 |
6 |
|
|
|
5 |
|
|
|
|
|
5 |
|
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
-1 |
5 |
|
|
|
|
|
|
|
|
4 |
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
4 |
|
|
|
|
|
3 |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
-2 |
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
-3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-5
3
Рис. 1. Схема уровней атома натрия
Однако не все переходы возможны. Разрешенными являются лишь переходы, для которых выполнено правило отбора ∆l = ±1, т.е. орбитальное квантовое число может измениться лишь на единицу (главное квантовое число − на любое значение).
Основным уровнем энергии в атоме натрия является 3S состояние (с энергией −5,14 эВ), поскольку состояния с n=1, 2 уже заняты остальными электронами, образующими остов.
Спектр излучения натрия состоит из нескольких частично перекрывающихся серий. Длина волны спектральной линии определяется согласно формуле (5), поэтому спектральные серии натрия могут быть представлены в следующем виде:
28

Серия |
Переход |
n |
Резкая |
nS-3P |
4,5,… |
Главная |
nP-3S |
3,4,… |
Диффузная |
nD-3P |
4,5,… |
Ближайшим по энергии к основному состоянию является состояние 3P. Линия излучения при переходе из 3P в 3S состояние является наиболее интенсивной. Длина волны этой линии (голов-
ная линия главной серии) определяется из условия: |
|
||||||
|
2πc |
= |
1 |
(E |
− E |
) . |
(6) |
|
λ |
h |
|||||
|
|
3P |
3S |
|
|
||
Эта линия лежит в видимом диапазоне длин волн (желтая линия). В видимой области лежит также и ряд других линий, но их относительная интенсивность мала. Зная энергию 3S состояния и длину волны перехода 3P-3S, можно из соотношения (6) определить энергию 3P состояния. Ридберговские поправки σ(3S) и σ(3P), соответствующие состояниям 3S и 3P, можно определить, воспользовавшись соотношением (4).
Исследование спектров щелочных металлов при помощи приборов с большой разрешающей силой показало, что каждая линия этих спектров является двойной (дублет). Так, например, характерная для натрия желтая линия 3P-3S состоит из двух линий (дублета) λ1 и λ2 (см. рис. 2). Структура спектра, отражающая расщепление линий на компоненты, называется тонкой структурой. Сложные линии, состоящие из нескольких компонент, называются мультиплетами. Расщепление спектральных линий обусловлено расщеплением энергетических уровней. Расщепление уровней можно объяснить наличием у электрона спина – собственного момента импульса Ms, не связанного с движением электрона в пространстве. Величина собственного момента импульса электрона определяется спиновым квантовым чис-
лом s=1/2 и равна Ms = h s(s +1) . Проекция собственного момента импульса электрона может принимать два значения ±(1/ 2) h . С моментом импульса Ms связан магнитный момент µs = −2µB Ms .
Рассмотрим теперь на качественном уровне как существование спина электрона может объяснить дублетное расщепление линий и оценим величину этого расщепления. Пространственное движение электрона создает магнитное поле B. Собственный магнитный мо-
29

мент электрона µs находится в поле B. Его энергия в этом поле равна ∆E = −µs B cos α, cos α = ±1, знак «±» соответствует ориентации
спина соответственно по полю и против поля. Следовательно, энергетический уровень Enl расщепляется на два Enl± µsB. Энергия расщепленных уровней зависит от ориентации спинового магнитного момента по отношению к внутреннему магнитному полю. Для атомом с одним валентным электроном, к которым относится атом натрия, возможны только дублеты, соответственно двум ориентациям спина электрона. Таким образом, различием в ориентациях спинового магнитного момента по отношению к внутреннему магнитному полю можно объяснить расщепление спектральных линий.
Оценим порядок величины ∆E. Величину магнитного поля B мы можем оценить как магнитное поле диполя, эквивалентного орби-
тальным токам B ≈ 4µπ0 µaB3 , где a длина порядка внутриатомных
расстояний (10-10 м) и µs ≈µB (9·10-24 Дж/Тл). Подставляя численные значения, получим ∆E≈±8 10-22 Дж (≈±5 10-3 эВ). Эта энергия мала в сравнении с разностью энергий между уровнями, отличающимися числами n, l и имеющими энергию порядка эВ (см. рис. 1), поэтому возникающие двойные линии близки друг к другу.
Полный момент Mj валентного электрона будет складываться из двух моментов – орбитального Ml и спинового Ms . Величина пол-
ного момента определяется квантовым числом j: M j = h j( j +1) ,
причем j может иметь два значения j=l+1/2 и j=l–1/2, которые соответствуют двум возможным взаимным ориентациям моментов Ms и Ml. При l=0 квантовое число j имеет только одно значение j=s=1/2. В зависимости от ориентации спина энергия терма различна, именно она будет разной для j=l+1/2 и j=l-1/2. Поэтому с учетом тонкой структуры уровни энергии (термы) характеризуются значением главного квантового числа n, значением орбитального числа l и числом j, определяющим полный момент. Уровни энергии
обозначаются символами n2S1/2, n2P3/2, n2P1/2, n2D1/2, n2D3/2. Правый нижний индекс дает значение j. Верхний левый индекс 2 указыва-
ет, что терм принадлежит к числу дублетных (двойных). Правила отбора для возможных переходов: ∆l = ±1, ∆j = 0, ±1, главное
квантовое число может меняться на любое значение.
30
