
- •V оксигенвмісні сполуки
- •V.1 Спирти
- •Класифікація спиртів
- •1.2 Номенклатура спиртів
- •1.3 Ізомерія
- •V.2 Алканоли
- •2.1 Будова аоканолів
- •2.2 Фізичні властивості
- •2.3 Хімічні властивості
- •V Окиснення та відновлення
- •2.4 Одержання алканолів
- •V. 3 Ненасичені одноатомні спирти
- •V.4 Ароматичні спирти
- •Назви ароматичних спиртів утворюються згідно із замісниковою чи радикально–функціональною номенклатуроюIupac , наприклад:
- •V. 5 Багатоатомні спирти
- •Залежно від кількості гідроксилів багатоатомні спирти бувають двох–, трьох–, чотири– і поліатомними, а за будовою вуглецевого скелету – аліфатичними і карбоциклічними.
- •5.1 Двохатомні спирти – гліколі
- •5.1.1 Класифікація. Номенклатура. Ізомерія
- •5.1.2 Фізичні властивості
- •5.1.3 Хімічні властивості
- •5.1.4 Одержання гліколів
- •5.1.5 Використання гліколів
- •5.2 Трьохатомні спирти. Гліцерин
2.3 Хімічні властивості
Полярність звязків С–О і О–Н визначає їх схильність до гетеролітичного розриву. Оскільки на атомі Карбону виникає частковий позитивний заряд (+), то він може виступати у ролі електрофільного центра, тобто піддаватися нуклеофільному атакуванню. Отже, для спиртів характерні реакції нуклеофільного заміщення (SN) гідроксильної групи. А частковий позитивний заряд (+) на атомі Гідрогену, звязаному з атомом Оксигену, зумовлює слабкі кислотні властивості. У той же час, неподілені електронні пари на атомі Оксигену сприяють виникненню основних властивостей і здатності спиртів бути нуклеофільними реагентами у реакціях з іншими сполуками.


Основний Нуклеофільний
центр центр

+ .. +
 R
––––>CH2
–––––––> O
<––––––––––– H
R
––––>CH2
–––––––> O
<––––––––––– H
..

 Електрофільний
Кислотний
Електрофільний
Кислотний
центр центр
І Кислотні властивості залежать у першу чергу від будови вуглецевого ланцюгу: зростання його довжини і збільшення кількості бокових радикалів посилює сумарний індуктивний ефект ( +І), а це приводить до зменшення полярності звязку О–Н і, як наслідок, до падіння кислотних властивостей у ряді спиртів: первинні > вторинні > третинні.
Кислотні властивості спиртів настільки слабкі, що вони не взаємодіють ні з лугами, ні основними оксидами, ні з солями слабких кислот, але реагують з активними металами (переважно лужними і лужноземельними) з утворенням твердих солеподібних речовин, які належать до класу алкоголятів, або алкоксидів:
СН3–СН2–ОН + Na –––––––> CH3–CH2–ONa + 1/2H2
Етанол Етанолят
(етоксид) натрію
Оскільки алкоголяти можна розглядати як солі надзвичайно слабких кислот, то зрозуміло, що у присутності навіть невеликої кількості води вони піддаються необоротному гідролізу:
СН3–СН2–ONa + H2O –––> CH3–CH2–OH + NaOH.
І
 І
Основні властивості
теж виявляються у дуже незначній мірі
і зумовлюються гетероатомом Оксигену
з неподіленими електронними парами.
При охолодженні спирти можуть взаємодіяти
із сильними мінеральними кислотами,
утворюючи нестійкі солі алкілоксонію,
які розпадаються при незначному
нагріванні, а у випадку третинних спиртів
– навіть при кімнатній температурі.
І
Основні властивості
теж виявляються у дуже незначній мірі
і зумовлюються гетероатомом Оксигену
з неподіленими електронними парами.
При охолодженні спирти можуть взаємодіяти
із сильними мінеральними кислотами,
утворюючи нестійкі солі алкілоксонію,
які розпадаються при незначному
нагріванні, а у випадку третинних спиртів
– навіть при кімнатній температурі.
 +
H
t0
+
H
t0

 СН3–СН2–ОН
+ HBr
CH3–CH2–O
Br–
–––> C2H5OH
+ HBr
СН3–СН2–ОН
+ HBr
CH3–CH2–O
Br–
–––> C2H5OH
+ HBr
 Н
Н
Етанол
Бромід етилоксонію
ІІІ Реакції нуклеофільного заміщення за їх особливостями поділяються на три групи:
реакції SN, в яких спирти виступають у ролі сполук з електрофільним центром (С+) і атакуються нуклеофільними реагентами; до цього типу належать реакції перетворення спиртів на галогенопохідні;
реакції SN, в яких спирти виконують функцію нуклеофільного реагента – утворення складних естерів і взаємодія з галогенопохідними;
реакція SN, в яких молекули спирту одночасно є і нуклеофілами, і сполуками з електрофільним центром – міжмолекулярна дегідратація.
Перетворення спиртів на галогеналкани.
Спирти взаємодіють з галогеноводневими кислотами, причому швидкість реакції
залежить як від будови спирту (третинні > вторинні > первинні), так і від природи кислоти (HI > HBr > HCl):
CH3–CH2–OH + HI ––––––––> CH3–CH2 – I + H2O.
Етанол Йодетан
Механізм реакції складається з декількох стадій. На першій стадії відбувається кислотно–основна взаємодія між спиртом – основою (за рахунок неподілених електронних пар на атомі О) і протоном Н+, який утворюється внаслідок дисоціації кислоти (НІ Н+ +
+
 І–):
І–):
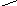 ..
+ H
..
+ H


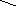 R–CH2–O–H
+ H+
R–CH2–O
R–CH2–O–H
+ H+
R–CH2–O
.. H
Алкілоксоній–катіон
При цьому протон виконує дві важливі функції. По–перше, активує електрофільний центр (С+), оскільки позитивний заряд на атомі Оксигену ефективніше відтягує від атома С+ електронну густину, ніж гідроксильна група. І по–друге, протон Н+ звязує гідроксильну групу (після її відщеплення) з утворенням нуклеофуга – малодисоційованої сполуки води, що зміщує рівновагу у бік прямої реакції.
На другій стадії нуклеофіл (галогенід–іон) атакує електрофільний центр:
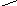

 +
+ H
+
+ H
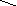 R–CH2–O
+ I–
––––––––> R–CH2–I
+ H2O
R–CH2–O
+ I–
––––––––> R–CH2–I
+ H2O
H
Йодалкан
Перейти від спиртів до галогенопохідних можна і при їх взаємодії з іншими галогенуючими реагентами, наприклад:
СН3–СН2–СН2–ОН + PCl5 ––––––––––> CH3–CH2–CH2–Cl + POCl3 + HCl,
Пропанол–1 1–Хлорпропан
3СН3–СН2–СН2–ОН + PCl3 ––––––––––> 3CH3–CH2–CH2–Cl + H3РО3,
Пропанол–1 1–Хлорпропан
CH3–CH2–CH2–OH + SOCl2 –––––––––––> CH3–CH2CH2–Cl + SO2 + HCl.
Взаємодія з галогеналканами
Для проведення цієї реакції беруть як правило не спирт, а його найближче похідне –
алкоголят, який за рахунок алкоголят–іона виявляє сильнішу нуклеофільність порівняно з нейтральною молекулою. Внаслідок взаємодії утворюються прості етери – похідні спиртів, в яких атом Гідрогену гідроксильної групи заміщений на вуглеводневий радикал:
CH3
– +
СН3–ONa + CH3–CH–CH3 –––> CH3–O–CH–CH3 + NaCl
Cl
Метанолят 2–Хлорпропан Метилізопропіловий
(методоксид) етер
натрію
Утворення складних естерів
Взаємодія між спиртами і карбоновими чи мінеральними кислотами, внаслідок якої утворюються складні естери, називається реакцією естерифікації.
До реакції естерефікації належать також реакції між похідними спиртів та кислот, однак невідємною ознакою цих реакцій є утворення складних естерів.
В реакціях естерификації нуклеофільним реагентом виступає спирт.
З мінеральними кислотами:
..
СН3–СН2–ОН + HO–SO3H ––––> CH3–CH2–OSO3H + H2O
.. Етилгідросульфат
2СН3–СН2–ОН + HO–SO2–ОH ––––> CH3–CH2–O–SO2 –О–СH2–СН3 + 2H2O
Етанол Сульфатна Диетилсульфат
кислота
СН3–СН2–ОН + HO–NO2 ––––> CH3–CH2–ONO2 + H2O
Етанол Нітратна Етилнітрат
кислота
У наведених схемах реакцій шрифтом виділені символи тих атомів, з яких утворюється нуклеофуг – вода.

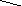 З
карбоновими кислотами:
З
карбоновими кислотами:
.. + O O
CH3–CH2–O–H + CH3–C –––––––––> CH3–C + H2O
.. OH H2SO4 O–CH2–CH3
Етанол Оцтова кислота Етилацетат (етилетаноат)

 OO
OO
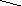 CH3–CH–СH3
+ CH3–CН–С
–––––––––> CH3–CН–С
+ H2O
CH3–CH–СH3
+ CH3–CН–С
–––––––––> CH3–CН–С
+ H2O
OH H2SO4 O–CH–CH3
ОН СН3 СН3
СН3
Пропанол–2 2–Метилпропанова Ізопропіл–2–метилпропаноат
кислота
Найкращу здатність до естерифікації виявляють первинні спирти, а найгіршу – третинні.
Механізм реакції естерифиікації буде розглянутий при вивченні карбонових кислот.
Міжмолекулярна дегідратація. При нагріванні спирта в присутності каталітичної кількості сильної кислоти (найчастіше – H2SO4) відбувається відщеплення однієї молекули води від двох молекул алканолу з утворенням простого етера:
t0
2 CH3–CH2–OH –––––––> CH3–CH2–O–CH2–CH3 + H2O
Етанол H2SO4 Диетиловий етер
Якщо нагріванню піддавати два спирта, то одночасно утворюється суміш трьох етерів – двох симетричних і одного змішаного, наприклад:
CH3
t0
CH3–OH + CH3–CH(OH)–CH3 –––––––> CH3–O–CH–CH3 + H2O
Метанол Пропанол–2 H2SO4 Метилізопропіловий етер
t0
2 CH3OH –––––––> CH3–O–CH3 + H2O
Метанол H2SO4 Диметиловий етер
t0
2 CH3–CH–СH3 –––––––> CH3–CH–O–CH–CH3 + H2O
H2SO4
ОН СН3 СН3
Пропанол–2 Диізопропіловий етер
При міжмолекулярній дегідратації одна молекула спирту відіграє роль нуклеофіла, а інша – сполуки з електрофільним центром, який активується за допомогою протона сильної кислоти на першій стадії реакції:
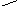 +
+ H
+
+ H
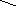 R–CH2–OH
+ H+
––––––> R–CH2–O
R–CH2–OH
+ H+
––––––> R–CH2–O
H
Алкілоксоній–катіон
На другій стадії молекула нуклеофілу атакує електрофільний центр в алкілоксоній–катіоні:
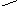 +
H ..
+
+
H ..
+
R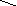 –CH2––>O+
+ HO–CH2–R
––––––––> R–CH2–O–CH2–R
––––––> R–CH2–O–CH2–R
–CH2––>O+
+ HO–CH2–R
––––––––> R–CH2–O–CH2–R
––––––> R–CH2–O–CH2–R
H .. –H2O –H+
Н
Найбільшу здатність до міжмолекулярної дегідратації виявляють первинні спирти потім – вторинні, а третинні спирти в цих умовах піддаються переважно внутрішньо– молекулярній дегідратації.
IV Реакції елімінування, або внутрішньомолекулярної дегідратації, є конкурентними процесами для щойно розглянутої міжмолекулярної дегідратації. Змінюючи умови проведення реакції (збільшенням кількості кислоти і підвищенням температури), можна добитися, що одна молекула Н2О буде відщеплюватися від однієї молекули спирта і утворюватиметься алкен.
Швидкість елімінування зростає у ряді: первинні спирти < вторинні < третинні. При цьому відщеплення атома Гідрогену при внутрішньомолекулярній дегідратації несиметричних вторинних і третинних алканолів проходить згідно із правилом Зайцева від найменш гідрогенізованого атома Карбону, наприклад:
t0
2 CH3–CH–СН2–СH3 –––––––> CH3–CH=CH–CH3 + H2O
H2SO4
ОН
Бутанол–2 Бутен–2
CH3 СН3
t0
CH3–С–СH2–СН3 –––––––> CH3–С=CH–CH3 + H2O
H2SO4
ОН
2–Метилбутанол–2 2–Метилбутен–2
Механізм елімінування складається з трьох стадії:
активація електрофільного центру (С+) протоном Н+–каталізатором:
CH3 CH3
СН3–С–СН2–СН3 + Н+ ––––> CH3–C–CH2–CH3
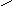
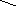 OH
O+
OH
O+
H H
Алкілоксонієвий катіон
відривання нуклеофуга і утворення карбкатіона
CH3
+
СН3–С–СН2–СН3 ––––> CH3–C–CH2–CH3 + Н2О
 +O
СН3
+O
СН3
H H
Карбкатіон Нуклеофуг
повернення (регенерація) каталізатора:
+
СН3–С–––СН–СН3 ––––> CH3–C=СН–CH3 + Н+
СH3 Н СН3
Продукт Каталізатор
У промисловості внутрішньомолекулярну дегідратацію спиртів проводять для добування алкенів. У якості каталізатора використовують Al2O3, ThO2, ZnCl2 при температурі 350–5000С.
