
Лекции_Общая геохимия
.pdfмежатомные расстояния равны 1.54 A, для гексагонального углерода-графита -1.42 A. Соответственно, атомный радиус будет равен или 0.77, или 0.71 A.
Атомные радиусы элементов, у которых имеются s- и p-электроны, за - кономерно возрастают в каждой группе периодической системы в направлении сверху вниз, т. е. при увеличении числа электронных слоев в атоме. В пределах каждого периода слева направо, т. е. при возрастании числа электронов в слое, атомные радиусы уменьшаются. По мере заполнения всех внешних подгрупп электронов у атомов благородных газов радиус резко возрастает, поскольку в структуре этих элементов атомы соединены лишь остаточной (молекулярной) связью. Атомные радиусы элементов, содержащих d- электроны, в начале ряда уменьшаются, но затем, по мере увеличения количества электронов, начинают возрастать. У атомов, содержащих f- электроны, в пределах ряда наблюдается несколько отклонений от общей тенденции на фоне небольшого сокращения радиуса.
Ионные радиусы - это радиусы атомов, находящихся в состоянии ионной связи. Размер иона изменяется в зависимости от внешних условий и влияния соседних элементов, входящих в структуру минерала. Например, NH4+ и Cl образуют соединение, кристаллизующееся при температуре выше 184.3 о в кубической структуре, где у каждого атома несколько соседей, а при более низкой температуре образуют минерал нашатырь кубической сингонии, имеющий восемь соседних элементов. В первом случае расстояние между ионами 3.27 A, во втором - 3.35 A. Радиус иона зависит, прежде всего, от его валентности. При возрастании положительной валентности ионный радиус уменьшается по сравнению с атомным радиусом, а при отрицательной валентности - возрастает. Поэтому размер катионов в общем случае меньше, чем размер анионов.
В пределах периодической системы в каждом периоде слева направо радиус катионов при их валентности, отвечающей номеру группы, т. е. возрастающей от элемента к элементу на единицу, резко уменьшается изза увеличения притяжения ядра. Радиус анионов меняется незначител ь- но. У элементов, содержащих s-, p- и d-электроны, в первых периодах радиус ионов немного сокращается, далее - несколько возрастает. У элементов, образующихся за счет прибавления f-электронов, радиусы ионов постепенно уменьшаются во всем ряду. Для лантаноидов это явление получило название «лантаноидного сжатия», для актиноидов - «актиноидного сжатия». В вертикальных группах ионные радиусы возрастают сверху вниз, также как и атомные.
Сочетание перечисленных закономерностей создает еще одну тенденцию - близость величин ионных радиусов по направлению диагонали, проходящей слева сверху направо вниз в таблице Менделеева. Это направление предопределяет возможность изоморфных изменений.
21
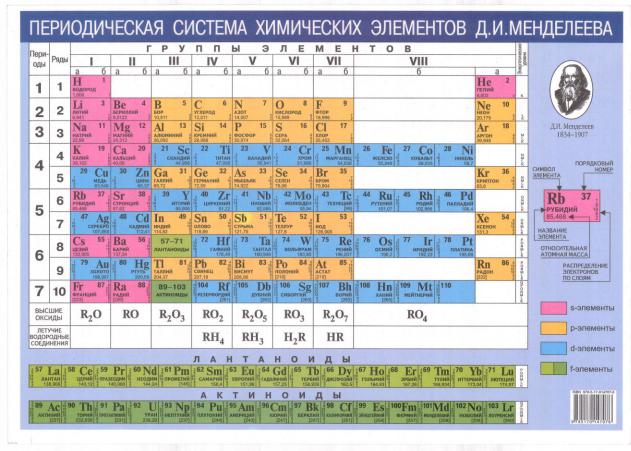
2.4. Периодическая система элементов, как основа геохимических классификаций
Рис. 2.5. Периодическая система элементов Д.И.Менделеева
Основой практически всех геохимических классификаций является Периодическая таблица химических элементов Д.И. Менделеева, где атомы по их химическим свойствам разбиты на группы и ряды, и которая, поэтому может рассматриваться как наиболее ранний вариант не только химической и, но и геохимической классификации.
Используя строение электронных оболочек, обуславливающее химические свойства элементов, положение элементов на кривой атомных объёмов, химическое «сродство» к тем или иным конкретным элементам, т.е. преимущественную склонность именно с этими определёнными элементами образовывать соединения (может измеряться значениями энергии образования определённых типов их соединений, например, оксидных) В.М. Гольдшмидт создал в 1924 году одну из наиболее широко применяемых классификаций. В ней элементы подразделены на 4 группы:
Литофильные - Li, Be, B, O, F, Na, Mg, Al, Si, P, Cl, K, Ca, Sc, Ti, V, Cr, Mn, Br, Rb, Sr, Y, Zr, Nb, I, Cs, Ba, TR, Hf, Ta, W, At, Fr, Ra, Ac, Th, Pa, U.
22
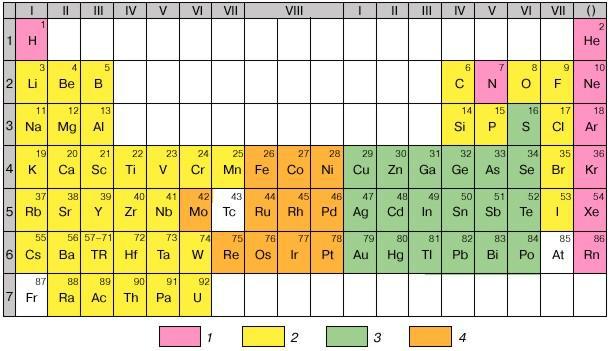
Включены кислород и галогены, а также ассоциирующие с ними элементы, то есть преимущественно образующие кислородные и галоидные соединения.
Рис. 2.6. Периодическая система и геохимическая классификация химических элементов: 1 - атмофильные, 2 - литофильные, 3 - халькофильные, 4 - сидерофильные.
Последние – это те, которые расположены на пиках и нисходящих участках кривых атомных объёмов, а также имеют максимальные величины энергии образования оксидных соединений. Построены на модели атома благородных газов, наружная оболочка из 8 электронов (2 и 6р). Сродство к О,F, Cl.
Халькофильные (или тиофильные, «любящие» серу) – S, Cu, Zn, Ga, Ge, As, Se, Ag, Cd, In, Sn, Sb, Te, Au, Hg, Tl, Pb, Bi, Po). Те, которые ассоциируют пре-
имущественно с медью и серой. Это – сера и её аналоги (селен, теллур), а также элементы, преимущественно склонные образовывать не оксидные, а сульфидные соединения. Для последних характерны 18-электронные внешние оболочки катионов, расположение на восходящих участках кривых атомных объёмов. Величины энергии образования кислородных соединений низкие. Некоторые способны существовать в самородном виде. Построены на модели атома благородных газов, наружная оболочка из 18 электронов (2s, 6p и 10d) за исключени-
ем Se, S, Te, As, Sb.
Сидерофильные - Fe, Co, Ni, Mo, Ru, Rh, Pd, Re, Os, Ir, Pt. Ассоциируют с желе-
зом. Все принадлежат к элементам с достраивающимися d-оболочками. Занимают промежуточное положение между лито- и халькофильными: минимумы на кривой атомных объёмов, промежуточные значения энергии образования кислородных соединений. В равной мере распространены и в оксидных, и в сульфидных ассоциациях. Ионы переходного типа с числом электронов в наружной оболочке от 8 до 18.
23
Атмофильные – все инертные газы, N, H. Все являются газами, свойственно по преимуществу атомарное или молекулярное (вне соединений) состояние (видимость того, что Н представляет исключение, связана с тем, что атомарный водород теряется, рассеиваясь в космическом пространстве).
Неправомерным является дополнение этой классификации группой биофильных элементов.
Исходя из периодической системы различными исследователями предпринимались неоднократные попытки геохимической классификации элементов, которая давала бы возможность по положению элементов в периодической системе объяснить поведение его в природных процессах и его естественные ассоциации с другими элементами.
Классификация В.И. Вернадского основана на следующих признаках:
1.Присутствие или отсутствие в истории данного химического элемента химических и радиоактивных процессов;
2.Характер этих процессов – обратимость или необратимость;
3.Присутствие или отсутствие в истории химических элементов в
Земной коре их химических соединений или молекул, состоящих из нескольких атомов.
Согласно этим признакам В.И. Вернадский элементы на 6 геохимических групп, которые представлены в табл. 2.2.
|
|
|
|
Таблица2.2 |
|
Геохимические группы элементов. По В.И. Вернадскому |
|||||
Номер |
Групппа |
Элементы |
|
% |
|
группы |
|
|
|
|
|
I |
Благородные газы |
He, Ne, Ar, Kr, Xe |
5 |
5.44 |
|
II |
Благородные метал- |
Ru, Rh, Pd, Os, Ir, Pt, Au |
7 |
7.66 |
|
|
лы |
|
|
|
|
III |
Циклические эле- |
H, B, C, N, O, F, Na, Mg, |
44 |
47.82 |
|
|
менты |
Al, Si, P, S, Cl, K, Ca, Ti, |
|
|
|
|
|
V, Mn, Fe, Co, Ni, Cu, Zn, |
|
|
|
|
|
As, Se, Sr, Mo, Ag, Cd, |
|
|
|
|
|
Ba, (Be, Cr, Ge, Zr, Sn, |
|
|
|
|
|
Sb, Te, Hf, W, Re, Hg, Tl, |
|
|
|
|
|
Pb, Bi |
|
|
|
IV |
Рассеянные элемен- |
Li, Sc, Ga, Br, Rb, Y, Nb, |
11 |
11.95 |
|
|
ты |
In, J, Cs, Ta |
|
|
|
V |
Элементы сильно |
Po, Rn, Ra, Ac, Th, Pa, U |
7 |
7.61 |
|
|
радиоактивные |
|
|
|
|
VI |
Элементы редких |
La, Ce, Pr, Nd, Pm, Sm, |
15 |
16.30 |
|
|
земель |
Eu, Gd, Tb, Dy, Ho, Er, |
|
|
|
|
|
Tu, Yb, Lu |
|
|
|
1.Благородные газы. Соединения с другими атомами образуют исключительно редко, поэтому в природных химических процессах значительного участия не принимают.
24
2.Благородные металлы. Соединения редки. Преимущественно присутствуют в форме сплавов, и образуются в основном в глубинных процессах (магматических, гидротермальных).
3.Циклические элементы. Наиболее многочисленная группа и преобладающая по массе. Для каждого элемента характерен определённый круг химических соединений, возникающих и распадающихся в ходе природных процессов. Таким образом, каждый элемент проходит цепочку превращений, в конечном счёте возвращаясь к исходной форме нахождения – и далее. Циклы не являются полностью обратимыми, так как часть элементов постоянно выходит из круговорота (и часть так же снова в него вовлекается).
4.Рассеянные элементы. Безусловно, господствуют рассеянные атомы, не образующие химических соединений. Незначительная доля может участвовать в образовании самостоятельных минеральных соединений (большинство – в глубинных процессах, а J и Br – в гипергенных).
5.Редкоземельные элементы. Тяготеют к рассеянным. Основная черта – совместная миграция.
6.Радиоактивные элементы - Po, Rn, Ra, Ac, Th, Pa, U. Основная специ-
фика в том, что в геохимическом процессе происходит постоянное превращение одних элементов в другие, что делает процессы их химиче-
ской миграции наиболее сложными.
Элементы условности данной классификации:
наличие химических элементов, занимающих промежуточное положение между группами, т.е. способных вести себя в миграционных процессах двояко; в этих случаях для отнесения такого элемента к одной из двух возможных групп «решающим аргументом будет история главной по весу части атомов или наиболее яркие черты их геохимической истории» (наличие доли субъективизма в таком критерии очевидно).
выделение в особую группу радиоактивных элементов не учитывает разной устойчивости изотопов; у ряда элементов существенной является доля как стабильных, так и нестабильных изотопов, и, естественно, геохимическая история соответствующих долей общего числа атомов данного элемента будет различной (K, Rb, Sm, Re и др.). Сейчас, в связи с процессами радиогенного загрязнения, необходимо учитывать и мигра-
цию искусственных радиоактивных изотопов.
Кроме упомянутых геохимических классификаций существуют и многие другие (Н.А. Солодова, А.Н. Заварицкого и др.), но они, как правило, носят либо слишком общий, либо слишком частный характер и в современной геохимии используются мало.
2.5.Кларки концентраций элементов
Вприроде существуют механизмы, позволяющие обеспечивать формирование повышенных концентраций тех или иных элементов, в результате чего их содержание в каких-то участках могут многократно превышать кларковые. По-
25
этому кроме кларка элемента нужно учитывать и величину его концентрации в сравнении с кларковым содержанием.
Для этого введено понятие «кларк концентрации» (или «коэффициент кон-
центрации»). Последний термин более корректен, так как понятие кларка введено именно для средних содержаний, и лучше для характеристики содержаний повышенных такой же термин не использовать. Но всё же в литературе вы час- то можете встретить именно термин «кларк концентрации».
Коэффициент концентрации (КК) – это соотношение содержания химического элемента в данном конкретном природном вещественном агрегате (горной породе и т.п.) к его кларку.
На этом основании элементы с низкими кларками подразделяются на две уже известные вам качественно различные группы. Те, для распределения которых не характерны высокие значениями КК, называются рассеянными (Rb, Ga, Re, Cd и др.). Способные формировать повышенные концентрации с высокими значениями КК – редкими (Sn, Be и др.).
Различиями в достигаемых величинах КК обусловлена разная роль тех или иных элементов в истории материально-технической деятельности человечества (с древности известные металлы с низкими кларками Au, Cu, Sn, Pb, Hg, Ag … - и более распространённые Al, Zr…).
Большую роль в процессах концентрации и рассеяния элементов в земной коре играет изоморфизм.
2.6. Изоморфизм элементов
Изоморфизм - это явление взаимозамещения атомов или ионов в кристаллической решетке минерала. При этом инородный ион должен отвечать определенным требованиям: обладать приблизительно теми же размерами, что и замещаемый им элемент, а также одинаковой с ним валентностью и иметь сходные свойства поляризации. Такой изоморфизм называется изовалентным. К нему можно отнести широко известные замещения циркония гафнием, молибдена рением, калия рубидием, алюминия галлием и т. д. Благодаря близости ионных радиусов гафний, рубидий, рений, галлий, будучи редкими элементами, практически полностью поглощаются минералами своих более распространенных элементов-хозяев. Их собственные минералы неизвестны.
Более сложной формой изоморфизма является гетеровалентный изоморфизм, при котором замещающие друг друга атомы, имеющие одинаковые размеры, обладают различной валентностью. Правило электростатической нейтральности, т. е. сохранения нейтрального заряда соединения, может быть соблюдено благодаря компенсации валентности другим ионом. Например, в плагиоклазах Са + А1 (суммарная валентность равна пяти) — →Na+ + Si4+(суммарная валентность также равна пяти).
Широко распространены взаимные замещения элементов, мало отличающихся по размерам атомов. Например, замещение магния и железа никелем и кобальтом в оливинах, кремния германием в силикатах и т. д.
26
А.Е. Ферсман ввел понятие «полярного изоморфизма», суть которого заключается в следующем: ион меньшего размера легче замещает ион большего размера (а не наоборот), ионы с более высоким зарядом предпочтительно замещают ионы с более низким зарядом (Ca2+ → Na+ и т. д.). Эти явления Ферсман объяснил энергетической «выгодностью» одностороннего (направленного) изоморфизма. Им были предложены два ряда элементов, в которых изоморфизм может идти по вертикали лишь снизу вверх, т. е. Ba может замещать K, но не наоборот, Sc может замещать Fe, но не наоборот
и т. д.: |
|
|
|
|
|
|
|
|
|
|
К |
Fe |
Ca |
Ce |
K |
Ti |
TR |
Ca |
Ti |
Sc |
Mg |
Ва |
Sc |
U |
Th |
Pb |
Nb |
Th |
Y |
Ta |
Zr |
(Hf) Sc |
Важнейшие примеры изовалентного и гетеровалентного изоморфизма приведены в «Кратком справочнике по геохимии» (Войткевич, 1977).
Кроме изоморфизма известно явление полиморфизма, которое заключается
втом, что одно и то же по химическому составу вещество при кристаллизации
вразных условиях (при разных P и T) образует различные минеральные модификации. Примеры: графит и алмаз, кварц - тридимит - кристобалит - коэсит - стишовит.
Интересен также эффект автолизации, или очистки минерала от примесей при его неоднократной перекристаллизации.
Разделение изоморфных примесей происходит в коре выветривания, куда попадают минералы, сформированные на больших глубинах. В обстановке избытка кислорода и влаги элементы повышают валентность, проходя все стадии окисления. Например, четырехвалентный уран превращается
вшестивалентный и, являясь в такой форме хорошо растворимым, выносится из разрушающихся пород поверхностными водами. В то же время четырехвалентный торий, с которым уран очень близок по по ведению в глубинных процессах, остается в россыпях, так как не меняет свою валентность.
Тестовые вопросы:
1.Как называются мельчайшие частицы, из которых состоит вещество?
2.Что построено из атомов?
3.Как называется вещество, состоящее из молекул (или атомов) двух или нескольких веществ?
4.Чему равна атомная единица массы -1а.е.м?
5.Чему равно массовое число атома ?
6.С каким элементом ассоциируют сидерофильные элементв?
7.В каких единицах выражается кларк концентраций вещества? Что представляет собой формула Курлова ?
27
3. СТРОЕНИЕ ЗЕМЛИ И ПРОИСХОЖДЕНИЕ ЕЕ ОБОЛОЧЕК
3.1. Строение Земли
Земля - третья планета, считая от Солнца, представляет собой по форме геоид - несколько сплюснутый со стороны полюсов шар с радиусом 6400 км; средняя плотность ее — 5,5 г/см3. Увеличение давления и температуры в породах по мере углубления в толщу Земли породило много гипотез о состоянии вещества на различных уровнях Земли. Так, в настоящее время принимается, что плотность Земли в ее центре достигает 11 г/см3. Однако представления о непрерывном нарастании температуры в глубину Земли при допущении слишком больших значений, вытекающих из существующего термического градиента для верхней части земной коры, приводят к тому, что Земля оказалась бы недостаточно устойчивой и превратилась бы в газ. Поэтому существующие теории допускают для ядра Земли температуры в 2000—4000° С.
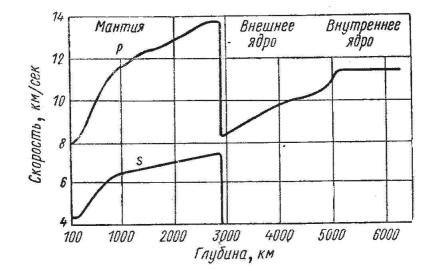
Рис. 3.1. Распределение скоростей продольных (р) и поперечных (s) волн сейсмического происхождения в Земле (по Б. Гуттенбергу, Тугаринов,
1979)
Наиболее эффективными оказались сейсмиче-
ские методы изучения глубин Земли — измерение скорости прохождения продольных (р) и поперечных (s) сейсмических волн в Земле. На основании этих данных было установлено оболочечное строение Земли: земная кора (мощностью от 60 до 5 км), мантия (до 2900 км) и ядро радиусом 3500 км (рис. 3.1.).
Существование у Земли мощного магнитного поля послужило основанием для предположения о металлическом составе ее ядр и соответственно о значительной удельной плотности его вещества.
28
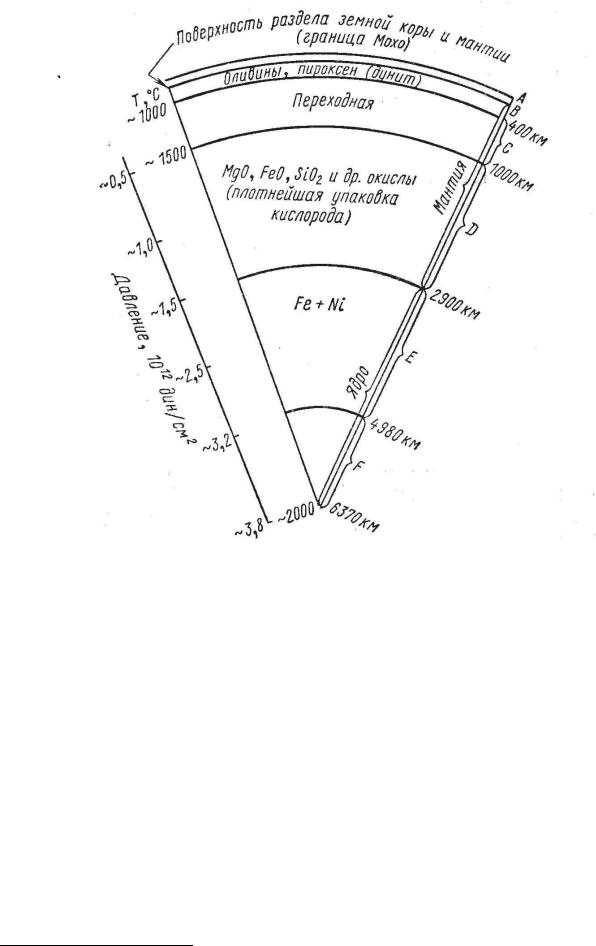
Рис. 3.2. Разрез Земли с выделением шести зон (Тугаринов, 1973)
В. М. Гольдшмидт впервые высказал идею о составе и внутреннем строении Земли, взяв за основу металлургический процесс, он предложил считать земное ядро железо-никелевым, мантию — в виде сульфидной оболочки - аналога штейна3, а земную кору — в виде силикатной коры или шлака. Эта гипотеза, несмотря на ряд удачно разрешенных вопросов, в частности о соотношении удельных плотностей Земли (5,5 г/см3) и коры (3 г/см3), а также о составе ядра Земли вызвала возражения (против огромного избытка серы и металлов в мантии). Ни одна интрузия основного состава, сопровождаемая сульфидной минерализацией явно глубинного происхождения, не привела доказательств такого избытка серы в мантии. Более того, состав метеоритов, явившихся прообразом вещества, из которого формировалась планета, не отвечал этому специфическому составу мантии, охватывавей подавляющий объем земного шара.
Тем не менее, факт существования оболочек в земном шаре мог быть принят, и оставался лишь вопрос о составе и состоянии вещества в каждой из них. Ниже рассматрим разрез Земли на основе сейсмических данных (рис. 3.2).
3 ШТЕЙН м. горн. или сырец, заводская выплавка смеси сернистых металлов.
29
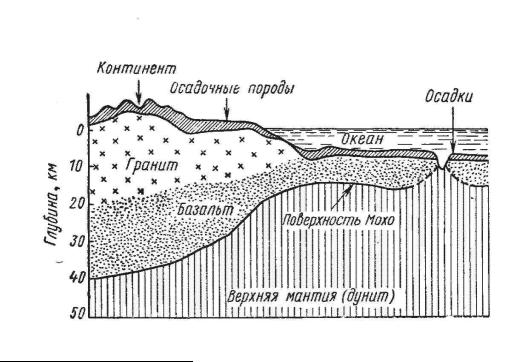
Зона А составляет земную кору (сиаль). От нижележащей мантии она отделяется так называемой поверхностью Мохоровичича (или Мохо), глубже которой скорость прохождения сейсмических волн резко возрастает.
Различают земную кору континентального и океанического типов. Мощность земной коры континентального типа достигает 60 км и увеличивается в районах крупных горных сооружений (Гималаи). В подобных регионах поверхность Мохо как бы опускается глубоко в мантию. Наоборот, под океанами происходит поднятие поверхности Мохо, так как толщина коры океанического типа не превышает 5 км, а местами, в областях рифтовых долин, она полностью исчезает, и мантия соприкасается с океанической водой (рис. 3.3).
Согласно В. В. Белоусову, в коре континентального типа выделяется три слоя: верхний (осадочных пород)-3 км, затем гранитный (гранито-гнейсов) - около 20 км и наконец базальтовый, достигающий в среднем такой же мощности, разделяемый в свою очередь на гранулито-базальтовый (верхний) и грану- лито-эклогитовый4 (нижний). Второй и третий слои (гранитный и базальтовый) разделены так называемой поверхностью Конрада.
Если в гранитах и базальтах скорость распространения сейсмических волн составляет 5-6 км/сек, то в мантии непосредственно под земной корой она достигает 8,1 км/сек.
Рис. 3.3. Схема строения земной коры (Тугаринов,
1973)
Существуют
различные мнения о характере перехода вещества земной коры в мантию. Так, например, В. В. Белоусов и А. П. Вино-
4 Эклогит — метаморфическая горная порода состоящая из пироксена с высоким содержанием жадеитового минала (омфацита) и граната гроссуляр-пироп-альмандинового состава, кварца и рутила[1]. По химическому составу эклогиты идентичны магматическим породам основного состава — габбро и базальтам.
В настоящее время установлено, что эклогиты образуются при высокобарическом метаморфизме этих пород. Это подтверждено экспериментально. Однако еще недавно, в 1950—1970 годах рассматривался вопрос осадочной природы протолита эклогитов.
Термин эклогит был введен Р. И. Гаюи (Haüy) в 1822 году для обозначения пород, сложенных пироксеном травяно-зеленого цвета (омфацитом) и красным гранатом.
30
