
Лекции_Общая геохимия
.pdfТак, в районе месторождения Джергалан были обнаружены пластыкаменной соли в верхах разреза. От береговой линии эти месторождения обычно удалены, так как терригенные осадки среди них отсутствуют.
При исследовании 3. В. Студениковой разреза Кавказской гео - синклинали была получена характеристика распределения вольфрама и молибдена в осадочных породах. Эти данные показали исключительную приуроченность молибдена к сланцам, насыщенным сульфидами, особе н- но пиритом, в то время как вольфрам накапливался в основном в извес т- няках независимо от содержания в них органического вещества в виде вольфрамата кальция, рассеянного в массе карбоната.
Месторождения урана особенно типичны для пород, отличающихся скоплениями ОВ. Такая же связь характеризует уран с фосфатным вещ е- ством, оказавшимся спутником ураноносных фаций, например, в нижнем палеозое. Отмечается четкий парагенезис подобных чисто осадочных скоплений, фигурирующих в различных континентах на протяжении п о-
следних 600 млн. лет: один из них - U, V, Ni, Mo, Re, Сорг и другой — P, Zr, редкие земли, U, Th. Характерно, что при метаморфизме, особенно
последнего типа месторождений, парагенезис, хотя и частично наруше н- ный явлениями переотложения, сохранялся.
А. П. Виноградов, характеризуя химический состав пелагических илов, обратил внимание на неравномерность содержания многих компонентов в донных терригенных отложениях вокруг берегов континентов. Так, он привел в качестве примера скопления селена вдоль берегов Кал и- форнии, золота — вдоль восточного побережья Евразии, урана — у берегов Скандинавии, объясняя это сносом материала с суши.
На основе приведенных выше фактов можно сделать вывод, что о т- ложения в области шельфа и на современных материках обогащены м е- таллами и отражают сложную дифференциацию континентального материала, умноженную непрерывно происходящим гипергенезом при главенствующей роли биогенных процессов. В тоже время для океанов, за и с- ключением марганца, мы наблюдаем относительно постоянный состав небольшого набора осадков, лишенных какого-либо скопления рудных компонентов.
Вопросы для проверки усвоения лекции:
Накопление каких пород происходит в континетальных условиях и что является их конечным продуктом?
Какие химические элементы при гипергенезе рудных месторождений являются о с- таточными – реликтовыми?
На какие литологические типы могут быть разб иты осадочные образования? Какие пелагические осадки в океане имеют наибольшее распространение?
Чем вызвано низкое содержание кремния в морской воде? Какую часть дна океана покрывают красные глины?
Чем объясняется окраска красных глин?
121
11. ГЕОХИМИЧЕСКИЕ БАРЬЕРЫ
11.1. Геохимические барьеры
Геохимические барьеры – участки, где на коротком расстоянии происходит резкое снижение миграционной способности химических элементов, ведущее к их накоплению.
Все геохимические барьеры по происхождению делятся на природные и техногенные (рис. 11.1), а по процессам их образования делятся на три класса: механические, физикохимические и биологические.
Типы геохимических барьеров
Природные |
Техноген- |
|
ные |
Физико- |
Механичес- |
Биохими- |
Физико- |
Механи- |
Биохимии- |
химические |
кие |
ческие |
химические |
ческие |
ческие |
Рис. 11.1. Типизация геохимических барьеров избирательности накопления
Наиболее важные типы механических геохимических барьеров:
аэродинамический;
гидродинамический;
фильтрационный.
Все эти виды барьеров Вы хорошо представляете и сами легко можете привести примеры таких барьеров (оконное стекло, полоса лесонасаждений, запруда и т.д.)
Теперь попробуем разобраться с барьерами при физико-химической миграции. Этот во-
прос займёт значительно больше времени, так как физико-химические барьеры значительно более многообразны и в целом оказывают значительно большее влияние на природные процессы концентрации химических элементов.
В общем случае физико-химические барьеры приурочены к узким пограничным зонам, где контактируют (соприкасаются) две обстановки, существенно различающиеся ка- кими-либо химическими или физическими параметрами среды и, как следствие, разными условиями миграции химических элементов. При этом обязательным условием, чтобы барьер реально функционировал, является осуществление миграции через них химических элементов, переносимых тем или иным способом (обычно с потоками поверхностных и подземных вод). Если же существует контакт двух контрастных обстановок, через ко-
торый перенос вещества не осуществляется, такой контакт называют потенциальным геохимическим барьером (то есть таким, который может возникнуть при появлении этого дополнительного условия).
Самой по себе смены обстановки для возникновения отчётливо выраженного геохимического барьера тоже недостаточно. Надо, чтобы эта смена была резкой, осуществляющейся на небольшом промежутке. Если же смена условий происходит постепенно, на значительном расстоянии, барьер оказывается как бы «размазан» в пространстве, и повышение концентраций осаждающихся на нём химических элементов будет незначительным. Но для
122

изучения общей картины миграции химических элементов и такие неявные, «размытые» барьеры тоже нужно учитывать.
Типизация барьеров по масштабам и природным объектам их проявления приведена на рис. 11.2.
|
|
Геохимические барьеры |
|
|
Макробарьеры |
Мезобарьеры |
Микробарьеры |
||
Зона слияния морских и |
Краевые части болот |
Источники подземных вод |
||
|
речных вод |
|
|
|
Смешение глубинных вод |
Поступление богатых О2 |
Нейтральные слабо щелоч- |
||
с теплыми прибрежными |
склоновых и грунтовых вод |
|
ные рН |
|
Зоны апвелинга
Коагуляция, осаждение колоидов
Обогащение углекислотой
Рис. 11.2. Классификация геохимических барьеров по масштабам и природным объектам их проявления
По масштабам проявления среди геохимических барьеров существуют макро-, мезо- и микробарьеры. Некоторые типичные примеры таких барьеров рассматривает в своих работах А.И. Перельман.
Примером макробарьеров могут служить зоны смешения речной и морской воды в устьях рек, иногда имеющие ширину до первых километров. Эти барьеры являются зонами массовой коагуляции и осаждения коллоидных частиц. Другой случай макробарьера – зоны апвеллинга (подъёма глубинных холодных вод в океане, обогащённых СО2, и их смешения с тёплыми прибрежными водами.
Пример мезобарьера – краевые части болот, где в болото (восстановительная среда) поступают с окружающих возвышенностей богатые кислородом поверхностные и грунтовые воды.
Пример микробарьера – место выхода на поверхность источника с восстановительными водами.
Эффективность геохимического барьера определяется его градиентом и контрастностью. Градиент барьера – это скорость нарастания изменения параметров среды по на-
правлению миграционного потока:
G= m1- m2/l,
где l – протяжённость барьера;
m1 и m2 – геохимические параметры среды до и после барьера
(параметры любые – кислотность, окислительно-восстановительный потенциал, давление и т.д.).
Контрастность барьера – отношение величин геохимических параметров в направлении потока до барьера и после него:
S= m1/ m2
123
Интенсивность накопления химических элементов на барьере увеличивается с ростом контрастности и градиента (случай постепенного изменения параметров среды можно рассматривать как барьер с очень малым градиентом – и отсюда понятно, почему повышение содержания химических элементов будет незначительным).
По стабильности своего положения геохимические барьеры подразделяются на: подвижные; неподвижные.
Неподвижные барьеры занимают фиксированное положение в пространстве. Они распространены более широко, так как обычно смена параметров среды связана с изменением каких-то характеристик ландшафта, занимающих фиксированное положение.
Подвижные барьеры могут возникнуть в тех случаях, когда сам миграционный поток является причиной изменения химизма среды. Например, поток грунтовых вод, богатых свободным кислородом, проникает вглубь зоны, характеризующейся восстановительной обстановкой. Зона раздела этих сред является геохимическим барьером, и с течением времени барьер будет всё более смещаться в направлении движения водного потока.
Специфическим типом геохимических барьеров являются двусторонние барьеры. Они возникают в тех случаях, когда через границу раздела обстановок с разными параметрами среды миграция осуществляется попеременно то в одну, то в другую сторону. Тогда барьер будет действовать в обоих направлениях.
В зависимости от направленности движения миграционного потока можно выделить барьеры: латеральные; радиальные.
На латеральном барьере миграция происходит по горизонтали, из одного элементарного ландшафта в другой. В этом случае барьеры приурочены к границам ландшафтов, резко различающихся по условиям миграции. Радиальные барьеры связаны с вертикальной миграцией вод, они локализованы внутри соответствующих ландшафтов, на границах раздела сред по вертикали.
Важнейшие геохимические барьеры при физико-химической миграции (рис. 11.3).
Физико – химические барьеры
Окисли- |
Восстано- |
Кислотный |
Испари- |
Сорбции- |
Термодина- |
тельный |
ви- |
|
тельный |
онный |
мический |
|
тельный |
|
|
|
|
Рис. 11.3. Важнейшие геохимические барьеры при физико-химической миграции
Чтобы построить общую систематику физико-химических барьеров, надо учесть хотя бы основные, наиболее распространённые в природе случаи изменения физико-химических параметров среды. Основной средой миграции на Земле является водная среда. Химизм поверхностных и грунтовых вод определяется условиями их формирования. В зависимости от них формируются воды с конкретными параметрами по кислотности и окислительновосстановительным условиям, поэтому, если учитывать эти два наиболее важных параметра в качестве основных, получим 12 классов вод, которые были охарактеризованы ранее.
Мигрируя в ландшафте, эти воды могут попадать в обстановки, характеризующиеся иными параметрами. Если параметры исходных вод разместить в виде столбцов (арабские цифры от 1 до 12), а возможные направления изменений в среде их миграции – по горизон-
124
тали (латинские буквы, обозначающие тип геохимического барьера), получится систематика физико-химических барьеров в форме таблицы (матрицы).
Разработана эта классификация А.И. Перельманом. Позднее, А.И. Летувнинкас, внёс в эту классификацию ценное дополнение, показав тёмно-серым цветом клеточки, отвечающие барьерам, существование которых невозможно по определению («запрещённые» барьеры). А светло-серым цветом он выделил клеточки, отвечающие барьерам, существование которых теоретически возможно, но пока они в природе достоверно не выявлены и не изучены
(табл. 11.1.).
Окислительные (кислородные) барьеры (А).
Такие барьеры возникают на участках резкого повышения Eh среды – окислительновосстановительного потенциала. Поскольку в условиях земных ландшафтов увеличение Eh обычно связано с увеличением концентрации свободного кислорода (основного окислителя), то можно называть окислительный барьер кислородным, считая эти термины в данном случае практически синонимами.
На этих барьерах идут процессы окисления мигрирующих химических элементов. И, если окисленные формы того или иного элемента будут обладать меньшей подвижностью, они будут выпадать из раствора в осадок и концентрироваться на данном барьере.
В наиболее типичном варианте окислительный барьер возникает в зоне поступления глеевых или сероводородных вод в кислородную среду. Но иногда такие барьеры могут возникать и в пределах собственно кислородных обстановок, когда на границе раздела слабоокислительные условия сменяются резкоокислительными.
Поэтому барьеры типа А1-А4 также не являются запрещёнными. Окислительные барьеры очень широко распространены в равнинных ландшафтах, характеризующихся обилием органического вещества. Здесь для грунтовых вод характерна глеевая обстановка, а в местах их выхода на поверхность или на дно водоёма с кислородным режимом (реки, озера) она сменяется кислородной. В местах разгрузки таких вод происходит активное накопление гидрооксидов железа и марганца в виде обохривания грунтов и горных пород (приобретающих характерную ржаво-бурую окраску) или даже формирования железистых и марганцовистых конкреций и стяжений.
Нередко такие барьеры возникают в местах выхода глубинных подземных вод по зонам разломов, где в этих случаях наблюдается интенсивное обохривание пород. Своеобразные барьеры возникают в местах выхода на поверхность сероводородных источников или при смешении сероводородных вод с богатыми кислородом грунтовыми водами. При этом сульфидная сера (2-) окисляется или до элементарной, нейтральной серы (0), или, что бывает чаще, до сульфатной (с валентностью 6+).
2H2S + O2 = 2H2O = 2S
H2S + 2O2 = H2SO4
В первом случае, если такие условия сохраняются в течение длительного времени, могут формироваться крупные скопления самородной серы (это бывает в зонах окисления на нефтяных месторождениях). Второй случай интересен и важен тем, что он ведёт к резкому увеличению кислотности среды (за счёт образования серной кислоты).
125
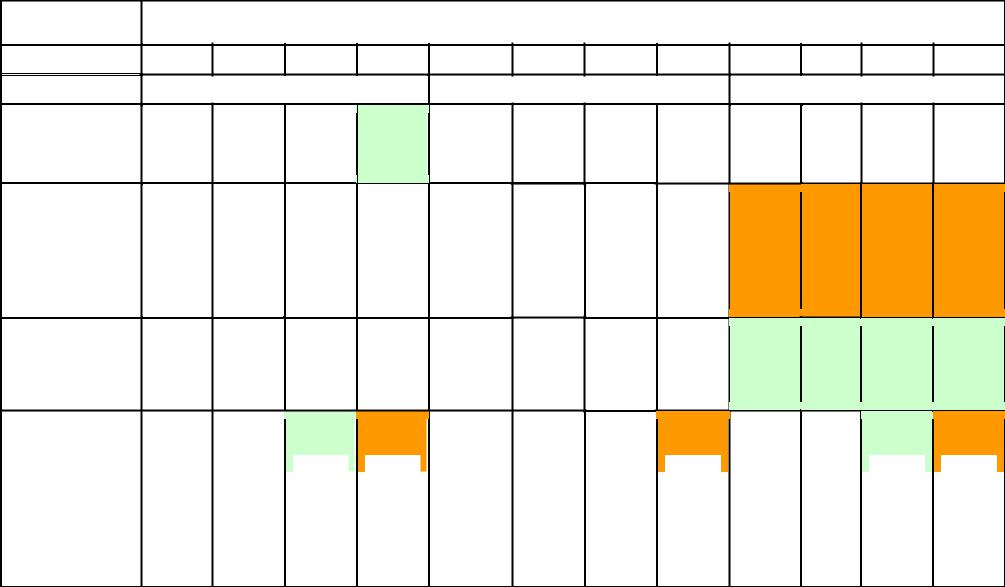
Таблица 11.1. Концентрация химических элементов на геохимических барьерах с различным режимом (по А. И. Перельману с дополнениями А.И. Летувнинкаса )
Режим геохимических |
Cостав вод, поступающих к барьерам |
|
|
|
|
|
|
|
|
|
|||
барьеров |
|
|
|
|
|
|
|
|
|
|
|
|
|
Интервал рН |
|
<3 |
3-6,5 |
6,5-8,5 |
> 8,5 |
<3 |
3-6,5 |
6,5-8,5 |
> 8,5 |
<3 |
3-6,5 |
6,5-8,5 |
> 8,5 |
Тип вод по Eh |
|
Кислородные |
|
|
Глеевые |
|
|
|
Сероводородные |
|
|
||
Окислительный (ки- |
A1 |
A2 |
A3 |
A4 |
A5 |
A6 |
A7 |
A8 |
A9 |
A10 |
A11 |
A12 |
|
слородный) |
А |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Al, Fe |
Fe, Mn, |
Mn |
|
Fe |
Fe, Mn, |
(Fe), Mn, |
(Mn) |
S, Se, (Fe) |
S, Se |
S, Se |
S, Se |
|
|
|
Co |
|
|
|
Co |
Co |
|
|
|
|
|
Сульфидный (серово- |
B1 |
B2 |
B3 |
B4 |
B5 |
B6 |
B7 |
B8 |
B9 |
B10 |
B11 |
B12 |
|
дородный) |
В |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Fe, Cu, |
Ti, Mn, |
Ti, Cr, |
Cu, Ag, |
Ti, Pb, Cu |
Fe, Co, Ni, |
Fe, Co, Ni, |
Cu, Zn, |
|
|
|
|
|
|
Hg, Cf, |
Co, Ni, |
Mo, U, Se, |
Zn, Cr, |
|
Pb, Cu, |
Cu, Zn, |
Cd, Hg, |
|
|
|
|
|
|
As, Mo, U |
Cu, Zn, |
V |
Mo, U, V, |
|
Zn, Cf, |
Cd, Hg, |
Mn. (Fe, |
|
|
|
|
|
|
|
Pb, Cd, |
|
As |
|
Hg, U |
(Mo, U) |
Co, Ni, U |
|
|
|
|
|
|
|
Cr, Mo, U, |
|
|
|
|
|
|
|
|
|
|
|
|
|
Hg |
|
|
|
|
|
|
|
|
|
|
Глеевый |
С |
C1 |
C2 |
C3 |
C4 |
C5 |
C6 |
C7 |
C8 |
C9 |
C10 |
C11 |
C12 |
|
|
Cu, U, Mo |
Cu, U, Mo |
Cu, Cr, U, |
Cu, Ag, |
Cu, U, Mo |
Cu, U, Mo |
Mo, U |
Mo, U |
|
|
|
|
|
|
|
|
Mo, Se, V |
Cr, Mo, V, |
|
|
|
|
|
|
|
|
|
|
|
|
|
Se, As |
|
|
|
|
|
|
|
|
Щелочной |
D |
D1 |
D2 |
D3 |
D4 |
D5 |
D6 |
D7 |
D8 |
D9 |
D10 |
D11 |
D12 |
Mg, Ca, |
Mg, Ca, |
|
|
|
|
|
|
|
Mg, Ca, Sr, |
Mg, Ca, |
Mg, Ca, |
|
|
|
Mg, Ca, |
Mg, Ca, |
|
|
|
|
|
|
|
|
Sr, Ba, |
Sr, Ba, Co, |
|
|
|
|
|
|
|
Ba, Mn, Fe, |
Sr, Ba, |
Sr, Ba, Zn, |
|
|
|
Sr, Ba, |
Sr, Ba |
|
|
|
|
|
|
|
|
Mn, Fe, |
Ni, Cu, |
|
|
|
|
|
|
|
Co, Ni, Cu, |
Mn, Fe, |
Cd, Mn, |
|
|
|
Mn, Fe, |
|
|
|
|
|
|
|
|
|
Co, Ni, |
Zn, Pb, |
|
|
|
|
|
|
|
Zn, Pb, Cd, |
Co, Ni, |
Co, Ni |
|
|
|
Co, Ni, |
|
|
|
|
|
|
|
|
|
Cu, Zn, |
Cd, Hg, |
|
|
|
|
|
|
|
Hg, P, As, |
Zn, Pb, |
|
|
|
|
Zn, Pb, |
|
|
|
|
|
|
|
|
|
Pb, Cd, |
Ra, (U) |
|
|
|
|
|
|
|
TR |
Cd, Hg, |
|
|
|
|
Cd, Al, |
|
|
|
|
|
|
|
|
|
Hg, Al, |
|
|
|
|
|
|
|
|
|
Al, Cr, P, |
|
|
|
|
TR, Cr, P, |
|
|
|
|
|
|
|
|
|
Cr, P, As, |
|
|
|
|
|
|
|
|
|
As, (U) |
|
|
|
|
As |
|
|
|
|
|
|
|
|
|
Al, U, TR |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
126
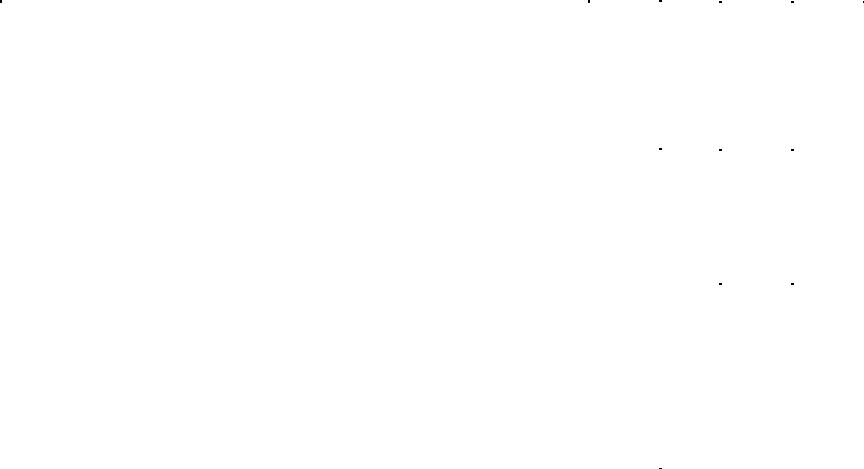
Кислый |
E |
|
E1 |
|
|
E2 |
|
E3 |
E4 |
|
E5 |
|
|
E6 |
|
E7 |
E8 |
|
E9 |
|
|
E10 |
|
E11 |
|
E12 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
Si, Mo |
(Cu, Zn), |
|
|
|
|
|
|
Si, Mo |
(Cu, Zn), |
|
|
|
|
|
|
Se, Ge |
|
Al, Si, TR, |
|
|
|
|
|
|
|
|
|
Ag, Al, |
|
|
|
|
|
|
|
Ag, Al, |
|
|
|
|
|
|
|
|
N, B, F, |
|
|
|
|
|
|
|
|
|
TR, Si, |
|
|
|
|
|
|
|
TR, Si, |
|
|
|
|
|
|
|
|
Cl, Br, J |
|
|
|
|
|
|
|
|
|
(Ti), Mo, |
|
|
|
|
|
|
|
(Ti), Mo |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cr |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Испарительный F |
|
F1 |
|
F2 |
|
F3 |
F4 |
|
F5 |
|
F6 |
|
F7 |
F8 |
|
F9 |
|
F10 |
|
F11 |
|
F12 |
||||
|
|
|
Na, K, Ck, |
|
|
|
Li, Na, K, |
Li, Na, K, |
|
Na, K, Cl, |
|
|
|
Li, Na, K, |
Li, Na, K, |
|
Li, Na, K, |
|
|
|
Li, Na, K, |
|
Li, Na, K, |
|||
|
|
|
Mg, Ca, |
|
|
|
N, B, F, |
N, B, F, |
|
Mg, Ca, Sr, |
|
|
|
Rb, Tl, N, |
Rb, Tl, N, |
|
Rb, F, Cl, |
|
|
|
Rb, F, Cl, |
|
Rb, N, B, |
|||
|
|
|
Sr, S, Mn, |
|
|
|
Cl, Br, J, |
Cl, Br, J, |
|
S, Mn, Fe, |
|
|
|
B, Cl, Br, |
B, F, Cl, |
|
Br, j, Mg, |
|
|
|
Br, j, Mg, |
|
F, Cl, Br, j |
|||
|
|
|
Fe, Co, Ni, |
|
|
|
Mg, Ca, |
Cu, Zn, |
|
Co, Ni, Cu, |
|
|
|
j, Mg, Ca, |
Br, j, Zn |
|
Ca, Sr, S |
|
|
|
Ca, Sr, S |
|
|
|||
|
|
|
Cu, Zn, |
|
|
|
Sr, S, Zn, |
Mo, U, V, |
|
Zn, Pb, Cd, |
|
|
|
Sr, S, Zn |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
Pb, Cd, |
|
|
|
Mo, U, V, |
Se |
|
Al, Mo, U |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
Al, Mo, U |
|
|
|
Se |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Сорбционный |
G |
|
G1 |
|
G2 |
G3 |
G4 |
|
G5 |
|
G6 |
G7 |
G8 |
|
G9 |
|
G10 |
G11 |
|
G12 |
||||||
|
|
|
Al, Se, Si, |
|
Si, Ba, Zn, |
Li, Na, K, |
Li, Na, K, |
|
Al, Si, Ge, P, |
|
Si, Ba, Zn, |
Li, Na, K, |
Li, Na, K, |
|
Al, Si, Ge, |
|
Ba, Sr, |
Li, Na, K, |
|
Li, Na, K, |
||||||
|
|
|
Ge, P, V, |
|
Cd, Ni, |
(Cl, Br, J, |
(Cl, Br, J, |
|
V, As |
|
Cd, Ni, |
Zn, (Cl, |
(Cl, Br, J, |
|
P, V, As |
|
(Cl, Br, |
(Cl, Br, J, |
|
(Cl, Br, J, |
||||||
|
|
|
As |
|
Co, Pb, |
B, F, S, P, |
B, F, S, P, |
|
|
|
|
Co, Pb, |
Br, J, B, F, |
B, F) |
|
|
|
|
J, B, F, |
B, F, S, P) |
|
B, F, P) |
||||
|
|
|
|
|
|
Cu, Cl, Br, |
V, Mo, |
V, Mo, As) |
|
|
|
|
Cu, U, Cl, |
S, P) |
|
|
|
|
|
S, P) |
|
|
|
|||
|
|
|
|
|
|
J, B, P, V, |
As), Zn |
|
|
|
|
|
Br, J, F, S, |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
Mo, As |
|
|
|
|
|
|
P, Mn, Fe |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Термодинамичес-кий |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
H1 |
|
|
H2 |
H3 |
H4 |
|
H5 |
|
|
H6 |
H7 |
H8 |
|
H9 |
|
|
H10 |
H11 |
|
H12 |
|||||
|
H |
|
|
|
|
Mg, Ca, |
(Li), Mg, |
Zn, (Cu), |
|
|
|
|
Mg, Ca, |
(Li), Mg, |
Zr, (Cu), |
|
|
|
|
Mg, Ca, |
Mg, Ca, |
|
|
|||
|
|
|
|
|
|
Sr, Ba, |
Ca, |
(U) |
|
|
|
|
Sr, Ba, |
Ca, |
(U) |
|
|
|
|
Sr, Ba |
Sr, Ba |
|
|
|||
|
|
|
|
|
|
Mn, Zn, |
Sr,Ba,Zr, |
|
|
|
|
|
Mn, Zn, |
Sr,Ba,Zr, |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
Pb, Co, Ni |
Pb |
|
|
|
|
|
Pb, Co, Ni, |
Pb, Mn |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Fe |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Геохимические барьеры: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
Установленные и изученные |
|
|
|
|
Установленные не изученные |
|
|
|
|
Запрещенные |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
127
Интересно, что в истории развития биосферы роль окислительных барьеров и их положение заметно изменялись. Первоначально атмосфера Земли была восстановительной и не содержала свободного кислорода. Не содержали его и природные воды. Начало накопления свободного кислорода связано с появлением фотосинтезирующих организмов, вначале морских. Но в течение очень долгого периода времени, на протяжении архея и раннего протерозоя, продуцируемый в океане кислород, видимо, практически не поступал в атмосферу. Дело в том, что первично-восстановительная морская водная среда содержала большое количество растворённого железа. И поначалу почти весь синтезируемый кислород расходовался на окисление железа и связывался с ним в нерастворимых оксидных соединениях. Весь ранний протерозой – это гигантская по продолжительности эпоха массового накопления на дне древних океанов железооксидных осадков (так называемых железистых кварцитов). Это было время функционирования первого и притом гигантского по своим размерам кислородного можно сказать даже не макро-, а мегабарьера. И лишь после того, как в результате его работы воды океана были очищены от растворённого в них железа, началось массовое поступление кислорода в атмосферу. Здесь тоже кислород первоначально расходовался на окисление серы – до всё той же серной кислоты - H2SO4. Окисление атмосферной серы неизбежно должно было сопровождаться кислотными дождями, что в конечном счёте привело к очищению атмосферы от сернистых соединений и вытеснению их свободным кислородом. И уже как следствие формирования кислородной атмосферы стало возможным появление окислительных барьеров в наземных ландшафтах.
Сероводородные (сульфидные) барьеры (В).
Эти барьеры возникают там, где кислородные или глеевые воды встречают на своём пути сероводородную обстановку. Естественно, если в сероводородную среду проникают сероводородные воды, никакого барьера не возникает. Поэтому символы, соответствующие барьерам с индексами В9-В12,выделены красным цветом – эти барьеры запрещены. Сероводородные обстановки в зоне гипергенеза встречаются редко, так что и сероводородные барьеры тоже распространены мало. На сероводородных барьерах наиболее эффективно накапливаются халькофильные элементы (так как они непосредственно связываются с серой, образуя сульфидные соединения), отчасти – сидерофильные, и в наименьшей мере литофильные.
Самый обычный случай возникновения природного сероводородного барьера при латеральной миграции – это контакт кислородных вод с сероводородными илами. Например, при впадении реки в озеро, на дне которого развиты сероводородные илы. Такой барьер может возникать в приустьевых частях рек.
Пример функционирования природных геохимических барьеров типов В5-В8 при вертикальной миграции выявлен и изучен Н.С. Касимовым в солончаках, подпитываемых водами солёных озёр (побережья Аральского моря, Балхаша, озёр Тургайской котловины). В этих ландшафтах непосредственно под поверхностной соляной коркой расположен маломощный горизонт с окислительной обстановкой (первые сантиметры). Под ним – горизонт с сероводородным заражением (от 5 до 30 см). А ещё глубже – горизонт со слабовосстановительными глеевыми грунтовыми водами. В условиях сухого климата господствует вытяжной водный режим: вода капиллярными силами вытягивается в направлении поверхности, где испаряется (пример относительно редкого случая водной миграции в направлении снизу вверх). В результате формируются два барьера. первый – сероводородный, второй (выше первого) – окислительный.
Известны случаи возникновения локальных очагов сероводородного заражения (и, следовательно, возможности появления сероводородных барьеров) в гумидном климате при смешении грунтовых кислородных и глеевых вод. Необходимое условие для этого – сульфатный состав кислородных вод. Это может быть следствием миграции кислородных вод через зону окисления горных пород, содержащих сульфиды. При окислении сульфидов образуется сульфат-ион SO42-. Здесь сульфат-ион, действуя как окислитель, окисляет, при уча-
128
стии деятельности серобактерий, присутствующие в торфе органические углеводородные соединения. А сам при этом восстанавливается с образованием сероводорода. В результате в узкой полосе вдоль границы между кислородными водами и глеевой средой возникает сероводородная обстановка. И, с учётом направления водной миграции, функционирует сероводородный барьер типа В2.
Глеевые барьеры (С).
Эти барьеры в наиболее типичных случаях возникают на участках резкой смены кислородной обстановки глеевой. Реже – слабоглеевой обстановки резкоглеевой, то есть тоже глеевой, но характеризующейся ещё более низкими значениями окислительновосстановительного потенциала. Теоретически можно предположить вероятность существования в природе глеевых барьеров типов С9-С12, которые возникали бы при поступлении сероводородных вод в глеевую среду. Но такие барьеры пока не изучены.
Глеевые барьеры очень широко распространены в гумидных и семиаридных ландшафтах, особенно в супераквальных (с неглубоким залеганием грунтовых вод), где развиваются процессы заболачивания. При заболачивании формируется глеевая среда. В результате нисходящего движения почвенных вод или латерального стока грунтовых вод из сопряжённых возвышенных ландшафтов по периферии зоны заболачивания формируются глеевые барьеры типа С2 или С3.
Возможно также возникновение глеевых барьеров в краевых частях артезианских бассейнов. Воды, которые поступают в артезианский бассейн из области питания, по мере своего продвижения могут терять О2, расходуя его на окисление содержащегося в водоносном горизонте ОВ. В результате во внутренних частях артезианского бассейна формируется бескислородная среда. Если при этом в водах содержится мало SO42-, они будут глеевыми. Награнице кислородных вод, поступающих из области питания, и глеевых вод внутренней части артезианского бассейна, будет формироваться подвижный глеевый барьер.
Щелочные барьеры (D).
Возникают на участках резкого повышения рН среды в нейтральной, кислой и щелочной обстановках. В соответствии с общими законами миграции на них происходит накопление преимущественно катионогенных химических элементов, лучше мигрирующих в кислой среде: Fe, Mn, Ni, Co, Cu, в том числе такие высоко токсичные загрязнители природной среды, как Pb, Cd, Hg, As, U и др.
Характерный пример: почвенный профиль элювиального ландшафта влажных тропиков на карбонатных породах. Сверху формируются кислые почвы, повышенная кислотность которых обеспечивается разложением больших объёмов органических остатков. Растворы, фильтрующиеся через эти почвы, попадают в карбонатные горные породы, трещинные воды которых имеют щелочную реакцию. Возникает щелочной барьер типа D2.
Способность многих токсичных элементов осаждаться на щелочных барьерах используют для локализации загрязнения, создавая такие барьеры искусственно. Например, для обработки виноградников широко используется в качестве фунгицида смесь медного купороса CuSO4 и гашеной Ca(OH)2 извести (бордосская смесь). В результате при многолетнем применении этого средства в почве накапливается избыток меди, достигающий опасного уровня – особенно в почвах подчинённых ландшафтов, куда мигрируют почвенные растворы. Для борьбы с загрязнением на путях миграции растворов роют траншеи, которые заполняют песчано-карбонатной смесью, в которых возникает щелочная среда. Формируется щелочной барьер, на котором медь связывается в форме малоподвижного в этих условиях гидрокарбонатного соединения малахита – Cu2CO3(OH)2.
Пример использования щелочного барьера для очистки подземных вод приведен на рис. 11.4.
129
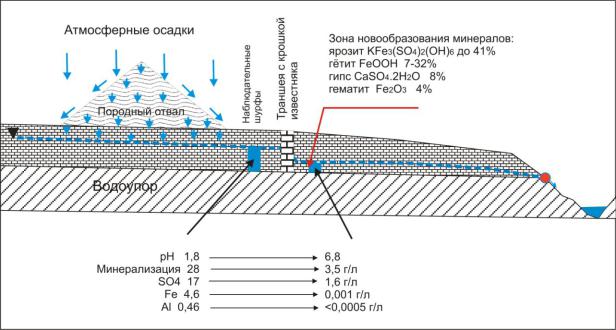
Рис. 11.4. Схема проведения опытных работ по очистке стоков с породного отвала (Максимович, 2006)
Кислые барьеры (Е).
Возникают на путях миграции химических элементов при резком снижении рН среды. В противоположность щелочным барьерам, на них накапливаются не катионогенные, а анионогенные элементы, более активно мигрирующие в условиях щелочной среды. К ним принадлежат Si, Al, Mo, Be, Ga, Sc, Y, Zr, TR и др. Как правило, эти элементы мигрируют в форме растворимых солей щелочных металлов, подвижных в щелочной среде – Na2SiO3, Na2AlO2, Na2MoO4 и др.
Чаще всего в природе встречаются (и лучше всего изучены) кислые барьеры, возникающие при попадании щелочных содовых вод в кислую среду. Такая ситуация возникает при радиальной испарительной миграции (капиллярное «вытягивание» щелочных растворов с глубины в более кислую почвенную среду) – пример хорошо изучен в Северном Казахстане. Накапливаются Si, Y, Be, Se, Zr и ряд других элементов.
Яркий пример действия кислого барьера – замещение древесных остатков опалом и халцедоном (оксидными соединениями кремния). Если древесина захороняется в почвах аридных ландшафтов, имеющих щелочную среду, то при её разложении возникают очаги повышенной кислотности на щелочном фоне. Щелочные растворы, содержащие подвижные соединения кремния, приникают в разлагающуюся древесину – и здесь, на локальном кислотном барьере, осаждаются слабо подвижные соединения кремнезёма. В более широком плане этот процесс назван М.А. Глазовским хемогенным опалогенезом. Он протекает в различных ландшафтных обстановках именно на кислых барьерах.
Специфический случай возникновения кислого барьера – водонефтяной контакт. Испарительные барьеры (F).
Это участки зоны гипергенеза, где накопление химических элементов обусловлено процессами испарения. Первая существенная особенность этих барьеров – действие в условиях самых разнообразных по химизму обстановок. То есть действие испарительного барьера лишь в незначительной степени зависит от параметров кислотности-щёлочности среды или окислительно-восстановительного потенциала. Главным фактором является климат. Вторая важная особенность – то, что именно на этих барьерах концентрируются наиболее растворимые химические элементы. Те, которые подвижны в водах любого химического состава (Na, K, Rb, Cl и др.). Понятно, что самый простой способ осадить такие элементы – это просто выпарить раствор, в котором они переносятся.
130
