
- •Содержание
- •Лабораторная работа 5 расчет и приготовление рабочих растворов hCl и NaOh
- •1 Цель и содержание
- •2 Теоретическое обоснование
- •3 Приборы и реактивы
- •4 Указания по технике безопасности
- •5 Методика и порядок выполнения работы
- •6 Содержание отчета и его форма
- •7 Вопросы для защиты работы
- •Лабораторная работа 6 приготовление стандартного раствора буры
- •1 Цель и содержание
- •2 Теоретическое обоснование
- •3 Приборы и реактивы
- •4 Указания по технике безопасности
- •5 Методика и порядок выполнения работы
- •6 Содержание отчета и его форма
- •7 Вопросы для защиты работы
- •Лабораторная работа 7 стандартизация титрованного раствора hCl
- •1 Цель и содержание
- •2 Теоретическое обоснование
- •Первичный стандарт вторичный стандарт рабочий раствор.
- •3 Приборы и реактивы
- •4 Указания по технике безопасности
- •5 Методика и порядок выполнения работы
- •6 Содержание отчета и его форма
- •7 Вопросы для защиты работы
- •Лабораторная работа 8 стандартизация рабочего раствора NаOh
- •1 Цель и содержание
- •2 Теоретическое обоснование
- •3 Приборы и реактивы
- •4 Указания по технике безопасности
- •4. Методика и порядок выполнения работы
- •6 Содержание отчета и его форма
- •7 Вопросы для защиты работы
- •Лабораторная работа 9 определение содержания органической кислоты в растворе способом прямого титрования
- •1 Цель и содержание
- •2 Теоретическое обоснование
- •3 Приборы и реактивы
- •4 Указания по технике безопасности
- •5 Методика и порядок выполнения работы
- •6 Содержание отчета и его форма
- •7 Вопросы для защиты работы
- •Лабораторная работа 10 определение содержания соли аммония методом обратного титрования
- •1 Цель и содержание
- •2 Теоретическое обоснование
- •3 Приборы и реактивы
- •4 Указания по технике безопасности
- •5 Методика и порядок выполнения работы
- •6 Содержание отчета и его форма
- •7 Вопросы для защиты работы
- •Список рекомендуемой литературы Основная
- •Дополнительная литература
- •355028, Г. Ставрополь, пр. Кулакова, 2.
7 Вопросы для защиты работы
Что понимают под стандартизацией растворов? Виды стандартов и особенности их приготовления.
Почему раствор с приготовленным титром называют первичным стандартом? Дайте его определение.
Требования, предъявляемые веществам для первичного стандарта.
Почему раствор
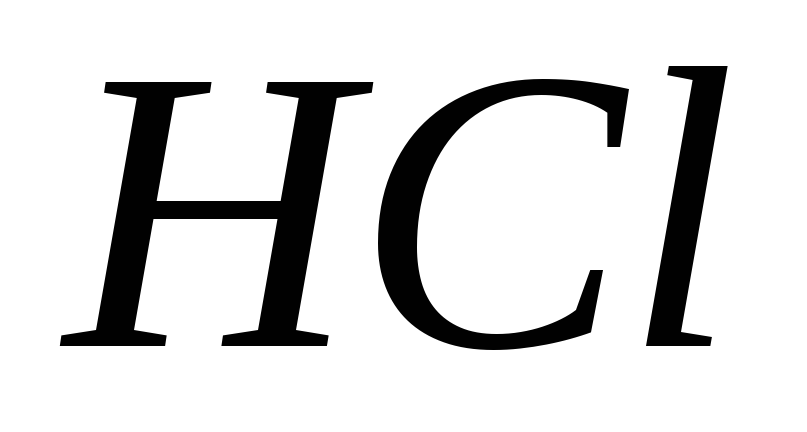 относят к группе вторичных стандартов?
Ответ пояснить.
относят к группе вторичных стандартов?
Ответ пояснить.Перечислите правила работы с мерной колбой Мора.
Назовите вещество и стандартную температуру, при которых выполняют калибровку мерной посуды.
Какие из перечисленных ниже веществ:
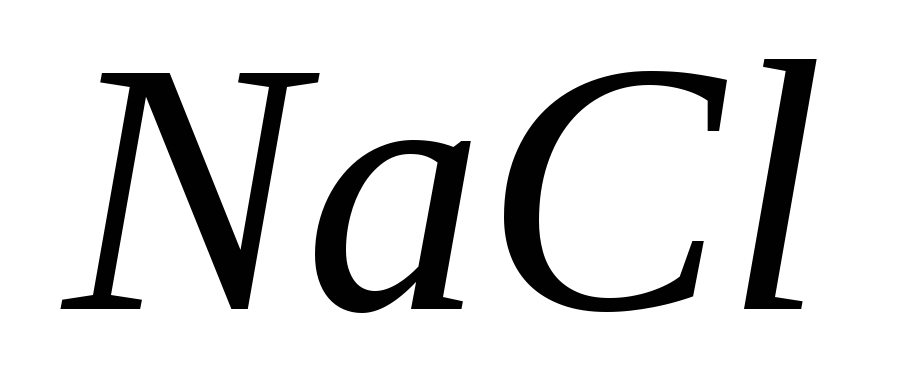 ,
,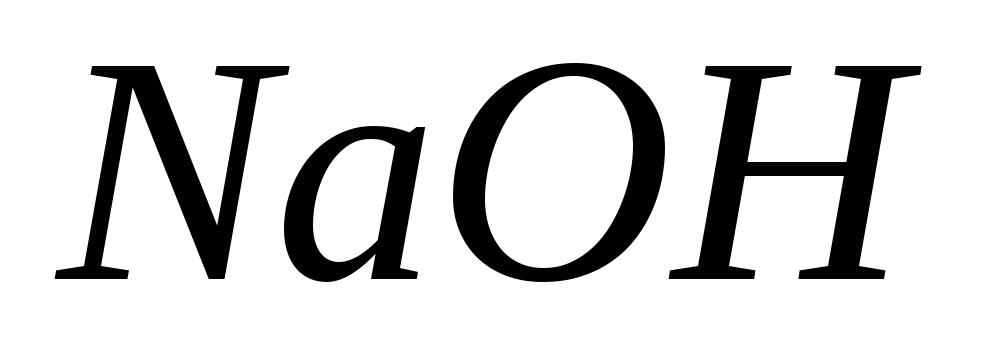 ,
,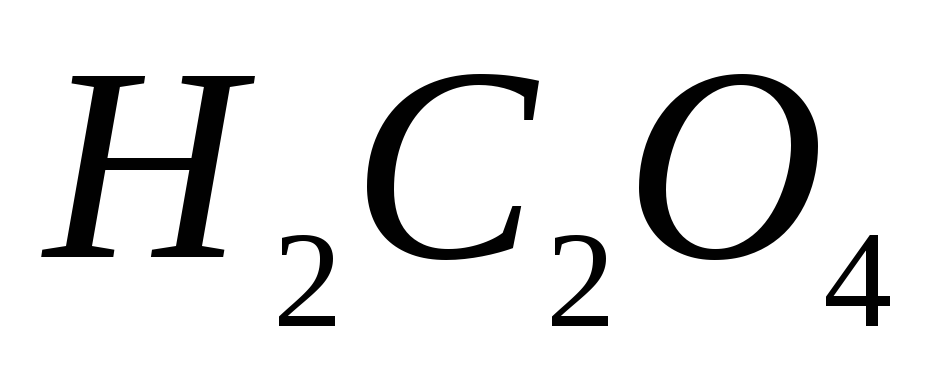 ,
, ,
, ,
, ,
,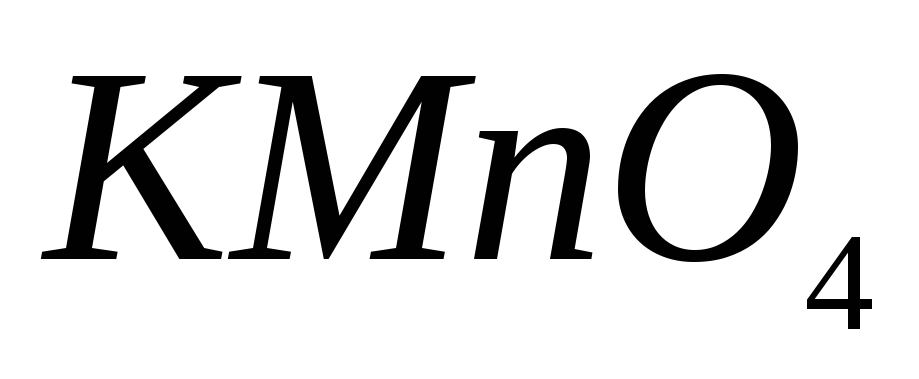 ,
,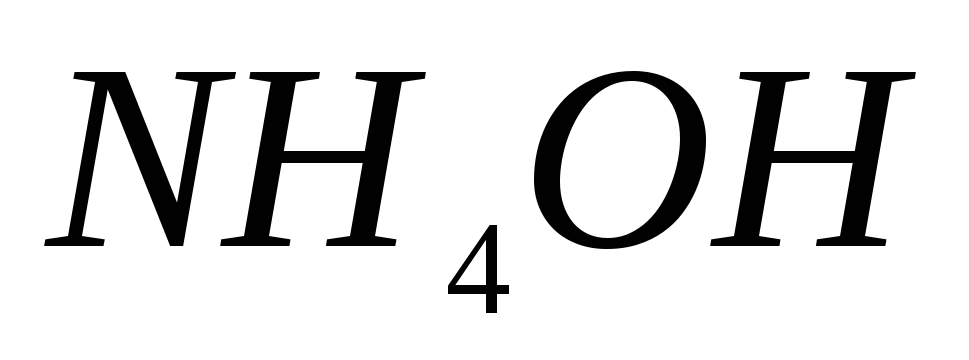 используют для приготовления: а)
первичного стандарта; б) вторичного
стандарта; в) не обладают свойствами
стандарта?
используют для приготовления: а)
первичного стандарта; б) вторичного
стандарта; в) не обладают свойствами
стандарта?Дайте определение титра раствора и приведите формулу связи титра с молярной концентрацией и молярной концентрацией эквивалента.
Что такое условный титр? Как связаны между собой простой и условный титры? Как связаны между собой условный титр и молярная концентрация эквивалента?
Объясните суть метода точных навесок и метода разности.
Какие весы называют аналитическими? Правила работы на них.
Почему на технических весах платформа для взвешивания открыта, а на аналитических весах имеется защитный кожух со шторками?
Почему при взвешивании предмет помещают точно в центр и его можно переставлять, а не сдвигать?
Рассчитайте навеску двуводной щавелевой кислоты
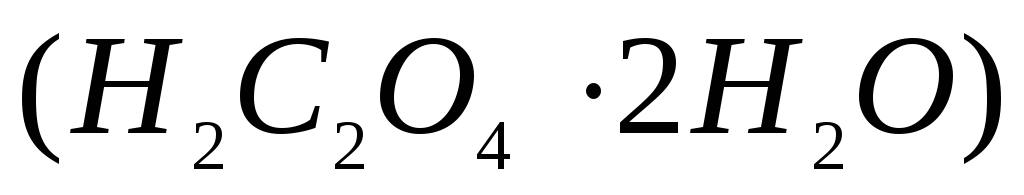 необходимую для приготовления раствора
стандарта объемом 200 мл и концентрацией
необходимую для приготовления раствора
стандарта объемом 200 мл и концентрацией .
.
Лабораторная работа 7 стандартизация титрованного раствора hCl
1 Цель и содержание
Научиться проводить стандартизацию растворов кислот методом пипетирования; освоить методику визуальной фиксации точки эквивалентности.
2 Теоретическое обоснование
Известно, что концентрация кислот и влажность твердых щелочей при хранении может заметно изменяться, поэтому приготовленные из них растворы не могут иметь точную концентрацию, а значит непосредственно использовать их для анализа нельзя. Чтобы определить точную концентрацию рабочих растворов кислот и щелочей, необходимо их отстандартизировать по установочным веществам (стандартным растворам).
Устойчивые при хранении титрованные растворы (например, некоторых кислот, солей) также могут выступать в качестве стандарта (вторичный стандарт). Такие растворы стандартизируются и хранятся в тщательно закупоренной посуде.
Растворы
фиксаналов готовят в соответствии с
методикой, приведенной в паспорте
реагента, чаще всего они содержат
![]() вещества и предназначены для приготовления
вещества и предназначены для приготовления![]() стандартного раствора. Такие растворы
обычно используют для работы или
стандартизации непосредственно сразу
после приготовления на правах первичного
стандарта.
стандартного раствора. Такие растворы
обычно используют для работы или
стандартизации непосредственно сразу
после приготовления на правах первичного
стандарта.
Под стандартизацией понимают процесс установления точной концентрации растворов реагентов по стандартным веществам с относительной погрешностью не превышающей 0,1%.При этом используют 2 методики: 1) метод отдельных навесок; 2) метод пипетирования.
Процесс стандартизации может проводиться как в одну стадию (по первичному стандарту), так и в несколько по схеме:
Первичный стандарт вторичный стандарт рабочий раствор.
В методе отдельных навесок
рассчитывают массу вещества стандарта,
на титрование которой расходуется
приблизительно![]() раствора титранта. Навеску стандарта
берут на аналитических весах с точностью
до 4-го знака и количественно переносят
в колбу для титрования, разводят
раствора титранта. Навеску стандарта
берут на аналитических весах с точностью
до 4-го знака и количественно переносят
в колбу для титрования, разводят![]() воды, добавляют
воды, добавляют![]() капли индикатора и титруют до изменения
окраски раствора. Измеряют с точностью
до
капли индикатора и титруют до изменения
окраски раствора. Измеряют с точностью
до![]() объем титранта, пошедший на титрование
навески стандарта.
объем титранта, пошедший на титрование
навески стандарта.
Метод
пипетированияоснован на отборе
точного объема раствора для титрования
(аликвотной части) с помощью пипетки
Мора. К аликвоте добавляют![]() капли индикатора и титруют до перехода
окраски индикатора (конец титрования).
В точке эквивалентности определяют
расход титранта. Расчет концентрации
стандартизируемого раствора проводят
по закону эквивалентов.
капли индикатора и титруют до перехода
окраски индикатора (конец титрования).
В точке эквивалентности определяют
расход титранта. Расчет концентрации
стандартизируемого раствора проводят
по закону эквивалентов.
В зависимости от устойчивости растворов применяют различные способы титрования: прямое, реверсивное (разновидность прямого), заместительное, обратное. Наиболее просто выполняется прямое титрование, когда в колбу для титрования отбирают пипеткой Мора аликвоту стандартизируемого раствора, а в бюретку помещают раствор стандарта.
Титрование
раствора проводят до тех пор, пока не
будут получено не менее 3-х сходящихся
результатов (допустимая погрешность в
определении объема титранта не более
![]() ,
т. е. для бюретки объемом
,
т. е. для бюретки объемом![]() разброс значений не должен превышать
разброс значений не должен превышать![]() ).
Расчет концентрации раствора проводят
по закону эквивалентов, используя его
выражение в зависимости от выбранного
способа титрования.
).
Расчет концентрации раствора проводят
по закону эквивалентов, используя его
выражение в зависимости от выбранного
способа титрования.
Для
выбора индикатора необходимо примерно
оценить кислотность среды в точке
эквивалентности путем теоретического
расчета и воспользоваться справочными
данными для определения рТ индикатора.
Переход индикатора должен попадать в
интервал значений рН для области скачка
на кривой титрования, при этом величина
индикаторной погрешности не может
превышать ![]() .
Основным требованием при подборе
индикатора следует считать отсутствие
сопряженных реакций и контрастное
изменение окраски индикатора в области
скачка кривой титрования от одной капли
титранта.
.
Основным требованием при подборе
индикатора следует считать отсутствие
сопряженных реакций и контрастное
изменение окраски индикатора в области
скачка кривой титрования от одной капли
титранта.
Для стандартизации
раствора
![]() в качестве первичного стандарта применяют
раствор буры. Определение проводят
методом пипетирования или отдельных
навесок, используя способ реверсивного
титрования. Между титрантом (
в качестве первичного стандарта применяют
раствор буры. Определение проводят
методом пипетирования или отдельных
навесок, используя способ реверсивного
титрования. Между титрантом (![]() )
и титруемым раствором буры протекает
реакция:
)
и титруемым раствором буры протекает
реакция:
![]() .
(7.1)
.
(7.1)
Исходный раствор
буры вследствие гидролиза имеет щелочную
реакцию и окрашивает индикатор метилоранж
в желтый цвет. В конце титрования от
одной капли титранта цвет индикатора
должен измениться с желтого на оранжевый
без розового оттенка. Вследствие
опалесценции определение этой границы
затруднительно, поэтому при титровании
в качестве раствора сравнения используют
специально приготовленную холостую
пробу, не содержащую буры, куда добавляют
![]() капли индикатора.
капли индикатора.
