
- •Содержание
- •Лабораторная работа 5 расчет и приготовление рабочих растворов hCl и NaOh
- •1 Цель и содержание
- •2 Теоретическое обоснование
- •3 Приборы и реактивы
- •4 Указания по технике безопасности
- •5 Методика и порядок выполнения работы
- •6 Содержание отчета и его форма
- •7 Вопросы для защиты работы
- •Лабораторная работа 6 приготовление стандартного раствора буры
- •1 Цель и содержание
- •2 Теоретическое обоснование
- •3 Приборы и реактивы
- •4 Указания по технике безопасности
- •5 Методика и порядок выполнения работы
- •6 Содержание отчета и его форма
- •7 Вопросы для защиты работы
- •Лабораторная работа 7 стандартизация титрованного раствора hCl
- •1 Цель и содержание
- •2 Теоретическое обоснование
- •Первичный стандарт вторичный стандарт рабочий раствор.
- •3 Приборы и реактивы
- •4 Указания по технике безопасности
- •5 Методика и порядок выполнения работы
- •6 Содержание отчета и его форма
- •7 Вопросы для защиты работы
- •Лабораторная работа 8 стандартизация рабочего раствора NаOh
- •1 Цель и содержание
- •2 Теоретическое обоснование
- •3 Приборы и реактивы
- •4 Указания по технике безопасности
- •4. Методика и порядок выполнения работы
- •6 Содержание отчета и его форма
- •7 Вопросы для защиты работы
- •Лабораторная работа 9 определение содержания органической кислоты в растворе способом прямого титрования
- •1 Цель и содержание
- •2 Теоретическое обоснование
- •3 Приборы и реактивы
- •4 Указания по технике безопасности
- •5 Методика и порядок выполнения работы
- •6 Содержание отчета и его форма
- •7 Вопросы для защиты работы
- •Лабораторная работа 10 определение содержания соли аммония методом обратного титрования
- •1 Цель и содержание
- •2 Теоретическое обоснование
- •3 Приборы и реактивы
- •4 Указания по технике безопасности
- •5 Методика и порядок выполнения работы
- •6 Содержание отчета и его форма
- •7 Вопросы для защиты работы
- •Список рекомендуемой литературы Основная
- •Дополнительная литература
- •355028, Г. Ставрополь, пр. Кулакова, 2.
6 Содержание отчета и его форма
Каждый студент должен иметь лабораторный журнал, который является документом, отражающим всю его работу.
Все наблюдения и выводы по экспериментальной работе, проделанной в лаборатории, студент заносит в лабораторный журнал непосредственно после ее выполнения.
Рекомендуется следующая схема записи:
1. Дата.
2. Номер и название лабораторной работы.
3. Цель работы.
4. Название и описание хода опытов.
5. Наблюдения.
6. Уравнения химических реакций.
7. Выводы и расчеты (формулы, таблицы, графики).
7 Вопросы для защиты работы
Какое титрование называют кислотно-основным?
Расшифруйте понятия «ацидиметрия» и «алкалиметрия». Для каких целей используют эти методы?
Дайте определение кривой титрования (КТ) в протолитометрии и укажите ее особенности.
Какие факторы влияют на величину скачка титрования и положение точки эквивалентности?
Перечислите особенности КТ при титровании слабых электролитов. В чем причина такого хода кривой? Ответ обоснуйте.
Каковы особенности КТ многоосновных кислот и их солей? Почему большинство из них нельзя полностью оттитровать (на примере
 ,
, ,
, )?
)?Каковы условия титрования смеси веществ?
Какие приемы используют при титровании смеси двух солей; соли и основания; смеси двух кислот? Назвать эти приемы и показать применение на примере
 ;
; ;
; или
или .
.Почему при титровании
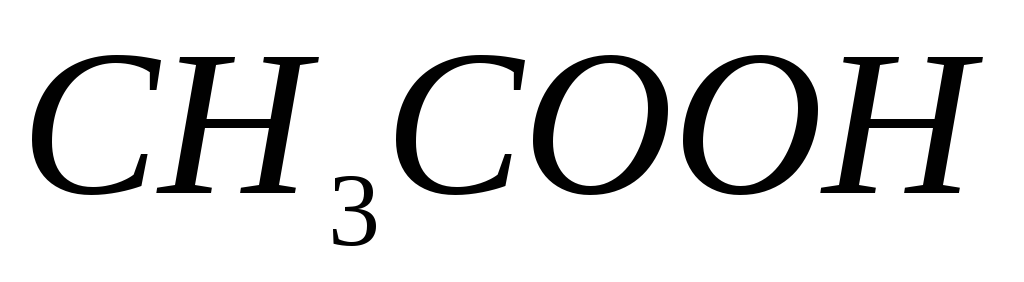 окраска индикатора фенолфталеина
неустойчива, о чем это говорит?
окраска индикатора фенолфталеина
неустойчива, о чем это говорит?Каким приемом можно убедиться, что достигнута ТЭ при титровании
 ?
Объясните, исходя из свойств системы,
почему в этом случае окраска фенолфталеина
стабилизируется и длительно не исчезает.
Какой принцип лежит в основе наблюдаемого
явления?
?
Объясните, исходя из свойств системы,
почему в этом случае окраска фенолфталеина
стабилизируется и длительно не исчезает.
Какой принцип лежит в основе наблюдаемого
явления?Кривая титрования в протолитометрии: ее особенности, характерные области.
Факторы, влияющие на положение точки эквивалентности и величину скачка кривой титрования. Приведите вид кривых титрования сильных и слабых электролитов.
Буферные растворы и их классификация. Буферная емкость.
Применение буферных растворов в анализе. Расчет рН буферных систем. Влияние буферов на ход кривых титрования в протолитометрии.
К
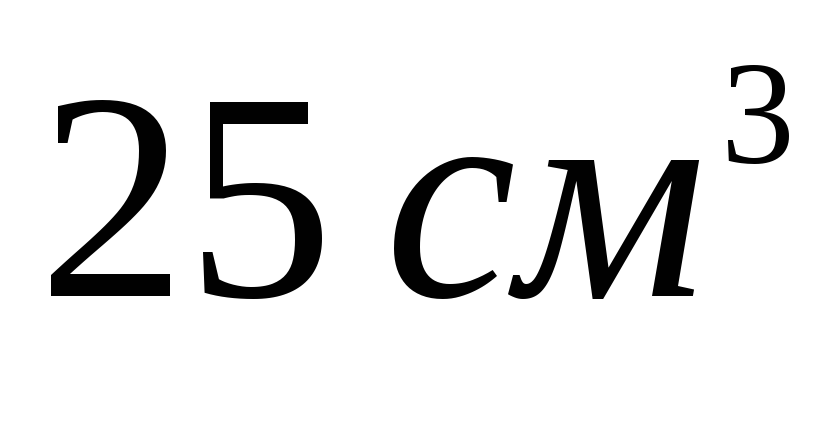 муравьиной кислоты с
муравьиной кислоты с добавили
добавили
 раствора
раствора .
Назовите вид полученного раствора и
рассчитайте значение рН исходных
растворов и полученного при их сливании.
.
Назовите вид полученного раствора и
рассчитайте значение рН исходных
растворов и полученного при их сливании.Титруют
 уксусной кислоты с концентрацией
уксусной кислоты с концентрацией раствором
раствором с титром
с титром .
Определить значение рН а) в точке
эквивалентности; б) при расходе титранта
.
Определить значение рН а) в точке
эквивалентности; б) при расходе титранта ;
в) при расходе титранта
;
в) при расходе титранта .
.Вычислите массу
 в пробе, которую растворили в мерной
колбе на
в пробе, которую растворили в мерной
колбе на ,
если аликвоту этого раствора объемом
,
если аликвоту этого раствора объемом оттитровали
оттитровали раствора
раствора с титром
с титром 3,64103.
3,64103.
Лабораторная работа 10 определение содержания соли аммония методом обратного титрования
1 Цель и содержание
Ознакомиться с методикой выполнения обратного титрования. Научиться выполнять расчеты по определению содержания солей аммония по результатам обратного титрования.
2 Теоретическое обоснование
Титрование
по заместителю (косвенное) и обратное
(по остатку) чаще всего применяют при
анализе неустойчивых систем, таких как
соли аммония или очень слабых электролитов,
где гидролиз продуктов становится
сопряженной реакцией (3-я точка по
![]() ).
Анализ в этом случае идет в две стадии:
).
Анализ в этом случае идет в две стадии:
реакция титруемого компонента со вспомогательным раствором;
титрование эквивалентного заместителя (либо устойчивый продукт реакции – заместительное титрование, либо остаток вспомогательного раствора – обратное титрование).
Так
как соли аммония неустойчивы даже при
небольшом нагревании, особенно в
присутствии сильных кислот или щелочей,
то при их определении целесообразно
использовать не прямое, а косвенное или
обратное титрование. В ходе обратного
титрования предварительно проводят
реакцию термического пиролиза соли
аммония в щелочной среде, добавляя
в раствор заведомо избыточное количество
![]() .
Часть щелочи расходуется на реакцию с
раствором соли аммония (10.1), а ее избыток
оттитровывают стандартным раствором
.
Часть щелочи расходуется на реакцию с
раствором соли аммония (10.1), а ее избыток
оттитровывают стандартным раствором![]() :
:
![]() .
(10.1)
.
(10.1)
Расчет проводят по закону эквивалентов для обратного титрования, который выражается формулой (10.2):
![]() .
(10.2)
.
(10.2)
Наряду
с обратным титрованием содержание
аммиака можно определять косвенно,
методом титрования заместителя
(формальдоксимный метод). Для этого
сначала отбирают аликвоту вспомогательного
раствора формальдегида и определяют
холостой объем титранта, который идет
на реакцию с муравьиной кислотой, всегда
присутствующей в растворе формальдегида
как примесь. После этого добавляют в
полученный нейтральный раствор аликвоту
соли аммония. В ходе реакции образуется
сильная кислота, которая эквивалентно
замещает ионы
![]() .
Образовавшееся по реакции (10.3) количество
протонов оттитровывают рабочим раствором
.
Образовавшееся по реакции (10.3) количество
протонов оттитровывают рабочим раствором![]() в присутствии фенолфталеина и выполняют
расчет содержания
в присутствии фенолфталеина и выполняют
расчет содержания![]() :
:
![]() .
(10.3)
.
(10.3)
