
- •Первый закон термодинамики
- •2. Второй и третий законы термодинамики
- •3. Термодинамические потенциалы
- •4. Химическое равновесие
- •5. Гетерогенное равновесие в однокомпонентных системах
- •6. Растворы
- •7. Электрохимия
- •8. Химическая кинетика
- •Термодинамические величины для некоторых веществ
- •Органические соединения
- •Криоскопические /к/ и эбуллиоскопические /е/ константы
- •Константы диссоциации некоторых слабых электролитов
5. Гетерогенное равновесие в однокомпонентных системах
Что такое фаза? Компоненты? Минимальное число компонентов?
Сколько фаз может быть в однокомпонентной системе? В двухкомпонентной системе?
При каких условиях правило фаз Гиббса может быть описано формулами
 ;
; ;
;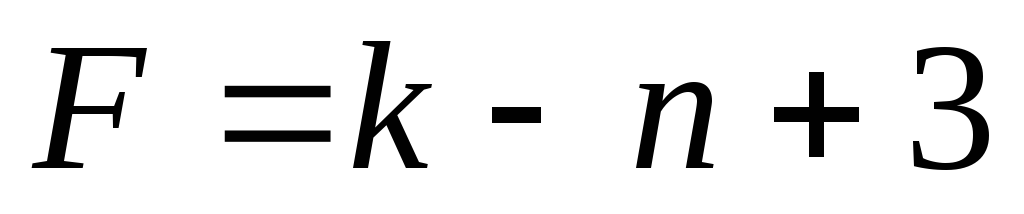 ?
?Сколько фаз может быть в системе
 ?
Какие фазы могут существовать в этой
системе?
?
Какие фазы могут существовать в этой
системе?Система представляет собой насыщенный раствор NaCl твердый NaCl, водяной пар. Сколько степеней свободы имеет эта система? Можно ли произвольно менять температуру в системе? Температуру и давление?
Жидкая вода находится в равновесии с водяным паром. Сколько степеней свободы в этой системе? Как связаны с ней между собой температура и давление?
Одним из методов анализа системы является исследование кривых охлаждения. Постройте кривую охлаждения для воды от -10℃ до +150℃ при P = 1 атм. как изменится кривая охлаждения, если процесс идет при P = 0,5 атм? P = 2 атм?
Почему температура тройной точки воды отличается от температуры плавления? Какую информацию о процессе плавления льда можно получить, исходя из температуры плавления и температуры тройной точки?
Почему ‘скрипит’ снег под ногами? Почему скрип прекращается, если температура воздуха близка к 0℃?
6. Растворы
Дайте определение разных способов выражения концентрации растворов: молярности, моляльности, мольной доли, весовой доли.
Выразите концентрации приведенных ниже водных растворов всеми способами, известными вам. В скобках приведена плотность растворов г/см ³ :
а) 6М раствор HCl /1,10/
б) 2,2М раствор NaOH /1,25/
в) 90% раствор
![]() /1,82/
/1,82/
г) 47% раствор
![]() /0,92/
/0,92/
Сколько грамм KOH необходимо для приготовления 3 л. 20% раствора /плотность раствора – 1,18 г/см ³/. Рассчитайте моляльность и молярность этого раствора и мольную долю воды в нем.
Как приготовить 100 г. раствора этилового спирта в бензоле, в котором мольная доля спирта составляет 0,1?
Смешано 300 г. 5% и 500 г. 10% растворов некоторого вещества. Определите концентрацию получившегося раствора.
Что такое идеальный раствор? Какие вещества могут образовывать растворы, близкие к идеальным?
Сформулируйте первый закон Рауля. Чем объясняются отклонения от него в реальных растворах?
Как рассчитать состав пара над идеальным раствором? Над реальным раствором?
Что такое ректификация? Нарисуйте схему ректификационной колонны.
Что такое азеотропная смесь? Как ее разделить?
Что такое абсолютный спирт? Как его получить?
Что такое парциальные мольные величины? Как их рассчитать?
Что такое коэффициент активности?
Что такое избыточные величины?
Под колпаком находится стакан с холодным сладким чаем и стакан с водой. Какой процесс пойдет? Когда он остановится?
Чистоту органических веществ нередко оценивают по температуре плавления и температуре кипения. Что вы думаете о правильности таких оценок?
Какой чай в стакане быстрей остынет, сладкий или не сладкий?
Всегда ли раствор замерзает при более низкой и кипит при более высокой температуре, чем чистый растворитель?
Что такое осмос? Осмотическое давление? Где встречается и используется явление осмоса дома? В биологических явлениях?
Какую информацию можно получить из криоскопических измерений?
Найти давление паров воды над раствором 30 г. сахара в 200 г.
 при
100℃.
При какой температуре закипит раствор?
при
100℃.
При какой температуре закипит раствор?Почему лед весной становится рыхлым? Почему замороженное мясо перед оттаиванием теряет твердость?
Водный раствор некоторого нелетучего вещества замерзает при -1℃. При какой температуре он будет кипеть? Какое давление пара будет над ним при 100℃?
Найти молекулярный вес растворенного вещества, если водный раствор 1 г. вещества в 50 мл. воды замерзает при температуре -0,015℃.
В виде каких частиц находится йод в растворе в нитробензоле, если раствор 0,1482 г. йода в 22,4051 г. нитробензола замерзает при 5,39℃. Чистый нитробензол замерзает при 5,82℃. Криоскопическая константа нитробензола – 8,1 К/л.моль.
Для раствора 0,8 г. белка в 150 мл. воды в осмометре обнаружено при 25℃ повышение уровня раствора на 248 мм. Вычислите молекулярный вес белка. При какой температуре этот раствор будет замерзать? Кипеть?
Рассчитайте
 процесса
диссоциации уксусной кислоты из
константы диссоциации. Что можно сказать
о самопроизвольности процесса
диссоциации?
процесса
диссоциации уксусной кислоты из
константы диссоциации. Что можно сказать
о самопроизвольности процесса
диссоциации?Что такое изотонический коэффициент? В каких пределах может меняться изотонический коэффициент в растворе
 при
изменении коэффициента?
при
изменении коэффициента?Что такое кажущаяся степень диссоциации сильного электролита в растворе?
Имеются растворы уксусной кислоты и ацетата натрия одинаковой концентрации. Какой раствор замерзнет при более низкой температуре? Какой раствор закипит при более высокой температуре?
Раствор тростникового сахара концентрацией 0,8718 М при Т=291°К изоосмотичен с раствором
 концентрацией
0,5М. рассчитайте изотонический коэффициент
и кажущуюся степень диссоциации в
раствореHCl.
Что является причиной неточности
расчета?
концентрацией
0,5М. рассчитайте изотонический коэффициент
и кажущуюся степень диссоциации в
раствореHCl.
Что является причиной неточности
расчета?Какое давление пара при 25℃ будет над водным раствором, содержащим 3 г. NaCl в 100 мл. раствора? Плотность раствора – 1 г/см³, степень диссоциации NaCl принять равной 1, давление пара над водой при 25℃ 31,68∙10² Па.
Раствор
 концентрацией
7,2% замерзает при -5℃.
Найти изотонический коэффициент и
кажущуюся степень диссоциации в
растворе.
концентрацией
7,2% замерзает при -5℃.
Найти изотонический коэффициент и
кажущуюся степень диссоциации в
растворе.Что такое pH? Как изменяется pH чистой воды при повышении температуры?
Чему равен pH раствора HCl концентрацией
 М?
М? М?
М? М?
М?Чему равен pH раствора KOH концентрацией
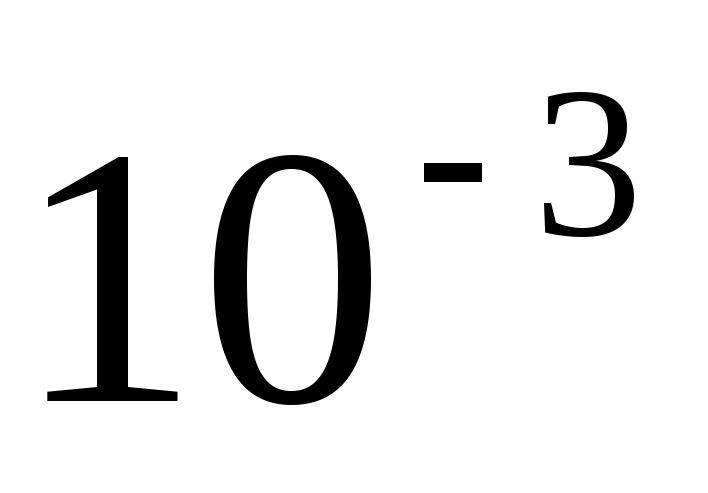 М?
М? М?
М? М?
М?Рассчитайте pH и степень диссоциации в растворе азотистой кислоты концентрацией
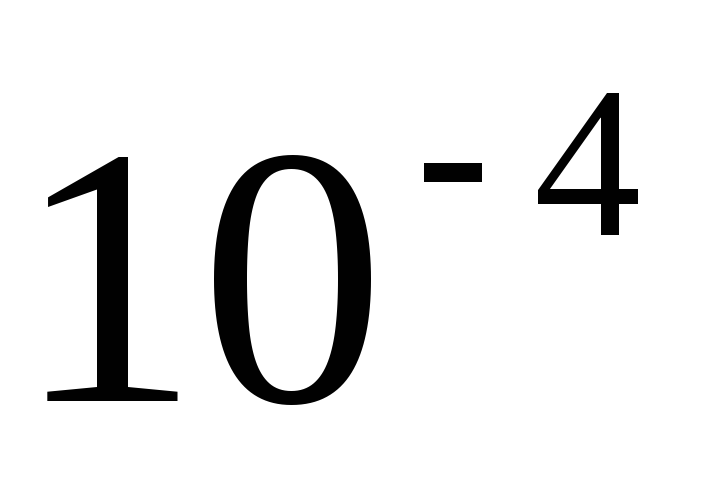 М?
возможно ли в этом случае применить
уравнение Оствальда? Почему?
М?
возможно ли в этом случае применить
уравнение Оствальда? Почему?К какой величине стремится степень диссоциации HCN при бесконечном разбавлении?
Предложите несколько способов оценки степени диссоциации слабого электролита.
pH раствора одноосновной кислоты концентрацией
 М
равен 4. Найти константу диссоциации
кислоты.
М
равен 4. Найти константу диссоциации
кислоты.Рассчитайте pH и степень диссоциации слабого электролита, в растворе 1 л. которого содержит:
а) 0,01 М
![]() и 0,01 М
и 0,01 М![]()
б) 0,1 М
![]() и 0,01 М
и 0,01 М![]()
в)
![]() МHCl
и 0,01 М NaCl
МHCl
и 0,01 М NaCl
г) 0,02 М
![]()
д) 0,05 М
![]() и
0,01 М
и
0,01 М![]()
Степень диссоциации слабого электролита считать равной 1.
Если разбавлять морс, приготовленный из ягодного сока с сахаром, то он становится более кислым /убедитесь практически, что это так/. Как можно объяснить это явление?
Как изменится pH раствора 0,01 М раствора HCl при введении в раствор KCl?
 ?
? ?
?Сколько граммов
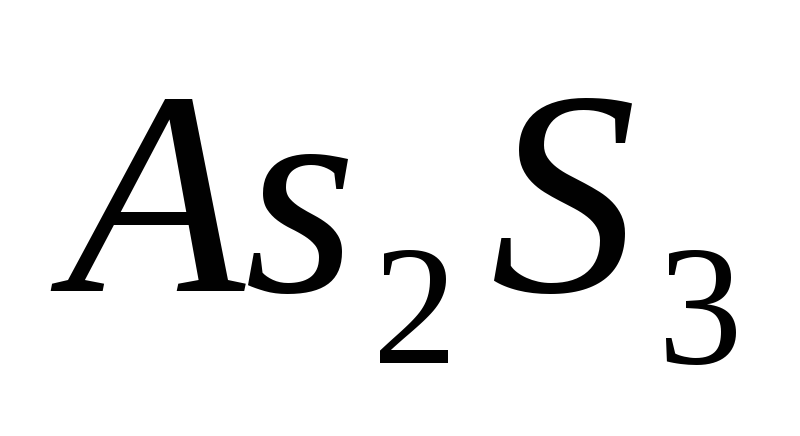 можно
растворить в 5 л. воды?
можно
растворить в 5 л. воды?Растворимость
 -
- моль/литр.
Рассчитайте произведение растворимости
моль/литр.
Рассчитайте произведение растворимости иpH
насыщенного раствора.
иpH
насыщенного раствора.Найти концентрацию ионов
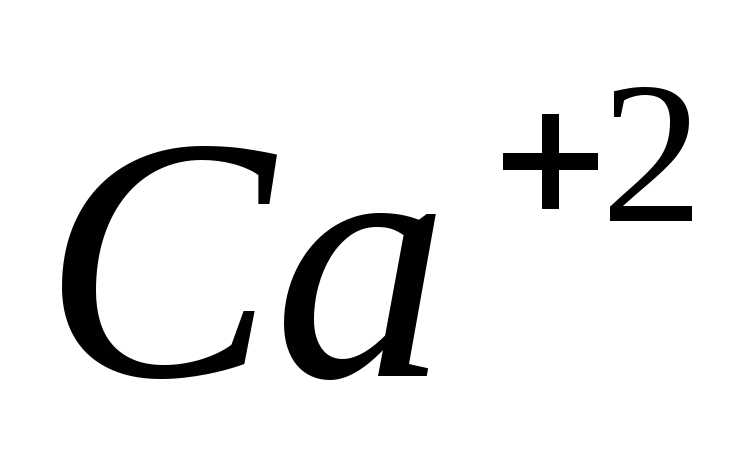 в
насыщенном растворе
в
насыщенном растворе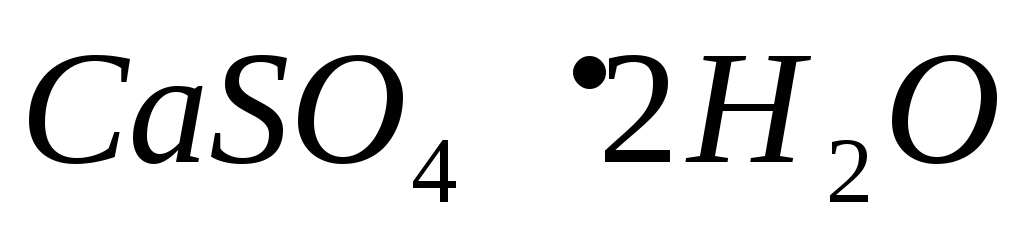 ,
если раствор содержит еще
,
если раствор содержит еще концентрацией
5г/л. степень диссоциации
концентрацией
5г/л. степень диссоциации принять
равной 1.
принять
равной 1.Выпадет ли осадок
 при
сливании 0,5 л. раствора
при
сливании 0,5 л. раствора концентрацией 0,5 г/л. и 1 л. раствора
концентрацией 0,5 г/л. и 1 л. раствора концентрацией 0,1 г/л. вычислить
концентрации всех ионов, находящихся
в растворе.
концентрацией 0,1 г/л. вычислить
концентрации всех ионов, находящихся
в растворе.Как изменится концентрация насыщенного раствора
 ,
если в раствор, находящийся в равновесии
с твердым
,
если в раствор, находящийся в равновесии
с твердым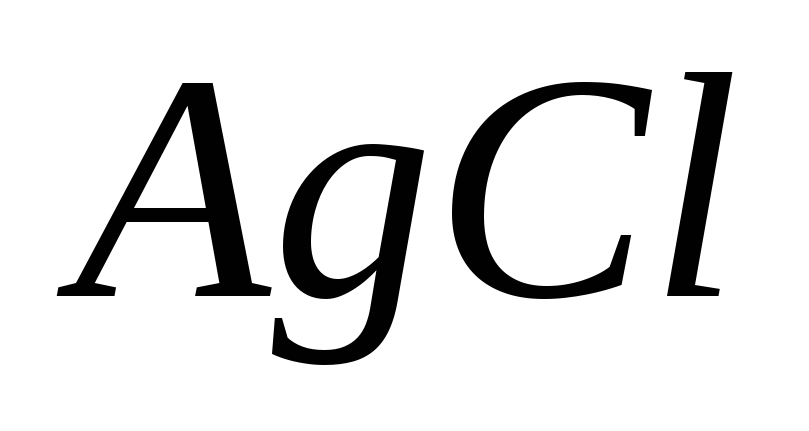 ввести
ввести ?
?
