- •Гликозаминогликаны Распространение в природе
- •Локализация различных гликозаминогликанов в тканях живого организма
- •Получение
- •Химическое строение и молекулярная структура
- •Моносахаридный состав и структура различных классов гликозаминогликанов
- •Физические свойства
- •Строение и функции протеогликанов
- •Характеристика углевод-белковой связи различных протеогликанов
- •Биосинтез
- •Классификация ферментов гиалуронидаз
- •Межклеточный матрикс
- •Литература
Биосинтез
Полисахаридные цепи гликозаминогликанов синтезируются путем последовательного присоединения остатков моносахаридов. Донорами моносахаридов обычно являются соответствующиенуклеотид-сахара. Реакции синтеза гликозаминогликанов катализируют ферменты семействатрансфераз,локализованные на мембранах аппарата Гольджи и обладающие абсолютной субстратной специфичностью к данному классу полисахаридов.
Белок кора синтезируется на полирибосомах. К нему присоединяются моносахариды связующей области и затем наращивается полисахаридная цепь. Сульфатирование углеводной части протеогликана происходит под действием фермента сульфотрансферазы. Донором сульфатной группы выступает ФАСФ.
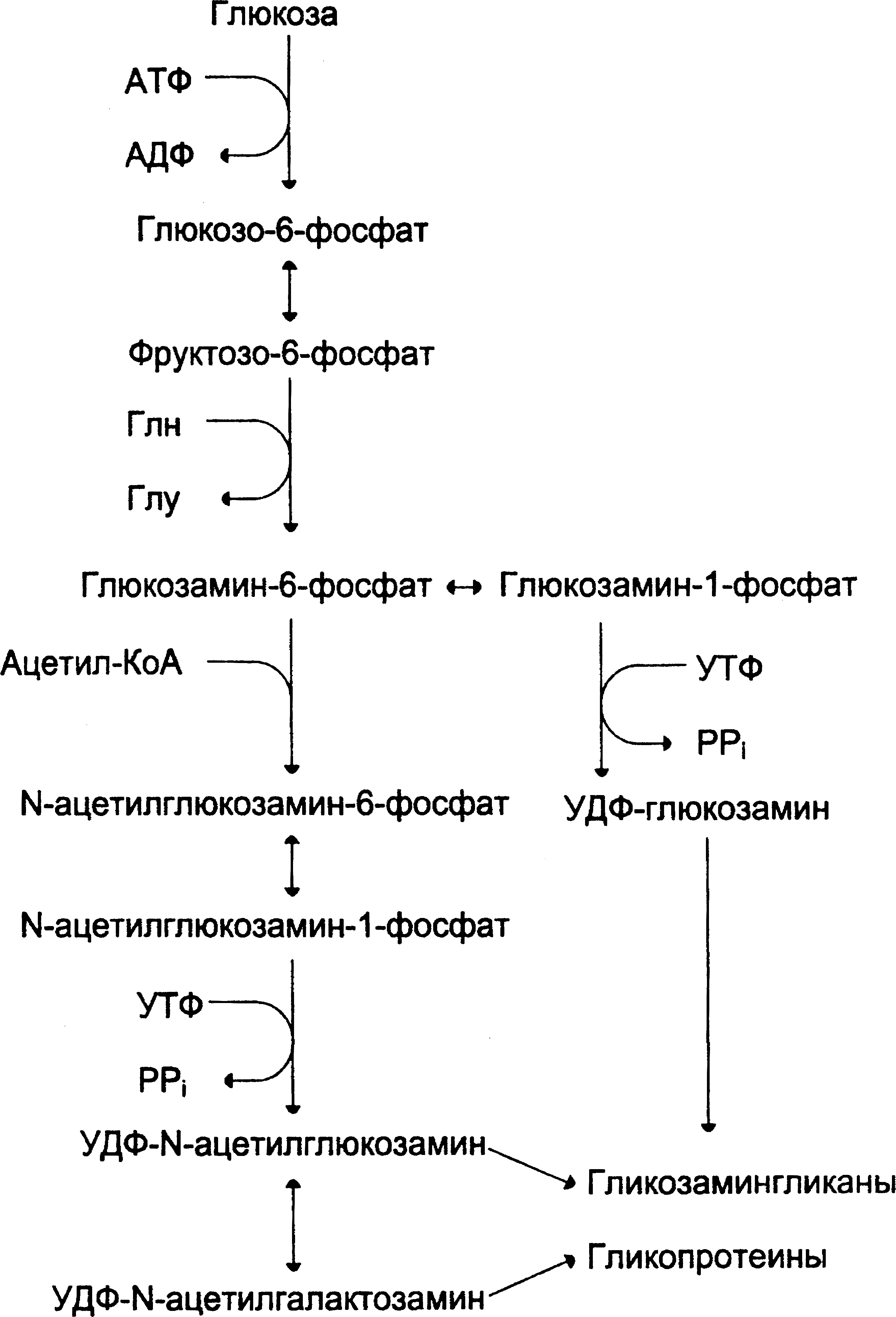
Аминосахара синтезируются из глюкозы.Непосредственными предшественникамиN-ацетилглюкозамина,N-ацетилгалактозамина и сиаловой кислоты являетсяфруктозо-6-фосфат.ИсточникомNH2-группы в этих сахарах служит аминокислотаглутамин.Аминосахар далее ацетилируется с помощью ацетил-КоА (коэнзим А). Активированными формами этих аминосахаров служат ихУДФ-производные(рис.2).
|
|
|
Рис.2. Схема синтеза аминосахаров. |
Источниками полиглюкуроновой кислотыв живом служит пища, внутриклеточное лизосомальное разрушение гликозаминогликанов и синтез глюкуроновой кислоты. Активированная форма глюкуроновой кислоты (УДФ-глюкуронат) образуется при окислении УДФ-глюкозы (рис.3).
|
|
|
Рис.3. Окисление УДФ-глюкозы до УДФ-глюкуроната. |
L-идуроновая кислота образуется в результате реакции эпимеризации УДФ-производных D-глюкуроновой кислоты (рис.4).
|
|
|
Рис.4.Реакция эпимеризации УДФ-ацетилглюкозамин – УДФ-ацетилгалактозамин. |
На процесс образования гликозаминогликанов влияют глюкокортикоиды, половые гормоны и др., оказывающие ингибирующее действие на синтез гиалуроновой кислоты и сульфатированных гликозаминогликанов.
Деструкция полисахаридных цепей гликозаминогликанов осуществляетсяэкзо-иэндогликозидазамиисульфатазами (гиалуронидазой, глюкуронидазой, галактозидазой, идуронидазойи др.).Гиалуронидазы – общее название группы ферментов различного происхождения, способных катализировать реакцию распада гликозаминогликанов. Гиалуронидазы можно классифицировать на типы с использованием таких признаков, как источник фермента, используемые субстраты, условия и тип катализируемой реакции, образующиеся продукты (табл.3). Используются в медицине в основном при заболеваниях, сопровождающихся ростом соединительной ткани, а также для увеличения скорости деградации лекарств и вакцин.
Олигомерные продукты гликозаминогликанов поступают в клетку из внеклеточного пространства по механизму эндоцитозаи заключаются в эндоцитозные пузырьки, которые затем сливаются с лизосомами. Лизосомальные гидролазы продолжают дальнейшую биодеградацию олигомерных цепей гликозаминогликанов, обеспечивая постепенное полное расщепление до мономеров.
Таблица № 3
Классификация ферментов гиалуронидаз
|
Тип |
Название |
Номер |
Источник получения |
Подтип (диапазон активности) |
Условия и тип катализируемой реакции |
Биологическая активность |
|
Тип 1Гиалуронидазы тестикулярного типа |
Гиалуронат-эндо-β-N-ацетилгексоза-минидазы |
3.2.1.35 |
Семенники и сперма млекопитающих, молоки рыб |
Ia Тестикулярная гиалуронидаза (рН 4,0-7,0, до 500С) |
Гидролизуют β-N-ацетилгексозамидные связи до тетрасахаридов. Проявляют трансгликозилазную активность (перенос дисахаридных фрагментов между молекулами субстрата) |
Способствуют процессу оплодотворения яйцеклетки, выступают в качестве пищеварительного фермента |
|
Лизосомы клеток различных тканей, физиологические жидкости: сыворотка крови, синовиальная жидкость |
Ib Лизосомальная гиалуронидаза (рН 3,5-4,5) | |||||
|
Iс Субмандибулярная (рН 3,5-4,5) | ||||||
|
Тип IIГиалуронидаза слюны пиявок |
Гиалуронат-эндо-β-глюкуронидаза |
3.2.1.36 |
Пиявки |
− (рН 6,0) |
Гидролизуют β-гликозидные связи в гиалуроновой кислоте до тетрасахаридов |
Увеличивают проницаемость капилляров |
|
Тип IIIМикробные гиалуронидазы |
Гиалуронат-лиазы, гиалуронат-эндо-β-N-ацетилгексоза-минидазы |
4.2.99.1 |
Бактерии Clostridium perfringens, Proteus vulgaris, родов Pneumococcus, Streptococcus, None, Flavobacterium |
IIIа |
Гидролизуют β-N-ацетилгексозамидные связи, одновременно дегидратируя ОН-группу у С4остатока уроновой кислоты на невосстанавливающем конце молекулы* |
Увеличивают проницаемость тканей за счёт снижения вязкости гликозаминогликанов |
|
Бактерии рода None(содержатся в почве) |
IIIb |
Примечание. * Конечными продуктами ферментативной реакции в случае гиалуронидазы типа IIIa являются дисахариды с аминосахаром на восстанавливающем конце молекулы. В случае гиалуронидазы типа IIIb субстратом является исключительно гиалуроновая кислота, а конечными продуктами являются тетра- и гексасахариды сN-ацетилглюкозамином на восстанавливающем конце молекулы. Оптимальные для проявления ферментативной активности микробных гиалуронидаз значения рН различаются в зависимости от природы субстрата: для сернокислых эфиров (хондроитинсульфаты, дерматансульфат) оптимальными являются значения рН 8,0 — 9,0, в то время как для гиалуроновой кислоты и хондроитина — значения в районе 6,8.