- •Банк данных
- •Введение
- •Классификация и номенклатура природных полисахаридов
- •Группы моносахаридных компонентов альдогексоз, входящих в состав макромолекул полисахаридов
- •Номенклатура и структурные формулы энергетически выгодных конформаций основных моносахаридов, входящих в состав макромолекул природных полисахаридов
- •Важнейшие представители полисахаридов
- •Литература
Группы моносахаридных компонентов альдогексоз, входящих в состав макромолекул полисахаридов
|
Заместители в моносахаридном компоненте |
|
|
|
|
X = CH2OH Y = OH |
D-глюкоза |
D-манноза |
D-галактоза |
|
X= COOH Y= OH |
D-глюкуроновая кислота |
D-маннуроновая кислота |
D-галактуроновая кислота |
|
X = H Y = OH |
D-ксилоза |
D-ликоза (не обнаружена) |
L-арабиноза |
|
X = CH2OH Y = NH CO CH3 |
N-ацетил-D-глюкозамин |
N-ацетил-D-маннозамин |
N-ацетил-D-галактозамин |
|
X = CH(OH) CH2OH Y = OH |
D-глицеро- иL-глицеро-D-глюкогептоза |
L-глицеро-D-манногептоза, D-глицеро-D-манногептоза |
D-глицеро-D-галактогептоза |
Символы D-иL-(см. табл.1) означают принадлежность моносахарида кD-илиL-генетическому рядуальдоз или кетоз, определяемую по конфигурации последнего (считая от альдегидной или кетонной группы)асимметрического атома углерода(хиральный центр). Если она совпадает с конфигурацией хирального центраD-глицеринового альдегида, то моносахарид относится кD-ряду, еслиL-глицеринового альдегида – кL-ряду.
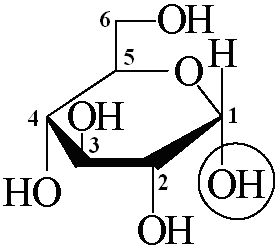
Звенья остатков моносахаридов входят в состав полисахаридной цепи преимущественно в форме циклических пиранозных (см. структурные формулы в табл.1), либофуранозных структур, представленных-и-аномернымиформами. Циклическая форма, у которой полуацетальный гидроксил расположен по одну сторону с ОН-группой, определяющей конфигурацию моносахарида (принадлежность кD- илиL-ряду), называется-формой, по разные стороны –-формой (рис.3).
-D- и-D-аномеры альдоз –диастереомеры, поскольку отличаются по конфигурации расположения заместителей только при первом хиральном центре (см. рис.3, ОН-группы, обведенные окружностью). Они являются такжеоптическими стереомерамиигеометрическими изомерами. Кроме того, аномеры легко переходят друг в друга в растворах, т.е. являются еще истерео-таутомерами.
|
(а) |
(б) | |
|
|
| |
|
Рис.3.Аномерные формы (диастереомеры)D-глюкопиранозы: -D-аномер –-D-глюкопираноза (а);-D-аномер –-D-глюкопираноза. | ||
Предполагаемый механизм и стереохимия процесса аномеризациипоказана на рис.4 на примереD-глюкозы, т.е. взаимопревращения одного аномераD-глюкозы в другой. Постулируется согласованное действиеэлектрофильной(электронопритягивающей) инуклеофильной(электронодонорной) частиц на две легко поляризуемые связи в молекуле глюкопиранозы.
|
|
|
Рис.4.Механизм и стереохимия образования аномеровD-глюкопиранозы. |
Электрофильными и нуклеофильными частицами могут быть диполи молекул воды или содержащиеся в ней сольватированные ионы Н+и ОН. Это так назваемыйpush-pull механизм. В качестве промежуточного молекулярного соединения предполагается образование альдо-формы глюкопиранозы. В зависимости от того, как расположена плоская карбонильная группа: в позиции1аили1б(см. рис.4) в момент взаимодействия с атомом кислорода спиртового гидроксила, при С5, образуется либо-D-глюкопираноза (рис.4,2), либо-D-глюкопираноза (3). Процесс обратим и идет до установления термодинамического равновесия. Скорость этого процесса увеличивается при нагревании раствора, при введении кислот и оснований.
Шестичленный пиранозный гетероцикл, в отличие от пятичленного фуранозного, не плоский. Он может принимать различные конформации: кресло,ванна. Широкое применение расчетных методов конформационного анализа и различных методов физико-химических исследований (спектроскопия ЯМР1Н и13С, масс-спектрометрия, хроматография, рентгеноструктурный анализ и др.) позволило установить, что наиболее устойчивыми являются конформации креслаС1и1С. Обычно они настолько отличаются друг от друга по запасу свободной энергии, что реализуется из них лишь одна.
Например, в молекуле -D-глюкопиранозы в конформации кресла С1 все объемные полярные группы (-ОН, и особенно –СН2ОН) находятся наэкваториальных связях (т.е. расположенныхпараллельноплоскости экватора пиранозного цикла), а все атомы водорода – нааксиальных(т.е.перпендикулярноплоскости) (рис.5). Это обеспечивает максимально возможные расстояния между полярными группами, а потому и минимальные силы их взаимного отталкивания.
|
|
|
Рис.5.Конформации кресла 1С и С1молекул-D-глюкопиранозы. |
В стереоструктуре С1 молекула
-D-глюкопиранозы
имеет избыток конформационной энергии![]() Е= 8.6
кДж/моль, тогда как в конформации 1С
запас свободной конформационной энергии
максимальный
Е= 8.6
кДж/моль, тогда как в конформации 1С
запас свободной конформационной энергии
максимальный![]() Е= 33.5
кДж/моль. Так как все полярные группы
оказываются в крайне невыгодном
аксиальном положении, они сближаются
друг с другом. Взаимное отталкивание
этих групп создает в молекуле большие
напряжения и сильно дестабилизирует
ее, обуславливая конверсионный сдвиг
в сторону конформации С1 (рис.5).
Е= 33.5
кДж/моль. Так как все полярные группы
оказываются в крайне невыгодном
аксиальном положении, они сближаются
друг с другом. Взаимное отталкивание
этих групп создает в молекуле большие
напряжения и сильно дестабилизирует
ее, обуславливая конверсионный сдвиг
в сторону конформации С1 (рис.5).
Для -D-глюкопиранозы
в конформации С1 запас свободной
конформационной энергии в сравнении с-D-глюкопиранозой
в той же конформации возрастает и
составляет![]() Е= 10.0
кДж/моль, поскольку появился один элемент
дестабилизации – аксиальное положение
глюкозидного гидроксила. Соответственно,
в конформации 1С экваториальное положение
этой группы несколько стабилизирует
молекулу (
Е= 10.0
кДж/моль, поскольку появился один элемент
дестабилизации – аксиальное положение
глюкозидного гидроксила. Соответственно,
в конформации 1С экваториальное положение
этой группы несколько стабилизирует
молекулу (![]() Е= 27.4
кДж/моль), но и в этом случае конформация
С1 остается единственной энергетически
выгодной.
Е= 27.4
кДж/моль), но и в этом случае конформация
С1 остается единственной энергетически
выгодной.
Основной формой существования в растворе (и в кристаллах) D-фруктозы является-D-фруктопираноза (рис.6). Ее молекулы в растворах имеют устойчивую конформацию кресла 1С, в которой аномерная НО-группа (фруктозидная) находится в аксиальном положении.
|
|
|
Рис.6.Соотношение различных формD-фруктозы в воде в состоянии равновесия при 20С. |
Конверсии гетероцикла 1С С1, как и в случаеD-глюкопиранозы, очевидно не происходит, так как при этом самая объемная СН2ОН-группа должна перейти из экваториального в аксиальное положение одновременно с третьим и четвертым спиртовым гидроксилами (рис.6), а это приведет к существенному увеличению свободной энергии. В водном растворе в термодинамическом равновесии с-D-фруктопиранозой находится 23.6% фруктофураноз, но совершенно нет ни кето-формыD-фруктозы, ни-D-фруктопиранозы (рис.6). Последняя не реализуется, поскольку должна обладать большим избытком конформационной энергии. При повышении температуры раствора содержание фруктофураноз уменьшается, а при нагревании – повышается.
Структурные формулы моносахаридов, остатки которых наиболее часто встречаются в составе макромолекул природных полисахаридов, с изображением энергетически выгодной конформации цикла приведены в таблице 2*.
Моносахаридные фрагменты (мономерные звенья) макромолекул природных полисахаридовсвязаны друг с другом посредствомО-гликозидных (ацетальных) связей.Данный тип связей образуется в результате взаимодействия альдегидной группы одного элементарного моносахаридного звена макромолекулы со спиртовой гидроксильной группой другого звена.
Важной характеристикой строения макромолекулярной цепи природных полисахаридов является конфигурация гликозидной связи. В зависимости от конфигурации полуацетального гидроксила остатка моносахарида связи между элементарными звеньями могут быть-или-гликозидными. При-гликозидной связи конфигурация асимметричных углеродных атомов в двух соседних мономерных звеньях (пиранозных или фуранозных) имеет противоположную пространственную ориентацию, а при-конфигурации – наоборот.
В зависимости от спиртового гидроксила, принимающего участие в образовании ацетальной связи, различают четыре типагликозидных связей:1→4-,1→6-,1→3-и1→2-(указаны в порядке уменьшения распространения). Цифры в обозначении связи соответствуют нумерации углеродных атомов пиранозного или фуранозного цикла (см. рис.3, рис.5), участвующих в образовании гликозидной связи. (Порядок и направление нумерации углеродных атомов показаны на рис.3 на примереD-глюкопиранозы.)
* Более подробно современные данные о структуре и стереохимии моносахаридов изложены в мультимедийной версии «Пространственные структуры природных полисахаридов» (см. компакт-диск, прилагается к текстовой версии банка данных «Природные полисахариды»).
Таблица 2.