
- •Саратовский государственный университет
- •1. Номенклатура неорганических соединений (н. Н. С.)
- •Тривиальные названия
- •Простые вещества. Металлы и неметаллы
- •Бинарные соединения
- •Гидроксиды (кислородсодержащие кислоты, основания, амфотерные гидроксиды)
- •Соли кислородсодержащих кислот
- •Номенклатура органических соединений (н. О. С.)
Соли кислородсодержащих кислот
Соли – это сложные вещества, которые можно рассматривать как продукты взаимодействия кислоты с основанием. Соли по составу подразделяются на средние, кислые, оснóвные, двойные, тиосоли, оксосоли, пероксосоли и др. В формулах средних солей на первом месте записывают химические символы катиона, затем – кислотного остатка (аниона). В формулах кислых солей между ними записывают знак водорода, а в формулах оснóвных солей – формулу гидроксигруппы.
Названия средних солей составляют из названия кислото-образующего элемента с добавлением соответствующих окончаний -ат и -ит в случае проявления из двух значений степени окисления высшей или низшей соответственно и названия катиона в родительном падеже с указанием его степени окисления, если она может быть переменной, например: NaNO3 – нитрат натрия; Fe(NO3)3 – нитрат железа (III); Na2SO3 – сульфит натрия.
Если элемент образует соединения с тремя степенями окисления, то для названия соли с низшей степенью окисления прибавляют приставку гипо- и суффикс -ит, например: KNO3 – нитрат калия; KNO2 – нитрит калия; K2N2O2 – гипонитрит калия. Если элемент образует соединения с четырьмя степенями окисления, то для названия соли с высшей степенью окисления прибавляют приставку пер-, например: КClO4 – перхлорат ка-лия; КClO3 – хлорат калия; КClO2 – хлорит калия; КClO – гипохлорит калия. По систематической номенклатуре названия средних солей составляют так же как название соответствующей кислоты, однако вместо слова водород ставят название катиона в родительном падеже, например:
КClO3 – триоксохлорат (V) калия; K2Cr2O7 – гептаоксодихромат (VI) дикалия. Кислые и оснóвные соли содержат в названии приставку соответственно гидро- или гидроксо-, например: NaHSO4 – гидросульфат натрия; (CuOH)2CO3 – дигидроксокарбонат (IV) димеди (II), или гид-роксокарбонат меди (II). Многие соли при кристаллизации из раствора образуют кристаллогидраты, например: CuSO4∙5H2O – пентагидрат сульфата меди.
Номенклатура органических соединений (н. О. С.)
В начальный период развития органической химии вещества получали случайные, тривиальные назв., основой которых служили природные источники, характерные свойства веществ, имена учёных. Такие названия в ряде случаев сохранились и до сих пор.
Научное название органического вещества должно отражать его химическое строение. Для этого употребляют сложные слова-названия, построенные по определённым правилам из обозначений более простых составных частей соединения и цифр или букв, указывающих расположение этих частей. Первой была постепенно сложившаяся во 2-й половине 19 в. рациональная номенклатура. Основу рационального названия составляет простой (но не обязательно первый) член данного гомологического ряда; названия "достраивают", указывая дополнительно (в приставке) имеющиеся радикалы и др. структурные части; их положение обозначают греческими буквами. Примерами могут служить следующие названия (принятая за основу названия часть молекулы выделена в формулах пунктиром):
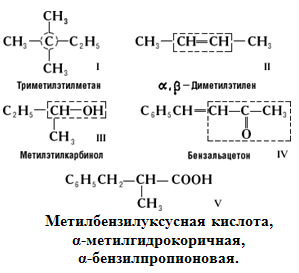
В зависимости от выбранной основы названия одно вещество может иметь и несколько рациональных названий, как в примере V.
Заместительная номенклатура, представляет собой дальнейшее развитие Женевской и Льежской номенклатур. Основой названия по заместительной номенклатуре служит главная углеродная цепь и главная функциональная группа (функция, см. таблицу 1). **При употреблении этого варианта названий углерод функциональной группы (отделённый условно квадратной скобкой) считается составной частью углеродной цепи.
Примерами таких названий могут служить:
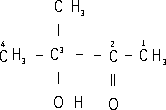 3-Окси-3-метилбутанон-2
3-Окси-3-метилбутанон-2
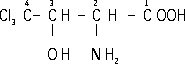 2-Амино-3-окси
4,4,4-трихлорбутановая кислота
2-Амино-3-окси
4,4,4-трихлорбутановая кислота
При помощи специальных приставок и суффиксов указывают имеющиеся в формуле дополнительные радикалы, кратные связи, др. функции. Их число обозначают соответствующими числительными (ди-, три-, тетра- и т. д.), а положение — номером соответствующего атома главной цепи. Последнюю обозначают корнем названия соответствующего углеводорода (C1 — мет, C2 — эт; C3 — проп.; C4 — бут, C5 — пент и т.д.), характер углерод-углеродных связей — суффиксами -ан (насыщенная цепь), -ен (двойная связь), -ин (тройная связь), боковые цепи — названиями соответствующих радикалов. Приведённые выше соединения получат по заместительной номенклатуре IUPAC следующие названия: (I) — 2,2-диметилбутан; (II) — бутен-2; (III) — бутанол-2; (IV) — 4-фенил-бутен-3-он-2; (V) — 3-фенил-2-метилпропановая кислота.
В названии соединений с несколькими разными функциями в суффиксе оставляют обозначение только главные функции, а остальные, как и боковые цепи (радикалы), перечисляют в приставке (префиксе). При этом одна и та же функция в суффиксе (как старшая) и в префиксе (как младшая) имеет разные обозначения (см. таблицу 1).
Международные
правила не фиксируют деталей написания
названий (слитно или через чёрточки,
расположение цифровой части, употребление
точек или запятых и т. д.), оставляя это
на усмотрение отдельных стран в
соответствии с языковыми особенностями
и традициями.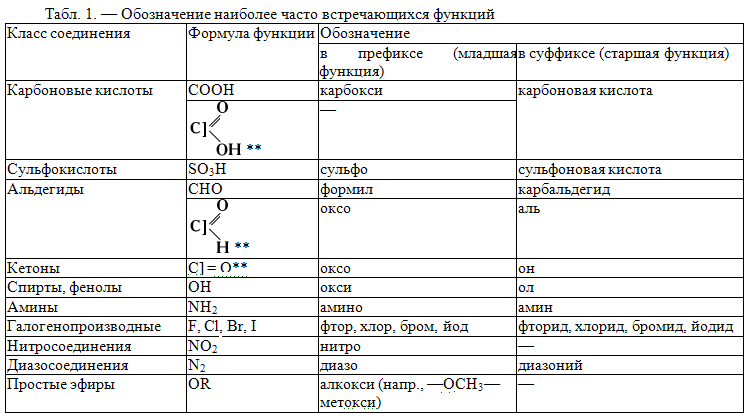
Мои вопросы по содержанию темы:
