
Лабораторная работа
.docЛабораторная работа №1
Тема: посуда и назначение, правила работы на весах.
Цель: познакомится со стеклянной и фарфоровой посудой; узнать устройство и правила работы на весах.
Оборудование: посуда, весы, разновесы.
Ход работы: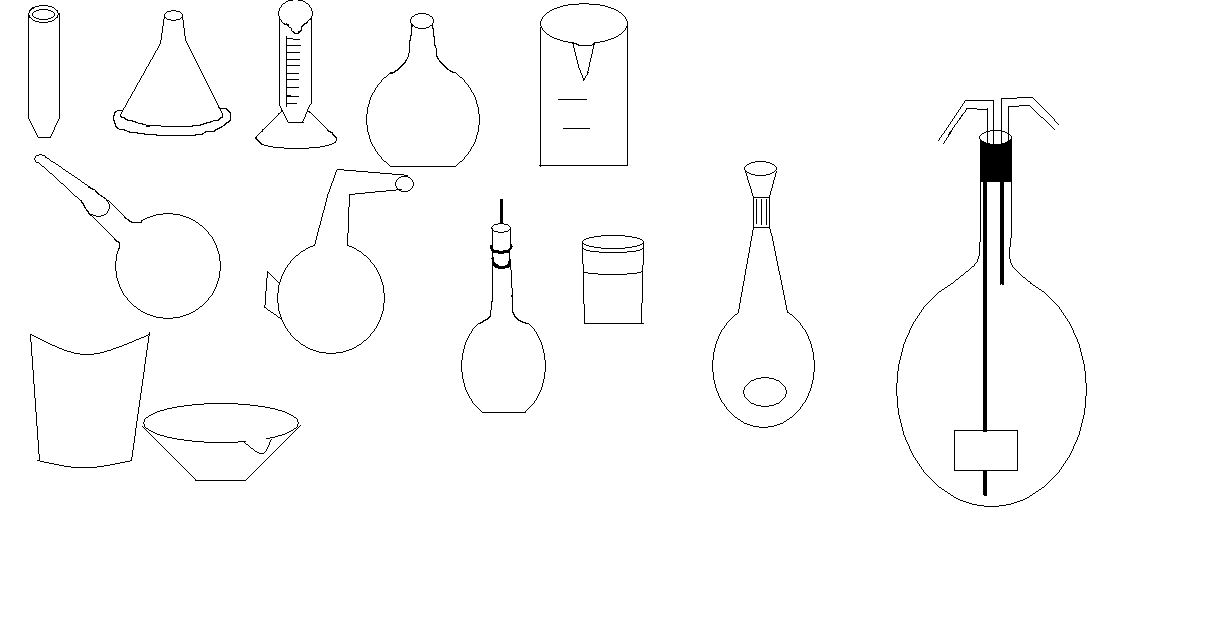
Весы:
1)Коромысло
2)Серьги
3)Чашки весов
4)Стрелки
5)Столбик
6)Отвес
7)Шкала
8)Арретир
9)Предметный столбик с ножками.
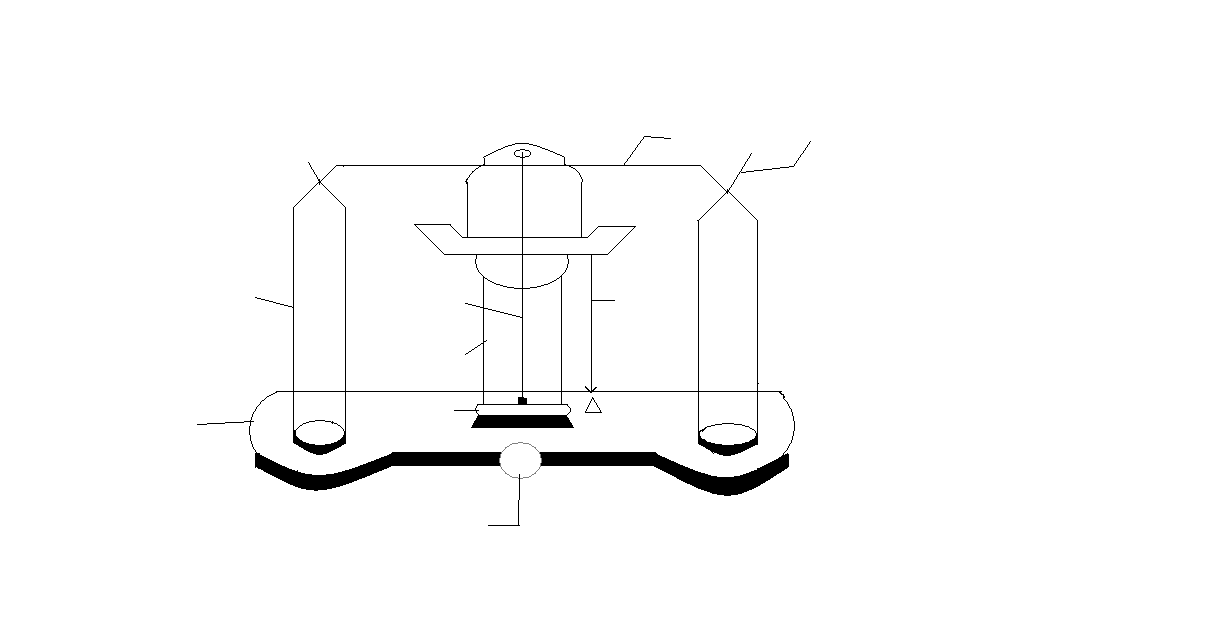
Правила работы на весах:
1)Взвешивать необходимо сидя.
2)Арретиром поднять чашу весов.
3)По левую чашу весов поместить взвешиваемый предмет, а правую-развесы
4)Добиться точности весов.
5)Записать результаты веса.
6)Опускаем арретиром чашу весов
7)Снимаем с чаши весов все предметы.
Лабораторная работа №2
Тема: реакции ионного обмена. Испытание растворов индикаторами
Цель: Закрепить знания, полученные при изучении темы «Ионные реакции. Гидролиз»; формировать навыки практической работы с веществами.
Оборудование: пробирки, стеклянные палочки, спиртовка, реактивы: CuSO4, CaCl2, Al2(SO4)3, NaOH, Na3PO4, Ba(NO3)2,Na2SO4, Na2CO3, H2SO4, ZnCl2.,индикаторы(метилоранж,фенолфталин,лакмус.).
Ход работы:
Опыт №1
Опыт №2
Опыт №3
Опыт №4
Исследование растворов индикаторами.
|
Раствор солей |
Цвет индикатора Лакмус Метилоранж Ф |
|
NaOH |
Желтый Желтый красный |
|
H2SO4 |
Розовый Розовый белый |
|
Na2SO4 |
Красный Оранжевый белый |
Лабораторная работа №3
Цель: научится определять концентрацию раствора, исходя из количества компонентов и путем титрования, уметь готовить растворы заданной концентрации.
Оборудование: Мерные цилиндры, мерные колбы на 100мл, 200мл, 250мл, стеклянные палочки, пипетка, весы, бюретка, штатив, воронка.
Опыт №1
Вывод: нормальность кислот, установленная по щелочи равна 0,19м
Лабораторная работа №4
Качественные реакции на ионы 2 и 3 валентного порядка.
Цель: Познакомится с основными качественными реакциями на ионы железа.
Оборудование: Пробирки, плитка, реактивы.
Опыт№1
FeCl3 + 3NaOH ----- Fe(OH3) + 3NaCl
Fe(NO3)2 + 3NaOH -----Fe(OH ) + NaNO
Ржавый осадок в обеих реакциях
Опыт№2
Fe(Cl ) + Na HPO ----- Fe (HPO ) + NaCl
Fe(NO ) + Na HPO ----- FeHPO + NaNO
Белый осадок в обеих реакциях
Опыт №3
FeCl + NaCO ----- Fe (CO ) + NaCl
Fe(NO ) + Na CO ----- FeCO + NaNO
Выделение газа, помутнение раствора
Опыт№4
FeCl + K [Fe(HN )] ---------- Fe [Fe(CN ) + KCl
Темно-синий осадок
Опыт№5
FeCl + NH CNS ---------- Fe(CNS) + NH Cl
Кроваво-красный осадок
Опыт№6
FeNO + H [Fe(CN )] ---------- Fe [Fe(CN )] + KNO
Лабораторная работа №5
Качественные реакции на анионы.
Цель: Познакомиться с качественными реакциями на анионы; уметь определять анионы по выпавшему осадку или изменению окраски раствора.
Оборудование: Пробирки, стеклянная палочка, сушильный шкаф, реактивы.
Опыт№1
Na CO + BaCl ----- NaCl + BaCO
Без изменений
Опыт№2
Na SO + KMnO ----- NaMnO + K SO
Розовый осадок
Опыт№3
Na SO + H SO ----- Na SO + H SO
Без изменений
Опыт№4
Na SO + KMnO ---------- NaMnO + K S O
Раствор обесцвечивается
Опыт№5
HCl + AgNO ----- AgCl + HNO
Белый творожистый осадок
Опыт№6
H SO + BaCl ----- HCl + BaSO
Белый осадок
Опыт№7
HCl + CaCO ----- H CO + CaCl
Реакция протекает бурно
Опыт№8
MgCl + NH OH ----- Mg(OH) + NH Cl
Образование мути
Mg(OH) + NHCl ----- MgCl + NH OH
Растворение мути
MgCl + Na HPO ----- MgHPO + NaCl
Белый осадок
Лабораторная работа №6
Определение содержания железа в соли железа
Цель: Определить содержание железа в сои железа FeCl ; научиться пользоваться приборами.
Оборудование: Стакан, колбы, стеклянная палочка, плитка, муфельная печь, фильтр, воронка, тигель, реактивы.
Q = a F
Где а-вес осадка
F- фактор перерасчета
Лабораторная работа №7
Цель: Изучить свойства спиртов на примере трехатомного спирта – глицерина
Оборудование: Пробирки, стеклянная палочка, реактивы.
Опыт №1: растворение глицерина в воде.
В 2 мл не растворяется, но в 4-6 растворяется.
Опыт №2: взаимодействие глицерина с гидроксидом меди.
NaOH + CuSO ----- Cu(OH) + Na SO
CH –O-H CH -O
H-O
Cu ----- CH-O + H O
CH-O-H + H-O
CH -OH
CH –O-H Глицерат меди.
Осадок растворяется
Лабораторная работа №8
Химические свойства карбоновых кислот
Цель: Уметь опытным путем получать уксусную кислоту, изучение свойства уксусной кислоты на примере конкретных реакций.
Оборудование: Пробирки, газоотводная трубка, спиртовка, стеклянная палочка, реактивы.
Опыт №1 Получение уксусной кислоты

2СH COONa + H SO ----- CH COOH + Na SO
Опыт №2 Взаимодействие уксусной кислоты с металлами.
CH COOH + Mg ----- CH (COO) Mg + H
CH COOH + Zn ----- (CH COO) ZN + H
Реакция идет медленно.
Опыт №3 Взаимодействие уксусной кислоты с основаниями
NaOH + CH COOH ---------- CH COONa + H O
Малиновая окраска становится бесцветной. Реакция нейтрализации
Опыт №4 Взаимодействие уксусной кислоты со спиртами
CH COOH + C H OH --------------- CH COOC H + H O
Лабораторная работа №9
Жиры и их свойства. Омыление жиров.
Цель: Закрепить знания по теме «Жиры» на практике, уметь проводить реакции, доказывающие непредельный характер жиров, провести омыление
Оборудование: Пробирки, фарфоровая чашка, плитка, стеклянная палочка, колбы, реактивы
Опыт №1 Доказательство непредельного характера жиров.
В пробирке с твердым жиром обесцветилась лучше, это доказывает непредельный характер твердого жира.
Опыт№2 Омыление жиров.
На поверхности воды образовалось мыло.
Опыт №3 Сравнительные свойства мыла.
А) 2СH (CH ) CH + SO ----- 2H O + 4CH (CH ) C
Малиновый цвет.
Б)
Лабораторная работа №10
Изучение свойств белков.
Цель: Закрепить знания, полученные при изучении темы «Белки» на практике, провести химические реакции на белки, изучить их свойства.
Оборудование: Раствор куриного белка, куриные перья, спиртовка, зажим, пробирки, реактивы.
Опыт№ 1 Горение куриных перьев
Перо, сгорая, сворачивается и темнеет. Появляется запах жженого пера.
Опыт №2 Денатурация белков.
Природная структура белка разрушается и уплотняется.
Опыт №3 Цветная реакция на белок.
А) Белок сворачивается и белеет. Раствор стал светлее.
Б) Белок в местах взаимодействия твердеет, не давая взаимодействовать с кислотой. Окраска раствора пожелтела.
Опыт №4
Белок в воде е растворяется.
Лабораторная работа №11
Химические свойства углеводов: глюкозы, сахарозы, крахмала.
Цель: Практически подтвердить свойства углеводов; продолжить формирование навыков практической работы с веществами и оборудованием.
Оборудование: Пробирки, стеклянная палочка, плитка, реактивы.
Опыт №1 Взаимодействие глюкозы с гидроксидом меди.
R-C + 2Cu(OH) ----- R-C + 2CuOH + H O
2CuOH ----- Cu O + H O
Опыт №2 Взаимодействие сахарозы с гидроксидом кальция.
С H O * CaO * 2H O + CO ----- C H O + CaCO + 2H O
Сахароза и кальций плохо растворяются в воде, однако при продувании воздуха растворяемость увеличилась.
Опыт №3 Приготовление раствора крахмального клейстера. Взаимодействие крахмала с йодом.
Окраска становится синей т.к. йод и крахмал дают синее окрашивание
Опыт №4 Гидролиз крахмала
(С H O ) + 4H O ---------- 4C H O
В зависимости от условий, гидролиз крахмала может протекать ступенчато, промежуточные продукты.
(С Н О ) ----- (С Н О ) ----- С Н О ----- С Н О
Лабораторная работа №12
Цель: Используя образцы химических волокон пластмасса, уметь давать характеристику предложенным образцам, научится распозновать и классифицировать природные и синтетические волокна.
Оборудование: Образцы пластмасса, синтетические и натуральные волокна, спиртовка, щипцы, фарфоровая чашка, реактивы.
Опыт №1 Свойства полиэтилена.
Полиэтилен деформируется
Опыт №2 Отношение полиэтилена к KHMO
KHMO обесцвечивается
Опыт №3



 енолфт.
енолфт.