
ХИМИЯ тесты
.docxПримеры тестов по отдельным темам курса. (На экзамене (зачете) будет тест, состоящий из 10 заданий из разных тем курса). Тема «Термодинамика» Вариант 1.
-
Эндотермическую реакцию однозначно характеризует неравенство: а) ∆Н > 0; б) ∆Н < 0; в) ∆G < 0; г) ∆G > 0.
-
Процесс, для которого ∆Н > 0 и ∆S > 0, возможен в закрытой системе а) при любых температурах; в) только при высоких температурах; б) только при низких температурах; г) невозможен.
-
Определите без расчета, при протекании какой реакции энтропия системы возрастает: а) СаО(тв) + СО2(г) = СаСО3(тв); в) 2СН4(г) = С2Н2(г) + 3Н2(г); б) N2 (г) + 3Н2(г) = 2NH3(г); г) NH3(г) + НСl(г) = NH4Cl(тв).
-
Тепловой эффект какой из приведенных реакций соответствует энтальпии образования ацетилена (С2Н2(г)): а) С2Н2(г) + Н2О(ж) = СН3СОН(ж); б) СН4(г) = С2Н2(г) + 3Н2(г); в) 2С(тв) + Н2(г) = С2Н2(г); г) СаС2(тв) + 2Н2О(ж) = С2Н2(г) + Са(ОН)2
-
Выберите правильное утверждение: а) стандартная энтальпия реакции нейтрализации положительна; б) экзотермические реакции всегда могут протекать самопроизвольно; в) молярная энтропия твердого вещества меньше, чем энтропия его в газообразном состоянии г) внутренняя энергия системы при совершении работы остается постоянной
Вариант 2.
-
Самопроизвольно протекающую реакцию однозначно характеризует неравенство: а) ∆Н > 0; б) ∆Н < 0; в) ∆G < 0; г) ∆G > 0
-
Процесс, для которого ∆Н < 0 и ∆S < 0, возможен в закрытой системе а) при любых температурах; в) только при высоких температурах; б) только при низких температурах; г) невозможен
-
Определите без расчета, при протекании какой реакции энтропия системы возрастает: а) СаО(тв) + СО2(г) = СаСО3(тв); в) 2СН4(г) = С2Н2(г) + 3Н2(г); б) N2 (г) + 3Н2(г) = 2NH3(г); г) NH3(г) + НСl(г) = NH4Cl(тв).
-
Тепловой эффект какой из приведенных реакций соответствует энтальпии образования оксида азота (II) (NO(г)): а) 3Zn(тв) + 8HNO3(ж) = 3Zn(NO3)2(ж) + 2NO(г) + 4H2O(ж) б) 1/2N2(г) + 1/2О2(г) = NO(г) в) 4NH3(г) + 5O2 (г) = 4NO(г) + 6H2O(г) г) NO(г) + 1/2O2(г) = NO2(г)
-
Связь между изменением внутренней энергии, теплотой и работой устанавливает: а) I закон термодинамики в) III закон термодинамики б) II закон термодинамики г) закон Гесса
Тема «Кинетика».
Вариант 1.
-
Выберите гомогенную реакцию: а) NaOH(р-р) + CO2(г) = NaHCO3(р-р); б) MgO(тв) + CO2(г) = MgCO3(тв); в) Zn(тв) + HCl(р-р) = ZnCl2(р-р) + H2(г); г) FeCl2(р-р) + Na2S(р-р) = FeS(тв) + 2NaCl(р-р).
-
Как изменится скорость реакции 2A + B → C, протекающей в растворе, кинетическое уравнение которой, v=kCACB, при
а) увеличении концентрации А в 2 раза б) уменьшении концентрации В в 2 раза
1) уменьшится в 2 раза 2) увеличится в 2 раза 3) увеличится в 4 раза 4 ) не изменится
-
Температурный коэффициент реакции =2. Как изменится скорость реакции при повышении температуры на 20 С: а) уменьшится в 2 раза; б) увеличится в 2 раза; в) увеличится в 4 раза; г) не изменится.
-
Выражение закона действующих масс для реакции СаО(тв) + СО2(г) = СаСО3(тв): а) v=k[СаО][СО2] в) v=k[СаСО3]; б) v=k[СО2]
-
Выберите правильное суждение: а) константа скорости реакции не зависит от температуры; б) константа скорости реакции зависит от концентрации реагентов; в) единица измерения скорости реакции моль/л∙с.
Вариант 2.
-
Выберите гетерогенную реакцию: а) N2 (г) + 3Н2(г) = 2NH3(г); б) MgO(тв) + CO2(г) = MgCO3(тв); в) СН4(г) = С2Н2(г) + 3Н2(г); г) FeCl2(р-р) + Na2S(р-р) = FeS(тв) + 2NaCl(р-р).
-
Как изменится скорость простой реакции 2A(г) + B(г) → C(г) при
а) при увеличении концентрации А в 2 раза б) уменьшении концентрации В в 2 раза в) при увеличении давления в 2 раза
а) уменьшится в 2 раза б) увеличится в 4 раза в) увеличится в 8 раз г) не изменится
-
Температурный коэффициент реакции =3. Как изменится скорость реакции при повышении температуры на 20 С: а) уменьшится в 6 раз; б) увеличится в 6 раза; в) увеличится в 9 раз; г) не изменится.
-
Выражение закона действующих масс для реакции 2N2O(г) = 2N2(г) + О2(г): а) v=k[N2]2[О2] в) v=k[N2О]2 б) v=k[N2О]
-
Выберите правильное суждение: а) константа скорости реакции не зависит наличия катализатора; б) константа скорости реакции зависит от концентрации реагентов; в) численные значения порядка и молекулярности простой реакции совпадают.
Тема «Химическое равновесие. Растворы неэлектролитов»
Вариант 1.
-
Какое воздействие на систему 2Н2О(г) + 2Сl2(г) 4НСl (г) + О2 (г), (∆Н > 0) приведет к смещению равновесия вправо: а) увеличение концентрации Сl2; в) понижение температуры; б) увеличение концентрации НСl; г) введение катализатора.
-
Уравнение константы равновесия гетерогенной реакции FeCO3(тв) FeO(тв) + CO2(г) имеет вид:
а)
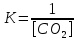
б)

в)

г)

-
Установите соответствие: а) Закон Рауля; 1) = СRT; б) Закон Вант-Гоффа; 2) P = P10X1 в) следствие из закона Рауля 3) ∆Тзам = КСm.
-
Расположите заданные вещества в порядке увеличения осмотического давления, если их концентрации одинаковы и равны 10 г/л: а) глицерин С3Н8О3 в) фруктоза С6Н12О6; б) сахароза С12Н22О11 г) этиленгликоль С2Н6О2
-
Как называются растворы с одинаковым осмотическим давлением: а) гипертонические; в) изотонические б) гипотонические; г) эквимолекулярные.
Вариант 2.
-
Выберите реакцию, в которой увеличение давление приведет к смещению равновесия вправо: а) N2 (г) + 3Н2(г) = 2NH3(г); б) MgCO3(тв) = MgO(тв) + CO2(г); в) СН4(г) = С2Н2(г) + 3Н2(г).
-
По отношению к раствору А с осмотическим давлением 100 кПа выберите:
а) гипертонический раствор б) изотонический раствор в) гипотонический раствор
1) раствор В ( = 75 кПа) 2) раствор С ( = 120 кПа) 3) раствор D ( = 100 кПа)
-
Укажите правильное выражение константы равновесия реакции 2Cr(тв) + 3Сl2(г) → 2CrCl3(тв):
а)
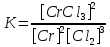
б)

в)

г)

-
Наибольшее осмотическое давление из перечисленных имеет раствор: а) 0,15 М С6Н12О6; в) 0,1 М КСl б) 0,05 М NaCl г) 0,05 М CaCl2
-
Температура кипения раствора неэлектролита изменилась на 0,6 С по сравнению с температурой кипения чистого растворителя. Каково значение температуры кипения раствора: а) 373 К б) 99,4 С в) 100,6 С
Тема «ОВР»
Вариант 1.
-
Выберите окислительно-восстановительную реакцию: а) NaOH + CO2 = NaHCO3; в) Zn + HCl = ZnCl2 + H2; б) MgO + CO2 = MgCO3; г) FeCl2 + Na2S = FeS + 2NaCl.
-
Процессу восстановления атомов серы соответствует схема: а) SO2 → SO3 в) Н2SO4 → H2S б) Na2S → CuS г) H2SO3→ SO2
-
К типичным восстановителям относят: а) оксид марганца (IV), оксид углерода (IV), оксид кремния (IV). б) вода, концентрированная серная кислота, азотная кислота в) перманганат калия, манганат калия, хромат калия г) сероводород, щелочные металлы.
-
В растворе нитрит натрия а) проявляет только окислительные свойства; б) проявляет только восстановительные свойства; в) проявляет как окислительные, так и восстановительные свойства; г) не проявляет ни окислительных, ни восстановительных свойств.
-
В уравнении реакции KMnO4 + H2S + H2SO4 = S + MnSO4 + K2SO4 + H2O сумма коэффициентов равна: а) 16 в) 10 б) 26 г) 20
Вариант 2.
-
Выберите окислительно-восстановительную реакцию: а) N2 + 3Н2 = 2NH3; б) MgO + CO2 = MgCO3; в) SO3 + H2O = Н2SO4; г) FeCl2 + Na2S = FeS + 2NaCl.
-
Процессу окисления атомов азота соответствует схема а) NO2 → NO в) N2 → NH3 б) HNO2 → HNO3 г) HNO3 → NO
-
Азотная кислота а) проявляет только окислительные свойства; б) проявляет только восстановительные свойства; в) проявляет как окислительные, так и восстановительные свойства; г) не проявляет ни окислительных, ни восстановительных свойств.
-
К типичным окислителям относят: а) углерод, металлы, водород б) сероводород, иодиды металлов, аммиак в) перманганат калия, дихромат калия, азотная кислота г) оксид марганца (II), оксид углерода (II), оксид кремния (IV)
-
В уравнении реакции K2Cr2O7 + KI + H2SO4 → I2 + Cr2(SO4)3 + K2SO4 + H2O сумма коэффициентов в правой части равна: а) 29 в) 15 б) 14 г) 18
