
Документ_Microsoft_Word (1)
.pdf
Тонкошарова хроматографія заснована на використанні в якості нерухомої фази тонкого шару адсорбенту, нанесеного на хроматографічну пластинку із інертного матеріала.
За механізмом процесу розподілу виділяють адсорбційну, іонообмінну, розподільну.
Суть адсорбційної хроматографії полягає в розподілі суміші речовин, основаному на їх різній здатності до адсорбції на тому чи іншому адсорбенті (нерухомій фазі).
Іоинообмінна хроматографія заснована на різній здатності іонів, які входять до складу аналізуємо/ суміші, обмінюватися з іонами, які входять до складу іонообминника (нерухома фаза).
В основу розподільної хроматографії покладена властивість розподілятися між рухомою і нерухомою фазою відповідно з коефіцієнтом розподілу ( закон розподілу Нернста).
Застосування хроматографії в медицині.
Хроматографічні методи широко застосовуються в медико-біологічних дослідженнях і в клінічній практиці. За допомогою цих методів можна визначити в біологічних рідинах різні мікро компоненти, які зяблюються в результаті тої чи іншої патології. Можна визначати якими саме мікроорганізмами викликане захворювання.
Застосування хроматографії дає можливість практично миттєво визначити вміст в крові алкоголю, наркотиків, летких речовин, які викликають токсикоманію. Цей метод використовують також і для допінг-контролю.
Лекція 8 Фізико-
хімія дисперсних систем
Дисперсна система - це утворена з двох або більше фаз (тіл), які абсолютно або практично не змішуються і не реагують один з одним хімічно. Перше з речовин (дисперсна фаза) дрібно розподілено у другому (дисперсійна се,реда). Якщо фаз декілька, їх можна відокремити один від одного фізичним способом (центрифугувати, сепарувати і т. д.).
Зазвичай дисперсні системи - це колоїдні розчини, золі. До дисперсним систем відносять також випадок твердої дисперсної середовища, в якому знаходиться дисперсна фаза.
Найбільш загальна класифікація дисперсних систем заснована на різниці
вказує на дисперсну фазу, а знаменник на дисперсійне середовище, наприклад
для системи "газ в рідині" прийнято позначення Г / Ж.
Позна Дисперсна фаза |
Дисперсійна |
Назва та приклад |
,; |
чення |
середу |
" ч |
|
Г / Г |
Газоподібна |
Газоподібна |
Р / Г |
Рідка |
Газоподібна |
т/г |
Тверда |
Газоподібна |
|
|
|
Г/Р |
Газоподібна |
Рідка |
р/р |
Рідка |
Рідка |
Т/Р |
Тверда |
Рідка |
г/т |
Газоподібна |
Тверда |
|
|
|
Р/Т |
Рідка |
Тверда |
т/т Тверда |
Тверда |
|
Дисперсна система не утворюється
Аерозолі: тумани, хмари
Аерозолі (пилу, дими), порошки
Газові емульсії і піни
Емульсії: нафта, крем, молоко
Суспензії і золі: пульпа, мул, суспензія, паста
Пористі тіла
Капілярні системи: рідина в пористих тілах, грунт, грунт
Тверді гетерогенні системи: сплави, бетон, композиційні матеріали
в агрегатному стані дисперсійного середовища і дисперсної фази. Сполучення трьох видів агрегатного стану дозволяють виділити дев'ять видів дисперсних систем. Для стислості запису їх прийнято позначати дробом, чисельник якого

Мікрогетерогенні Грубодисперсні 10"7... 10"5
|
більше 10"' |
|
Ультрамікрогетерогені системи |
також |
називають |
колоїдними або золямі. В залежності від природи дисперсійного середовища, золи поділяють на тверді золи, аерозолі (золи з газоподібної дисперсійним середовищем) і ліозолі (золи з рідким дисперсійним середовищем). До мікрогетерогенних систем відносять суспензії, емульсії, піни і порошки. Найбільш поширеними грубодисперсними системами є системи "тверде - газ", наприклад, пісок.
Звязанодисперсні системи (пористі тіла) за класифікацією М. М.
Дубініна поділяють на: |
■ ■ . ■ , , . ■ ■ ■ ■ • ■ ■ - |
і |
„ »? |
Назва |
Розмір часток, нм |
|
, |
Мікропористі |
менше 2 |
. . |
V t ; | |
Мезопористі |
2-200 |
|
|
Макропористі |
більше 200 |
|
|
За рекомендацією ІЮПАК мікропористими називають пор исті матеріали з розмірами пор до 2 нм, мезопористих - від 2 до 50 нм, макропористістю -понад 50 нм.
Методи одержання колоїдних розчинів Характерною ознакою колоїдних розчинів від ідеальних, являється їх
гетерогенність. Дійсно, розміри колоїдних частин, по рівняно з розмірами молекул розчинника, настільки великі, що між ними утворюється поверхня розділу.
.,._, |
Для одержання таких систем потрібно дотримання наступних умов. |
4ні#> |
а) довести розміри діспергіруємої речовини до розмірів колоїдних частин; |
|
б) створити відповідні умови, які могли б забезпечити збереження |
|
колоїдних частин в рівноважному стані в депресійному середовищі. |
|
Останній звичайно створюється іонами електролітів (стабілізаторами) які |
|
на поверхні розділу фаз утворюють іонний шар і гідратну оболонку; |
|
в) а також дисперсна фаза повинна мати погану розчинність по крайній |
|
мірі при одержанні гідрофобного попелу. |
|
Таким чином, частки набувають електричний заряд і гідратну оболонку, |
|
що перешкоджає випаданню їх в осад. Враховуючи, колоїдні розчини займают ь |
|
по розмірах, своїх частин проміжне положення між грубодисперсними і |
|
молекулярно-дисперсними системами, в основу одержання колоїдних розчинів |
|
можуть бути покладені два принципи: |
|
роздрібнення диспергованих більш великих частин до бажаного ступеня |
|
дисперсності, наближених до розмірів колоїдних систем; укрупнення |
|
62 |
колоїдних частинок. Перший метод одержав назву диспресійного, а другий - кондисаційного метода.
Дисперсійні методи. При роздрібнені великих частин необхідно затратити деяку кількість енергії. Основним принципом одержання колоїдів дисперсійними методами являється дрібненя твердих речовин з допомогою спеціальних млинів, електричних, ультразвукових і других.
Механічні методи. -....
З метою дрібнення речовин в лабораторіях і виробництва використовуються машини, працюючих по методу ударного роздрібнення і розтирання належних матеріалів; до таких машин відносяться шарові і колоїдні машини.
Шаровий млин представляє собою циліндр в якому розміщенні виготовлені із сталі або другого міцного мат еріалу кульки. В циліндр поміщають речовину, яка потім роздрібнюється ударами і розтиранням кульками в результаті швидкого обертанні циліндра. Ступінь такій обробці залишається порівняно низький. Більш високу дисперсність одержують при дробленні речовин в колоїдному млині. З допомогою таких млинів можуть бути одержані тонкодисперсні фармацевтичні препарати, какао, краски та ін.
Ультразвуковий метод.
Для подрібнення речовин в останній и час все частіше використовують ультразвуковий метод. Механізм дії ультразвуков складний і поки що
мало вивчений. Передбачають що подрібнення зважуваних частин проходить під дією звукової хвилі в рідині в силу створення місцевих швидко змінювальних стискань і розширень системи, що супроводжується появленням розриваючих сил, вед учих до подрібнення речовин. З допомогою ультразвукового методу можна роздрібнювати різні речовини: графік сірку, краски, ртуть, свинець, цинк, крохмаль і др.
Метод пептизацй
Пептизація являється скороченою назвою від слова «пептінізація» запропонований Гремом для позначення процесів переходу речовини із стану гель в золь під впливом пептизаторів диспергіруючих засобів. Термін пептизації виник по аналогії з процесом розчеплення білка ферментом пепсином на пептони. Пептизації в основному підлягають рихло з'є днаних і добре гідратовані осади гідрооксидів металів наприклад AL(OH)3, Fe(OH)3 і другі, тоді як щільні осади міді, срібла та інших металів не пептизируються.
Метод розчинення. Цей метод може бути використаний для одержання розчинів високомолекулярних речовин із твердих полімерів, шляхом диспергування їх в відповідних розчинах, як наприклад при розчиненні в воді крохмалю, гумміарабіка, желатина, сухого білку та ін.
Конденсаційні методи.
Конденсаційні методи поділяються на фізичні та хімічні. Методи фізичної конденсації грунтуються тільки на фізичних явищах, без перебігу хімічних реакцій.

Коагулюючу дію має лише той іон електроліту, заряд якого протилежний заряду колоїдної частинки. Коагулююча здатність іона тим більша, чим більший його заряд (правило Шульце — Гарді, або правило значності). Дані теоретичних розрахунків свідчать, що співвідношення коагулюючої здатності одно-, дво- і тризарядних катіонів становить 1:20:350, тобто, прямо пропорційна залежність між зарядом іона та його коагулюючою здатністю відсутня. Для іонів з однаковим зарядом коагулююча дія визначається їх місцем у ліотропному ряду, де вони розташовуються за зменшенням ступеня гідратації, зі зменшенням якого коагулююча дія збільшується. В органічних іонах коагулююча дія зростає з підвищенням адсорбційної здатності. Усі ці закономірності порушуються, якщо додані електроліти хімічно взаємодіють з колоїдними частинками, утворюючи з іонами колоїдного розчину нерозчинні сполуки.
При коагуляції сумішами електролітів їх вплив може складатися (адитивність), посилюватися (синергізм) та послаблюватися (антагонізм). При змішуванні золів з протилежно зарядженими частинками відбувається взаємна коагуляція. Визначення порога коагуляції утруднюється явищем звикання золів, тобто якщо до золю додавати електроліт невеликими порціями, то коагуляція настає при вищій концентрації електроліту, ніж при одноразовому його додаванні. Спостерігається і протилежне явище, коли поріг коагуляції при поступовому додаванні електроліту нижчий, ніж при швидкому його додаванні (від'ємне звикання). Коагуляція зумовлена діалізом або електродіалізом, пов'язана з видаленням іонів, які надавали стабільність колоїдним частинкам. Коагуляція яка спостерігається при електрофорезі, зумовлена зміною іонного складу системи.
( При додаванні до ліофобних золів високомолекулярних або поверхневоактивних сполук їх стійкість значно підвищуєгься. Це явище називається колоїдним захистом. Механізм захисної дії полягає в утворенні адсорбційного шару з високомолекулярних речовин, який забезпечує сольватацію частинки. Сольватні шари створюють значний розклинювальний тиск і перешкоджають :, злипанню часток. Захисна дія підсилюється при утворенні в дисперсійному середовищі досить міцної об'ємної структури і кількісно характеризується захисним числом, яке дорівнює числу міліграмів високомолекулярної речовини, що захищає 10 мл золю від коагуляції при додаванні до нього 1 мл 10% розчину NaCl. Залежно від того, який золь приймають за стандарт, розрізняють «золоте», «срібне», «рубінове», «залізне» та ін. захисне число. Якщо кількість доданої до золю високомолекулярної речовини дуже мала, то можливе не підвищення, а зниження стійкості (сенсибілізація).
Колоїдний захист має велике значення в біології та фармації. Білки крові захищають гідрофобні речовини, які в ній містяться, від коагуляції. При послабленні захисної дії білків спостерігається виникнення патологічних станів в організмі, напр., відкладання холестерину на стінках судин, утворення каменів у нирках, печінці та ін. Колоїдний захист використовують при виготовленні ЛП, напр., протарголу і коларголу, які є колоїдними препаратами срібла, захищеними білками.
Методи очищення.
Діаліз. Для очистки розчинів широко використовуються метод діаліза. Вилучення колоїдних розчинів від домішок, здатних проникати через рослинні і тваринні, штучні мембрани, називається діалізом, а пристрої пристосовані для цього, одержали назву діалізаторів. Перші моделі діалізаторів представляли собою посудину, заповнену проточною водою, в якій поміщалась на глибину декількох сантиметрів внутрішня частина приладу, нагадуючи широкий зрізаний отвір, на більше вузьку частину якої натягаємо мембрану із пергаменту, коллоїда, целофану. У внутрішню частину наливається колоїдний розчин, який треба очистити. З допомогою діалізу поступово проходить видалення речовин, легко проходять через мембрану, наприклад електролітів та інших розчинів кристалогідратів. Очистка неколоїдних розчинів таким способом протікає не швидко, і тому для прискорення діаліза використовуємо електричний струм.
Електродіаліз. Прискорений процес діаліза при використанні постійного електричного струму дістав назву електродіаліза. Прилад для електродіаліза представляє собою посуд, розділений двома мембранами на три частини. В середню частину наливається неочищений колоїдний розчин. А в бокові, в яких знаходяться електроди, наливається розчинник - проточна вода. При включенні струму утворюється направлений рух аніонів і катіонів до відповідних електродів, колоїдний розчин при цьому поступово очищається від електролітів, а також при діалізі можуть віддалятися низькомолекулярні неелектроліти.
Компенсаційний діаліз і вивидіаліз. Для дослідження біологічних рідин Михаелісом і Рона був рекомендований метод, який дозволяв визначити концентрацію тих або інших низькомолекулярних речовин що знаходяться в цільному стані в колоїдних розчинах. Суть компенсаційного діаліза перебуває в заміні звичайного розчинника спеціально приготовленим розчином, маючи знайомі концентрації речовин, близькі до концентрації біологічної рідини. Після довгого діалізу, коли між даними концентраціями установиться динамічна рівновага, аналізують склад і визначають кількість в внутрішньому середовищі речовин, знову в ній продіалізованих. Таким чином було виявлено наявність глюкози і сечовина в крові в вільному стані.
Приблизно на тому ж принципі базується прижиттєве визначення низькомолекулярних складових частин крові методом вівідіаліза (вівідіффузія по Обелю). В кінці перерізаної кровоносної судини вставляються скляні канюлі, розгалуження частин, які з'єднуються між собою трубочками з колоїда, і вся система занурюється в посудину, заповненою фізіологічним розчином NaCl або водою. Було встановлено, що амінокислоти в крові, так же як і глюкоза, можуть знаходитися в вільному стані. На принципі компенсаційної нівідіфузії був сконструйований апарат, одержавши назву «штучної нирки» з допомогою якого можна звільняти кров від продуктів обміну речовин (шлаків) і послідовно частково заміняти функцію природної, але хворої нирки. Доказом по використанню «штучної нирки» являється гостра ниркова недостатність,
' ' ■ . ' |
6 6 |
67 |
наприклад, при отруєні сулемою, сульфаніламідними препаратами, при уремії після переливання крові, при тяжких опіках, токсикозі вагітності і т.д.
Ультрафііьтрація. Одним із важливих методів очистки колоїдних розчинів являється ультрафільтрація, яка зводиться до відділення дисперсної фази від дисперсійного середовища. Для цього проводиться фільтрування колоїдного розчину через мембрани, які не пропускають колоїдні частинки або макромолекули. При фільтрації дисперсна фаза залишається на фільтрі.
Через пори звичайного фільтрувального паперу колоїдні частки легко проходять, а тому при ультрафільтрації користуються спеціальними фільтрами. Наприклад фільтрувальним папером просоченою колодіумом, целофаном. Ультрафільтрація, як правило протікає дуже повільно, а тому її частіше проводять під тиском, для чого і підкладеної під фільтром посудини відкачують повітря, або в посудину розволоженої над фільтром накачують повітря.
Аерозолі.
З колоїдно-хімічної точки зору аерозолі являють собою дисперсні системи з газоподібним дисперсним середовищем і з твердою або рідкою дисперсною фазою. В повсякденному житті прикладами таких систем можуть служити дими (дисперсна фаза тверда) і тумани (дисперсна фаз рідка).
З древніх часів аерозолі використовувались в медицині в вигляді інгаляцій для профілактики і лікування захворювань дихальних шляхів. Спочатку вони мали вигляд парів і диму, що утворювались при спалюванні різних лікарських рослинних матеріалів. Потім стали застосовуватись інгаляції природних летучих речовин. В середині XIX століття для одержання аерозолів почали використовуватись диспергуючі агенти: стиснути повітря, водяну пару, пізніше центрифугування, ультразвук.
Аерозолі використовуються широко в медицині, фармації і ветеринарії, для технічних і побутових цілей, в парф умерії і косметиці, сільському господарстві і т.д.
Суспензії - рідка лікарська форма, що містить як дисперсну фазу одну чи декілька подрібнених порошкоподібних лікарських речовин, розподілених у рідкому дисперсійному середовищі. Суспензії (зависі) являють собою
■0 мікрогетерогенні дисперсні системи, що складаються із твердої дисперсної фази і рідкого дисперсійного середовища.
У залежності від величини часток суспензії розрізняють:
-грубі, які називають збовтаними мікстурами (Mixturae agitandae), мають розмір часток дисперсної фази (тобто лікарської речовини) більше 1 мкм, при стоянні швидко осідають, тому їх не проціджують (у разі потреби проціджують тільки розчинник);
-тонкі, які називають мутними чи опалесцентними мікстурами (Mixturae turbidae), розмір часток від ОД до 1 мкм, відрізняються від грубих суспензій тим, що в них осад утворюється повільніше.
Залежно від способу застосування суспензії розрізняють для внутрішнього, зовнішнього і парентерального застосування. Якщо у формі сз^спензій прописуються лікарські речовини для внутрішнього застосування, то
їх називають мікстурами-суспензіями. Як зовнішні засоби суспензії
: , ■ . |
' . |
■ |
6 8 |
прописуються для змазувань, спринцювань та ін. Рідше суспензії застосовуються для ін'єкцій, в основному внутрім'язових (для внутрішнього введення не використовуються). В аптечній практиці найбільш часто застосовують суспензії, у яких дисперсійним середовищем ^є вода, водні витяжки з лікарської рослинної сировини, гліцерин, жирні олії та ін.
Суспензії можуть бути готовими до застосування, а також у вигляді порошків чи гранул для суспензій, до яких перед застосуванням додають воду або іншу придатну рідину в кількості, зазначеній у власних статтях. ,
Суспензії - це грубо дисперсні си стеми з рідким дисперсним середовищем і твердою дисперсною фазою. Суспензії мають велике практичне значення. Глинисті, цементні та вапняні розчини, масляні фарби, лаки широко використовують у будівництві. Багато лікарських препаратів, наприклад, синтоміцин, стрептоцид, новоцилін, камфору, фенілсаліцилат, ментол, сірку, цинк оксид тощо, використовують у медичній практиці у вигляді суспензій та паст.
Піни - це висококонцентровані гетерогенні системи, в яких дисперсною фазою є бульбашки газу, а дисперсійним середовищем - рідина (рідка піна) або тверде тіло (тверда піна).
Лекція №9 Класифікація, номенклатура та ізомерія біоорганічних сполук. Природа
хімічного зв'язку. Види хімічнил. реакцій, "^акційна здатність алканів, алкенів, аренів, спиртів, фенолів, амінів.
1. Хімічний зв'язок в органічних сполуках Молекули органічних сполук побудовані за допомогою ковалентних
зв'язків, які виникають за рахунок утворення однієї або декількох електронних пар, загальних для взаємодіючих атомів. Такий зв'язок утворюють атоми, я кі характеризуються рівними або близькими значеннями електронегативностей.
Для атомів - органогенів і галогенів ці значення такі: |
|
|
|
|||||
атом |
С |
Н |
ON |
S |
Р |
СІ |
Вг |
|
електронегативність |
2,5 |
2,1 |
3,5 |
3,0 |
2,5 |
2,1 |
3,0 |
2,8 |
Ковалентний зв'язок характеризується енергетичними (енергія зв'язку), |
||||||||
геометричними (довжина, |
валетний |
кут) |
та електронними |
параметрами |
||||
(полярність, поляризовність та умовний заряд на атомі в молекулі). |
|
|||||||
Енергією зв 'язку називається енергія, яка поглинається при порушенні або виділяється при утворенні зв'язку між атомами. Ця енергія є мірою його міцності. Вона визначається з термодинамічних характеристик (теплота утворення з атомів ) або з спектральних даних.
Довжиною зв'язка називається відстань між двома центрами ядер атомів в молекулі, коли сили відштовхування зрівноважені силами притягання
69
й енергія зв'язку мінімальна. Наприклад, довжина зв'язку в молекулі метану дорівнює 0,154 нм, в молекулі води 0,096 нм.
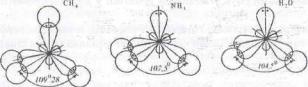
Валентним кутом називається кут між двома осями симетрії електронних орбіталей одного атома при утворенні ними з орбіталями іншого атома ковалентного зв'язку. Наприклад, у молекулах води, амоніаку та метану валентні кути дорівнюють 104°, 106°, 109°28':
Напрямленістю називається закономірний напрям взаємодії електронних орбіталей у просторі у бік найбільшого перекривання електронної густини при утворенні зв'язку. Напрямленість і валентний кут взаємно пов'язані величини і залежать від природи реагуючих атомів, типу електронних орбіталей, які утворюють зв'язок, розмірів атомів і величин зарядів на них. На рисунках напрямленість іноді показують стрілкою.
Рис Будова молекул
води, амоніаку та метану
Геометричні параметри залежать не тільки від природи атомів, які поєднуються, але й від природи і стану сусідніх атомів.
Полярністю зв'язку називається наявність електричних зарядів на атомах внаслідок асиметричного розподілу електронної густини між ними.
Поляризацією називається зміщення електронної густини ї ядер атомів в залежності від їх природи під впливом поля сусідніх атомів (цей фактор має велике значення у органічній хімії). Поляризація виникає також під впливом зовнішнього електромагнітного поля (поля сусідніх молекул). Отже полярність виникає внаслідок поляризації.
Полярність зв'язку залежить від довжини його та різниці електронегативностей атомів, які утворюють зв'язок. Чим більше ця різниця, тим більше полярність. Найбільшу електронегативність мають галогени та Оксиген, тому вони легко перетягують до себе електронну густину зв'язку. В результаті поляризації на атомах утворюється частковий позитивний або негативний заряд, який називається ефективним зарядом ( 5+, 5—).
а- та ж-зв'язки
Зв'язок між двома атомами, напрямлений вздовж прямої, що сполучає їх ядра та співпадає з віссю симетрії електронних хмар, називається сігмазв'язком (а— зв'язок).
л-Зв'язком називається такий тип зв'язку, при якому максимальне перекривання не проходить через вісь, яка поєднує центри ядер і яке
знаходиться над і під площиною а-зв'язків. я-Зв'язок симетричний відносно площини о-зв'язків. Зона перекривання його менше, ніж у а-зв'язка, тому він менш міцний, легше розривається і легко поляризується. я-Зв'язок виникає не тільки між атомами Карбону, але між будь-якими атомами, які мають р- електрони, наприклад, між атомами Карбону та атомами Оксигену, Нітрогену, Сульфуру, тощо.
М і ж мо л е ку л я р н і в за є мо ді ї • ■ ■ -
Міжмолекулярною взаємодією називається взаємодія між молекулами, що не супроводжується додатковим усуспільненням електронної густини, тобто утворенням нових зв'язків.
Водневий зв 'язок
Водневий зв'язок є специфічною міжмолекулярною взаємодією, тому що можливість його виникнення і міцність залежать від хімічної природи речовини.
Водневий зв'язок - це зв'язок між позитивно поляризованим атомом водню однієї молекули і атомом1. електронегативного елементу (Оксигену, Нітрогену, Хлору, Флуору, рідко - Сульфуру) другої молекули.
Виникнення водневого зв'язку обумовлено двома причинами: .,■,■•,,
1.Атом водню, зв'язаний полярним ковалентним зв'язком з другим атомом, фактично не має електронів і здатний легко впроваджуватися в електронні хмари інших атомів;
2.Атом водню має вакантну s-орбіталь і може приймати неподілену
електронну пару другого атома, |
утворюючи •■>, ним донорно-акцепторний |
зв'язок. |
|
У загальному вигляді процес утворення водневого зв'язку має такий |
|
вигляд: |
■ - ■ • • ■ « |
X - H + Y о Х - H . . . Y .
Тут X і Y — атоми електронегативних елементів.
Завдяки водневим зв'язкам молекули протеїнів зберігають свою спіральну форму, вони ж утримують разом подвійні спіралі ДНК, обумовлюють певну конфігурацію ланцюгів природних і штучних полімерів.
Водневий зв'язок часто впливає і на хімічні властивості речовин. Наприклад, у ряді флуороводнева кислота — хлорводнева кислота, перша з них - слабка, а друга - сильна, що пояснюється утворенням димерів та інших асоціатів, не здатних дисоціювати з розривом зв'язку Н.. .F.
Лізіс зв 'язку
Розрив ковалентних зв'язків може йти двома шляхами. При гомолітичному (радикальному) розриві загальна електронна пара роз'єднується і утворюються радикали. Радикалом називається нейтральна частина, яка має иеспарений електрон. Схема радикального розриву така:
Х:У -»Х. + .У
Радикальному розриву піддаються малополярні або неполярні зв'язки
70

(С - С, С - Н, N - N, S - S) при високій температурі, під дією сонячного світла або радіоактивного випромінювання.
Гетеролітичний розрив зв'язків призводить до утворення заряджених частинок - карбокатіонів і карбаніонів:
X: У -» ХГ + У+.
2.Взаємний вплив атомів в молекулах органічних сполук Індукційний ефект
Реакційна здатність молекул в великій мірі залежить від взаємного впливу атомів, поляризовності та полярності зв'язків.
Особливе значення мають два види взаємного впливу атомів: індукційний ефект і мезомерний ефект (ефект спряження). Ці ефекти визначають розподіл електронної густини в молекулі речовини, яка не зазнає впливу зовнішнього поля.
Індукційним ефектом (/-ефект) називають ефект, пов'язаний зі зміщенням електронної густини вздовж ст-зв'язків, який зумовлюється різницею електронегативностей атомів, що входять до складу молекули. Цей ефект може бути негативним і позитивним. Вважається, що знак ефекту дорівнює знаку на заміснику, який спричинює зміщення електронної густини. Якщо таке зміщення відбувається від ланцюга у бік замісника, то ефект буде негативним (-/-ефект). У випадку зміщення електронної хмари від замісника до ланцюга ефект буде позитивним (+/-ефект). В залежності від міцності та
напрямку індукційного ефекту замісники розташовуються у певний ряд:
(-/) (CH3)3N+- > -NO2 > -С = N > -С=О > - F > - Cl> -Br > -І > -COOH
>-COOR > -OR > HS- > -OH > -NH2 > -H < -CH3 < -C2H5 < -€(CH3)3
Гідроген вважається умовним нулем шкали, тобто замісником, з яким порівнюєься вплив всіх інших замісників.
Особливістью індукційного ефекту є те, що він швидко загасає по мірі
віддалення від групи атомов, |
яка його зумовлює. Приклади індукційного |
|||||
%чефекта: |
|
|
|
|
|
|
|
5+2 |
5+1 |
5- 5+1 |
6+2 |
|
|
|
|
|
|
|
СНз^-СН2->СН2->С1 |
|
|
5+3 |
5+2 |
5+1 |
5- |
5+1 > 5+2 > 5+3 |
|
|
|
|
|
|
; ; |
|
|
СНз ->СН2 --» О <-СН2 <-СН3 |
|
|
|||
|
|
5+1 |
> 5+2 |
|
|
|
|
|
|
|
|
|
5+ |
.' 5+2 |
5+, |
5- |
|
5-2 |
5-і |
|
; |
СН3 |
->СН2->О «-Н |
|
CH3->CH2-»NH2 |
||
|
|
|||||
* Як видно з наведених прикладів, цей ефект позначається стрілками на місцях зв'язків. Мезомерний ефект
У спряжених структурах спостерігається ефект іншого типу, так званий мезомерний ефект (або ефект спряження). Він виникає при наявності замісника з атомом іншої природи, який має неподілену р-електронну пару, або кратний ЗВІ'ЯЗОК між атомами Карбону. Цей ефект пов'язаний з перерозподілом
електронної густини таким чином, що атоми з негативним зарядом чергуються з атомами з позитивним зарядом. При цьому відбувається деформація зв'язків, зниження загальної енергії системи та зміна її реакційної здатності. Знак мезомерного ефекту співпадає зі знаком заряду на заміснику, який спричинив цей ефект. Мезомерний ефект вважаегься негативним (-Af-ефект), якщо замісник відтягує на себе електронну густину спряженої системи і позитивним (+А/-ефект), якщо замісник віддає свою електронну пару у спряжену систему. Мезомерний ефект передається тільки по я-зв'язкам і не загасає при розподіленні вздовж ланцюга. Він не залежіть від електронегативності атомів, що утворюють спряжений зв'язок.
(+А/)-ефект виникає, коли замісник, який з'єднується з карбоновим радикалом має неподілену пару р-електронів, яка відтягується від замісника у бік карбонового ланцюга. До таких замісників відносяться галогени, гідроксильна група, аміногрупа, етерна групіровка, наприклад:
СН2 = СН-СН = СН-СІ |
|
|
ОН |
|
|
|
|
фенол |
|
1-хлор -1,3-бутадієн |
|
|
|
|
|
|
|||
|
NH,- |
|
||
СН2 = СН-СН = СН-О-СН3 |
|
|
|
|
1-метоксі -1,3 -бутадієн |
|
аУ, |
||
(-М)-ефект виникає у разі наявності замісника з кратними зв'язками, утворених атомами, один з яких характеризуемся більшою електронегативністю і відтягує на себе спільні електронні пари кратного зв'язку. При цьому атом, який пов'язаний з спряженою системою набуває позитивного часткового заряду. До замісників з негативним мезомерним ефектом відносяться карбоксильна-, карбонільна-, сульфо-, нітро-, нітрильна групи, естерна групіровка та ін. Наприклад:
СН2 = СН - СН = СН - С = О
|
\он |
1,3-бутадієнкарбонова кислота |
|
СН2 = СН-СН = О |
CH2 = CH-NO2 |
етенілаль |
нітроетеніл |
-С = О
© - СН3 бензенметиловий естер О
О- S £■ S - ОН ' ч>
сульфобензен Як і у випадку індукційного ефекту, замісники утворюють певний ряд у
залежності від міцності та напрямку мезомерного ефекту:
(-М) - СОСІ > -NO2 > -С = N > -СНО > -COOCjHs > -COOH > Н < -І < - Br < -С l< -F < -OR < -OH < -NH2 < -O~ (+M)

І!' |
ефектів: |
|
|
|
|
|
невеликою перевагою М-ефекту. Приклади впливу мезомерних та індукційних |
||||
|
......;,. ,\, |
,.,,, |
: |
. |
он |
|
іфторбензен |
... |
фенол |
етенілкарбонова |
|
|
кислота |
, |
|
|
|
|
Мезомерний ефект позначаєтьсягнутою стрілкою. |
|
|||
3.Електрофільні та нуклеофільні реагенти
СНуклеофільними називаються речовини, які мають надлишок електронної густини (основи за Л'юісом). До них відносяться від'ємні аніони (F~, СГ Вг~, Г,
ОН', CIST), сполуки з вільними електронними парами (NH3, Н2О, ROH) або з надлишком електронної густини (алкени, алкіни, арени і інші органічні сполуки з кратними зв'язками).
Електрофільтши називаються речовини, які мають дефіцит електронної
густини ( кислоти за Л'юісом). До них відносяться, наприклад, Н +, BF3, АІСІ3, ~МО2+, RHC = О, R,R2C = О, BΓ, СІ та ін. Дефіцит електронів в молекулах типа АІСЬ пов'язаний з тим, що вони мають незаповнену електрону орбіталь в одному з атомів і здатні до приймання додаткових електронів для утворення конфігурації з восьми електронів.
Електрофільні та нуклеофільні процеси завжди пов'язані й по суті є процесами окиснення-відновлення.
4.Класифікація органічних реакцій
Реакції у органічній хімії класифікують з трьох позицій - за напрямком, за характером реагуючих частин і класифікація по елементарній стадії, яка визначає швидкість процесу.
_^ За напрямком реакції розрізняють реакції приєднання (позначається ( літерою А від англ. Addition), реакції відщеплення (Е, Elimintiori), і реакції у заміщення (5, Substitution). Наприклад
СН2 =СН2 + СІ2 -> СН2СІ - СН2СІ, реакція приєднання; СНзСН2ОН->СН2 = СН2+Н2О, реакція відщеплення; С2Н6+ СІ2 -» С2Н5СІ + НСІ, реакція заміщення.
Реакції окиснення-відновлення в залежності від характеру процесу можуть відноситься до будь-якої з цих груп, а молекулярні перегрупування (реакції обміну) відносять до реакцій заміщення.
Звичайно класифікація за цим ознакою не викликає труднощів. За реагуючими частинами розрізняють молекулярні, гемолітичні і гетеролітичні реакції
Молекулярні реакції ^ -------Гетеролітичні, або іонні реакції в залежності від діючого реагенту
Чможуть бути нуклеофільними (N) або електрофільними (E). \^ Реагентом називаегься один з компонентів реакції, який при взаємо дії з рядом сполук, що мають подібні властивості, утворює подібні продукти реакції. Як правило, реагент є більш простою сполукою яка додається у надлишку. Другий компонент реакції називаегься субстратом. Наприклад, у
■ |
. |
|
7 4 |
реакціях приєднання галогеноводнів |
до етиленових вуглеводнів |
завжди |
||||||
утворюються галогенопохідні вуглеводнів: |
|
|
|
СН3; |
||||
|
|
|
|
|
|
|
|
СН3 |
СН2 |
= |
СН2 |
+ |
НСІ |
-> |
|
СН2СІ |
пропілен - |
СН2=СН-СН3 |
+ |
НСІ |
|
-> |
СН2 |
= |
СНСІ |
|
Отже, в цих |
реакціях галогеноводень НСІ - реагент, етилен |
|
||||||
субстрати. |
|
|
|
|
|
|
|
|
У випадку нуклеофільних реакцій реагент надає свою електронну пару |
||||||||
для утворення нового зв'язку |
|
|
|
|
|
|
||
|
А:В |
+ |
:С~ |
-» |
|
А: + В : С |
|
|
|
субстрат |
нуклеофільний реагент |
|
|||||
У випадку електрофільних реакцій для утворення нового зв'язку |
||||||||
використовується електронна пара, яка належить субстрату: |
|
|||||||
|
|
А: В |
+ |
С+ |
-► А+ |
|
+ С:В |
|
|
Субстрат |
|
електрофільний |
реагент |
|
|||
Назви реакцій реакцій утворюються виходячи з типу реагента, наприклад:
A^- СН3 + НО - NO 2 - > NO 2 - /^\ - СНз + Н2 О
ця реакці<ТТ)сифікується як реакція елиГ Тильного заміщенн я гомолога (їензена, ToVy-що частина ~NO2+ - електрофиггатЛи реагент.
Гетеролітичні реакції проходять з утворенням карбокатіонів, карб - шііонів або нестійких проміжних сполук. Ознаки гетеролітичних реакцій:
1.прискорюються ( каталізуються) кислотами та основами;
2.не підлягають дії світла і вільних радикалів;
3.найчастіше проходять у середовищі полярних розчинників і дуже рідко - в газовій фазі.
Гемолітичні (радикальні) реакції проходять з утворенням радикалів. Нони позначаються літерою R. Найчастіше радикали - це нестійкі частини і можуть існувати недовгочасно. Радикальні реакції багатостадійні. Перша стадія реакція ініціювання при якій утворюються первинні, найчастіше - неорганічні радикали. Ініціація проходить у досить специфічних умовах. Наприклад, при дії світла (hv) утворюються галоїдні радикали. Друга стадія - реакції росту ланцюга, в яких утворюються органічні радикали. Далі йде стадія обриву радикалів, в результаті якої вони знищуються. Радикальні реакції можуть бути ланцюговими, якщо для реакцій росту ланцюга не потрібна подальша ініціація (наприклад, реакція хлорування насичених вуглеводнів). Ознаки радикальних реакцій:
1.проходять в газовій фазі або неполярних розчинниках;
2.каталізуються світлом або високою температурою, а також речовинами, які легко утворюють вільні радикали;
3.гальмуються речовинами, які реагують з вільними радикалами;
4.часто є ланцюговими реакціями.
За швидкістю елементарної стадії реакції розділяють на мономолекулярні (у елементарному акті бере участь одна молекула) і
If

бімолекулярні (у елементарній стадії беруть участь дві молекули). Реакції більш високої молекулярності зустрічаються рідко й тут не розглядаються.
Мономолекулярні реакції проходять в дві стадії (асинхронний процес). Більш повільною стадією, яка визначає швидкість реакції у цілому є стадія іонізації одного з компонентів реакції. Стійкість утворених заряджених частин залежить від їх структури, від ступені делокалізації заряду по всьому об'єму частини. Друга стадія (більш швидка) — це взаємодія зарядженої частини (карбіона) з другим компонентом реакції в результаті якої утворюється кінцевий продукт. В таких випадках швидкість реакції визначається концентрацією тільки одного з компонентів, тобто кінетичне рівняння має перший порядок.
Наприклад: реакція гідролізу третичного галоїдного алкілу - бромістого бутилу. Перша стадія — оборотна реакція дисоціації на іони: ,•■>,■>
(СНз)зС-Вг <-> (СН3)з - С++ BΓ";
Дисоціація йде повільно з утворенням карбокатіону, який далі швидко реагує з молекулами води (полярного розчинника), які здібні віддавати вільну
пару електронів для реакції з атомом Карбону:
Друга стадія: (СН3)3С+ + Н-ОН -> (СН3)3С - ОН + ¥Ґ.
Цей процес не може реалізуватися по бімолекулярному механізму, оскільки великі розміри радикалу (СН3)зС - перешкоджають підходу Н-ОН до зв'язку С-Вг.
Бімолекулярні реакції йдуть в одну стадію (синхронний процес). При цьому обидва компонента реакції реагують з утворенням так званого «перехідного комплексу» або «перехідного стана» Якщо обидва компоненти містяться у реакційній суміші в приблизно стехіометричних співвідношеннях, то швидкість її залежить від концентрацій обох компонентів, тобто цей процес описується рівнянням другого порядку. На швидкість таких реакцій впливають розміри сусідніх з реакційним центром радикалів - якщо їх розміри великі, то реакція уповільнюється з-за стеричних перешкод.
Наприклад: реакція гідролізу бромістого метилу. Гідроксильний іон (з їй) атакує молекулу бромістого метилу, витісняє бром у вигляді іона, причому, розрив зв'язку Карбон - Hal і утворення нового зв'язку С - О
проходить одночасно: |
|
-5 +5 |
-б ОН" + СНз - |
BΓ -> [ ОН...СН3...Вг] ~> ОН - СН3 + Вг~.
Умовні схеми цих процесів такі:
д л я а с и н х р о н н о г о : п е р ш а с т а д і я : X Y < - » Х + + Y ~ ; друга стадія: Х+ + А" -> Х-А.
для синхронного: XY + A -> X...Y...A -» X~+Y-A.
Для встановлення типу реакції вивчають її механізм. Під механізмом розуміють спосіб розриву валентних зв'язків в молекулах і послідовність станів, через які проходять реагуючи речовини до перетворення у кінцеві
продукти, тобто схему реакції по стадіям. Виявлення механізму реакцій необхідно для правильного вибору умов проведення процесу.
Позначення типу реакції включає всі три типа класифікації. Наприклад, реакція заміщення нуклеофільна, мономолекулярна - 5^1, реакція ириєд-нання слектрофільна, бімолекулярна - АВ2. Реакції SR характерні для алканів, Sβ —■ для ароматичних вуглеводнів, Л^ —для алкенів, дієнів. ,.->...
..->
Вуглеводні Вуглеводні - органічні сполуки, у молекули яких входять атоми двох
елементів - Карбону і Гідрогену. Вуглеводні можуть відрізнятися друг від друга будовою карбонового скелету: завдяки здатності атомів Карбону утворювати ланцюги і цикли різного розміру і форми, а також різні типи зв'язків можливі існування великого числа вуглеводнів.
Алкани Алканы (насичені, парафіни) є вуглеводнями, які мають найбільшу кількість
водню. їх називають також вуглеводнями ряду метану (по першому члену
РЯДУ).
Найпростіший представник алканов — метан СН4. Далі йде С?Н6— этан, C3HS - пропан, С4Н|о - бутан, С5Н,2 - пентан і т.д. За складом кожний наступний член ряду відрізняється від попереднього на одну групу СН2, загальна формула ряду СпНгп+2- Ряд сполук, що мають подібну хімічну будову, подібні властивосте і відрізняються один від одного за складом на групу СН2, називаються гомологічним рядом. Члени цього ряду називаються гомологами, різниця в складі двох сусідніх членів ряду - група СН2 - називається гомологічною різницею складу. Хімічні властивості всіх членів гомологічногоо ряду подібні.
Ізомерія
Ізомерія насичених вуглеводнів зубумовлена найпростішим видом структурної ізомерії — ізомерією карбонового скелета. СН3-СН2-СН2~СН3 н-бутан
СНз СН3-СН-СНз ізобутан
Обидва ці вуглеводні — гази, але з різною температурою кипіння: -0,5°С для бутану і -11,7°С для ізобутану. Ізобутан вперше синтезував А. М. Бутлеров (1867 p.), довівши тим самим існування ізомерії алканів.
Сполуки, що мають нерозгалужений карбоновий ланцюг, називають нормальними. Перші алкани — метан, этан, пропан - існують тільки в одній формі, вони не мають ізомерів. У бутану, як уже відзначшіося, існують два ізомери. Для вуглеводню складу СбНіг (пентан) відомі три ізомери:
СНз-СН2 -СН2 -СН2 -СНз н-пентан
Ъ - С Н - СНз-СНг-С.Н-СНз СНз 2-метилбутан
СНз - С - СН3
ff |
:ft |
|
СНз |
2,2-диметилпропан |
Зі збільшенням |
числа карбонових атомів у молекулі зростає і число |
теоретично можливих ізомерів. Так, для гексану воно складає 5, для гептану 9, для октану 18, для нонану 35, для пентадекану 315Н32 4347 і т.д. З цього не виходить, що всі теоретично можливі ізомери дійсно відомі. Для вуглеводнів С4 - С9 вони отримані; для вищих членів ряду відомі лише деякі.
При виводі формул ізомерів рекомендується попередньо будувати схеми карбонових скелетів, поступово укорочуючи основний (головний) ланцюг і розташовуючи вилучені з цього ланцюга атоми Карбону у виді розгалужень (бічних ланцюгів) у всіх можливих положеннях.
Для алканів властива комформаційна ізомерія. Багато фізичних і хімічних властивостей речовин залежать від того, яка саме конфірмація в них переважає. Як показують рентгенографічні дослідження, алкани нормальної будови у твердому стані мають правильну зиґзаґоподібну конформацію. Номенклатура
Перші чотири представники ряду алканів мають випадкові тривіальні назви: метан, этап, пропан, бутан. Назви наступних членів ряду утворюють від грецьких числівників, що вказують число карбонових атомів у молекулі; до них додається загальне для усього гомологического ряду алканов закінчення ан. Для назви алканів широко використовується раціональна номенклатура, відповідно до якої органічні речовини розглядаються як продукти ускладнення найпростішого представника даного гомологічного ряду. По цій номенклатурі назви всіх алканів утворюються з назви метану, перед яким поміщають позначення вуглеводневих радикалів, що заміщають у ньому атоми водню; радикали перелічують за абеткою. Якщо мається кілька однакових радикалів, то число їх указуют:. за допомогою префіксів - числівників ди- (два), три-,-тетра- (чотири). Наприклад, СНз - СН - СНз
СНз триметилметан (ізобутан).
При складанні назви вуглеводні з розгалуженим ланцюгом розглядають як с похідні нормальних алканів, у ланцюгах яких замість атомів Гідрогену знаходяться вуглеводневі радикали. Головний ланцюг вибирають максимальної довжини, карбонові атоми нумерують, починаючи з кінця, більш близького до розгалуження. У назві сполук цифрою вказують номер карбонового атома, при якому знаходиться радикал, що заміщується, потім назва радикала і назва головного ланцюга. Якщо радикали повторюються, то перелічують цифри, що вказують їхнє положення, а число однакових радикалів указують префіксами
ди-, три-, тетра-. Наприклад, С Н з - С Н - С Н з |
|
|
|||
СНз |
триметилметан (ізобутан) |
|
|
||
СНз - СН - СН2 - СН2 - СН - СНз |
|
|
|||
СНз |
|
СНз |
2,5-диметилгексан. |
||
Хімічні властивості |
|
|
|
|
|
У хімічному відношенні алкани мало активні. |
Хімічна поведінка насичених |
||||
вуглеводнів визначається характером і міцністю |
їхніх зв'язків у молекулах. |
||||
Г ї |
■ " : |
' |
' |
" |
. |
|
7 8 |
|
|
|
|
Стійкість карбон-карбонового (С - С) зв'язку зумовлена малим розміром атома карбону і його тетраедричною конфігурацією в стані «/?3"гібридизації, що сприяє максимальної концентрації електронного заряду між ядрами.
Галогенування •■-
Радикальне галогенування - важлива реакція алканів. У якості галогенуючих агентів можна застосовувати не тільки хлор, але і бром. Иод не здатний до реакції прямого заміщення водню, фтор діє занадто енергійно і руйнує органічні молекули. У промисловості використовують також термічне хлорування алканів при температурах < 300°С.
Радикальному заміщенню на хлор послідовно можуть піддаватися всі атоми Гідрогену в метані.
Нітрування
При звичайних температурах алкани стійкі до дії концентрованої нітратної кислоти. Однак при нагріванні їх з розведеною нітратною кислотою чи оксидами Нітрогену йде реакція нітрування - заміщення атома Гідрогену на нітрогрупу NO2. Вперше її здійснив М. И. Коновалів (1888 р.) і вона має його ім'я.
В умовах високих |
температур нітратна кислота розпадається за |
радикальним типом: |
НО - NO2 -► НО" + ЖЬ. Радикали, що утворюються, |
відривають Гідроген від молекул алканів, перетворюючи їх у радикали: |
|
110- + RH -* R + Н20; |
R + N02 -» RNO2 . |
Алкени |
="'■' |
Алкенами (олефінами) називають ненасичені вуглеводні, що містять у молекулі один подвійний зв'язок. Найпростішим представником таких нуглеводнів є ет;:лен С-Н4. Гомологами етилену є пропілен С3Н6, бутси С4Н8, иентен С5Н]0 і ін. Алкени мають загальну формулу С„Н2ш тобто ізомерні з циклоалканами.
Будова
Характерна риса будови алкенів - наявність в молекулі одного подвійного карбон-карбонового зв'язку. Подвійний зв'язок утвориться за допомогою двох пар узагальнених електронів (чьотирьохэлектронний зв'язок). Карбонові атоми, ін'язані подвійним зв'язком, знаходяться в стані «р2-гібридизації, кожний з них утворює три а-зв'язки, що лежать в одній площині під кутом 120°. Нсгібридизовані орбіталі р-злектронів розташовані перпендикулярно до площини ст-зв'язків і паралельно один одному і внаслідок «бічного» перекривання утворюють другий зв'язок, який називається я -зв'язком. Іілектронна хмара я-зв'язку частково розташована над площиною, а частково під площиною, у якій лежать атоми. Таким чином, подвійний зв'язок являє собою сполучення а- і я-зв'язків. Бічне перекривання негібридизованних р- орбіталей, що утворюють тс-зв'язок, зближує атоми Карбону і відстань між ними стає коротшою - довжина подвійного С=С-зв'язку 0,133 нм (довжина простого С-С-зв'язку 0,154 нм). Схема розташування атомів і зв'язків у молекулі с гилена наведена на рис. 1.

і р-єлектронні хмари; в — геометрія
Рис. 1. Будова етилена: ст-зв'язки молекули.
Ізомерія і номенклатура Структурна ізомерія. Структурні ізомери алкенів можуть відрізнятися
будовою карбонового ланцюга і положенням подвійного зв'язку. Так, для бутену СДз відомі три ізомери:
СН2 = СН-СН2-СН3 бутен-1 |
СН3-СН = СН-СН3 бутен-2 |
СН2= С - СНз метилпропен |
|
<±Н3 |
ї:.г: |
Цей приклад показує, що число ізомерів у алкенів вище, ніж у алканів.
Для етиленових сполук можлива просторова ізомерія, що зв'язана з розташуванням замісників стосовно площини подвійного зв'язку. Ця ізомерія спостерігаєгься в тих випадках, коли кожний з атомів Карбону, зв'язаних подвійним зв'язком, витрачає інші дві одиниці валентності на зв'язок із двома різними замісниками. Розташування пари однакових замісників по одну сторону площини подвійного зв'язку дає цис-изомер, по різні сторони — трансізомер, наприклад:
цис-бутен-2 (c= -139,3°С, *КИП= +3,7 °С) транс-
бутен-2 (/пл = -105,8°С, tam= +0,96 °С)
S K * ■■
Номенклатура
Тривіальні назви алкенів характеризуються закінченням илен (ілен): етилен, пропілен, бутилен і т.д. Раціональна номенклатура розглядає алкени як похідні етилена, що містять замість атомів Гідрогену вуглеводневі радикали; у разі потреби уточнюють положення радикалів у різних атомів етиленового угруповання, позначаючи їх грецькими буквами а і р, наприклад:
Ш2= СН - СН2 - СНз |
|
СНз - СН = СН - СНз |
етил етилен (бутен-1); |
. |
а,р-диметилетилен (бутен-2). |
Хімічні властивості
Хімічна поведінка алкенів визначається наявністю подвійного зв'язку. Електронна густина о-зв'язку концентрується по лінії, що з'єднує ядра атомів, а електронна густина тг-зв'язку виходить за ці межі і утворює більш велику область негативного заряду. При руйнуванні п-зв'язку відбуваються реакції
приєднання з утворенням двох нових ст-зв'язків. Такі реакції типові для алкенів.
Реакції приєднання
Реакції електрофільного приєднання до подвійного зв'язку відбуваються по гетеролітичному типу і є ступінчастим іонним процесом. Вирішальною стадією таких реакцій є взаємодія електрофільного реагенту з я-електронною хмарою подвійного зв'язку. Часто в ролі електрофільного реагенту виступає протон ¥Ґ, що утворюється при дисоціації мінеральних кислот (НС1, НВг, НІ, H2SO4). Спочатку електрофільньш реагент за рахунок свого позитивного заряду взаємодіє з тс-електронами подвійного зв'язку, утворюючи л-комплекс. Потім з одним з ненасичених С-атомів за участю р-електронів подвійного зв'язку утворюється звичайний а-зв'язок. Сусідній атом Карбону - другий партнер подвійного зв'язку, позбавивши електрона, здобуває позитивний заряд:
НҐ Н
С - С+ -
/ \
л-комплекс карбокатіон
В другій, завершальній стадії карбокатіон реагує з аніоном X , утворюючи другий а-зв'язок. У результаті виходить кінцевий продукт приєднання:
У |
н \ |
X/ |
|
|
|
|
Н\ |
|
|
Звичайно перша стадія йде повільніше, ніж друга. |
|
|||
Розглянемо наступні реакції приєднання до алкенів. |
розберемо |
|||
1. Галогенгідрування (приєднання галогеноводнів). Як приклад |
||||
|
||||
приєднання бромоводню до бутену-2: |
|
|
||
НВг ->Н+ + ВГ |
( |
Н+ф |
|
|
СН3-СН = СН-СН3 + Н+-> |
дНз - СН = СН - СНз |
|
||
СНз~СН2 - • ± - € Н 3 - СН 2 |
- СНВгСНз . |
|
||
правила Марковнікова (1869 р.): при приєднанні галогеноводнів до несиметричних алкенів водень приєднується до більш гідрогенізованого атома Карбону, а галоген - до менш гідрогенізованого:
СН3 - СН = СН2 + НВг -> СНз-СНВг-СНз.
Галогенування
За електрофільним механізмом йде і приєднання галогенів. Під впливом електронної густини подвійного зв'язку відбувається поляризація в молекулі галогена, тобто електрофільність симетричної молекули галогена може проявитися тільки після поляризації. Далі реакція йде за описаним вище шляхом:
81
