
- •1. Загальні правила роботи в лабораторії
- •2. Запобіжні засоби і перша допомога при нещасних випадках
- •3. Основний лабораторний хімічний посуд
- •4. Зборка приладів
- •5. Миття і сушка хімічного посуду
- •5. Використання літератури і правила складання звіту
- •1. Нагрівання
- •2. Охолоджування
- •3. Вимірювання і регулювання температури
- •4. Подрібнення і перемішування
- •5. Розчинення і Властивості деяких органічних розчинників
- •6. Сушка і основні осушувачі
- •7. Фільтрування
- •1. Кристалізація
- •2. Возгонка (сублімація)
- •3. Екстракція
- •4. Перегонка
- •5. Хроматографія
- •1. Температура плавлення
- •2. Температура кипіння
- •3. Відносна густина
- •4. Показник заломлення
- •5. Молекулярна маса
- •1. Якісний аналіз
- •2. Фізико-хімічні методи встановлення структури речовини
- •3. Ідентифікація невідомої речовини
- •1. Відновлення воднем і реакції гідрУвання
- •2. Одержання металів, їх сплавів і деяких неметалів
- •Питомі теплові ефекти (q) відновлення оксидів алюмінієм
- •3. Одержання металів і деяких неметалів відновленням водних розчинів солей
- •4. Хлорування металів, неметалів і оксидів
- •5. Бромування металів і неметалів
- •6. Йодування металів, неметалів і оксидів
- •7. Одержання сульфідів, селенідів і телуридів
- •8. Нітрування. Одержання нітридів
- •9. Одержання карбідів
- •10. Термічне розкладання речовин з метою одержання оксидів
- •11. Зневоднення крісталогідратів
- •12. Одержання солей
- •1. НітрУвання
- •2. Нітрозування
- •3. Сульфування
- •4. Галогенування
- •5. Алкілювання
- •6. Ацилювання
- •7. ДіазоТуВаНня і Реакції діазосполук
- •8. АзоспОлуЧення
- •9. Відновлення
- •10. Окислення
- •11. Амінування
- •12. Гидроксилювання
- •13. Конденсація
- •14. Полімеризація і поліконденсація
2. Одержання металів, їх сплавів і деяких неметалів
Відновлення оксидів. Металотермічний метод, відкритий у 1856 р. М.М. Бекетовим, знайшов застосування як в промисловості, так і для лабораторного одержання металів, сплавів і деяких неметалів. Можливість металотермічного одержання металів і сплавів визначається як фізико-хімічними властивостями вихідних і кінцевих речовин, так і тепловими умовами проведення реакцій.
Кількості теплоти, яка виділяється під час проведення реакції, повинно вистачити як на нагрівання речовин вище температури плавлення самого тугоплавкого з одержуваних компонентів, так і на теплові втрати за час від початку реакції до закінчення розшарування продуктів реакції на шлак і метал. При відновленні більшості оксидів Fe2O3, Fe3O4, Co3O4, CoO, NiO, МnО2, Мn2О3, Мn3О4, СrО3, МоО3, МоО2, V2O5, SnO2, CuO, Cu2O алюмінієм теплоти, що виділяється, цілком достатньо як на нагрівання продуктів реакції, так і на теплові втрати. Тому ці оксиди легко відновлюються алюмінієм. Майже у всіх випадках утворюється метал, який осідає на дно тигля.
При відновленні оксидів МnО2 і Мn2О3 вони розкладаються в зоні реакції з виділенням кисню і утворенням оксиду марганцю Мn3О4. Кисень, що виділяється, розкидає реакційну масу і перемішує продукти реакції, що заважає осадженню одержуваного металу на дно тигля. Тому ці оксиди не можна застосовувати для одержання марганцю або його сплавів. Часткове розкладання і випаровування спостерігається при алюмотермічному відновленні оксиду хрому (VI) і оксиду молібдену (VI). Ці оксиди також не можна безпосередньо використовувати для алюмотермічного одержання металів. Але ці оксиди можна використовувати як добавки до різних оксидів з метою одержання сплавів.
Оксиди можна використовувати для одержання двох-, трьохкомпонентних сплавів. При відновленні деяких оксидів (Сr2О3, Nb2O3, Ta2O3, SiO2, TiO2, ZrO2, B2O3) алюмінієм теплоти, що виділяється, недостатньо для нагрівання продуктів реакції, вище за їх температури плавлення. Але якщо до них додати необхідну кількість оксидів які легко відновлюються, то реакція пройде і сплав осяде на дно тигля.
Визначимо мінімальну кількість оксиду, що легко відновлюється, яку слід додати до оксиду, що важко відновлюється, щоб утворився двокомпонентний сплав. У результаті відновлення оксиду алюмінієм або іншим металом виділяється певна кількість теплоти, яка повинна нагрівати продукти реакції до певної температури:
![]()
де q – питома теплота реакції, тобто кількість теплоти, що виділяється на 1 г реакційної маси; Ср – середня питома теплоємність продуктів реакції.
Насправді, від початку реакції до закінчення розшарування продуктів на шлак і метал частина теплоти втрачається. Тому реальна температура нагрівання продуктів реакції складе:
![]()
де q1 – кількість теплоти, що втрачається реакційною масою.
Якщо прийняти, що теплоємність продуктів реакції і теплові втрати є постійною величиною, то
![]()
оскільки теплові втрати в конкретних випадках також представляють величину постійну.
Для визначення мінімальної кількості оксиду, що легко відновлюється, яку слід додати до оксиду, що важко відновлюється, складемо рівняння:
![]()
Це рівняння визначає питомий тепловий ефект відновлення суміші двох оксидів, в якому, % ок. – відсоток оксиду, що легко відновлюється, q1 – його питомий тепловий ефект відновлення, q2 – питомий тепловий ефект відновлення оксиду, що важко відновлюється.
Після сумісного зведення двох останніх рівнянь і перетворень отримаємо:
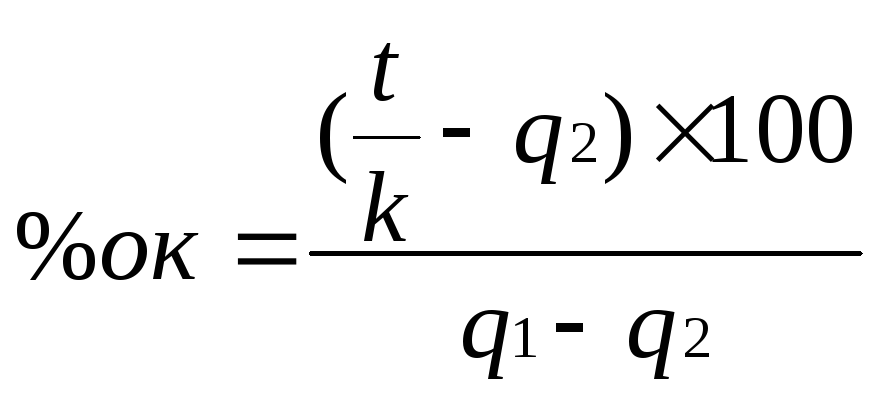
Приймемо значення t рівним температурі плавлення найтугоплавкішого з одержуваних компонентів. Як правило, ним є шлак – оксид алюмінію, який плавиться при 2050°С. Значення питомих теплових ефектів реакцій відновлення відповідних оксидів алюмінієм наведені в таблиці 1.
Таблиця 1
