
Обсуждение результатов
Характеристика полученных веществ.
Азотная кислота:
Безводная азотная
кислота - бесцветная или слегка желтоватая
жидкость (плотность при 20 1,51 г/см3),
кипит при 83
1,51 г/см3),
кипит при 83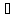 с частичным разложением. Дымящая азотная
кислота (ω(HNO3)=95-98%)
представляет собой красно-бурую жидкость,
дымящую на воздухе. С водой образует
азеотропную смесь (ω(HNO3)=68%,
плотность при 20
с частичным разложением. Дымящая азотная
кислота (ω(HNO3)=95-98%)
представляет собой красно-бурую жидкость,
дымящую на воздухе. С водой образует
азеотропную смесь (ω(HNO3)=68%,
плотность при 20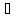 1,41г/см3),
кипящую при температуре 121
1,41г/см3),
кипящую при температуре 121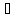 .
Растворимость в воде не ограничена.
Очень гигроскопична.
.
Растворимость в воде не ограничена.
Очень гигроскопична.
Азотная кислота образуется в результате реакции
2KNO3(тв.)
+ H2SO4(конц) 2HNO3
(г)+K2SO4(тв.)
2HNO3
(г)+K2SO4(тв.)
Описание полученного вещества:
Желтоватая жидкость, дымящая на воздухе.
Оценка плотности путем расчета через известную массу и объем. m(продукта)=9,545г V=6,5мл => ρ=
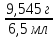 =1,468г/мл
Это соответствует концентрации 85% =>
в пересчете на сухое вещество
=1,468г/мл
Это соответствует концентрации 85% =>
в пересчете на сухое вещество
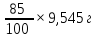 =8,11г
продукта, ν(безводного продукта)=
=8,11г
продукта, ν(безводного продукта)=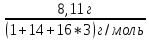 =0,13моль
=0,13мольРасчет выхода: ν(KNO3)=
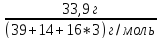 =0,33моль=νтеор.(HNO3)
ω=
=0,33моль=νтеор.(HNO3)
ω=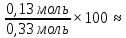 40%
40%
Нитрозилсерная кислота:
Белое кристаллическое
вещество, устойчивое в атмосфере сухого
воздуха. При нагревании выше 73,5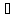 плавится с разложением. Водой быстро и
полностью гидролизуется.
плавится с разложением. Водой быстро и
полностью гидролизуется.
Конечный продукт образуется в результатате реакции
SO2(г) + HNO3(безв.) = (NO)HSO4
Изучение вещества:
Расчет выхода V(HNO3)=6мл ω=85% ρ=1,468г/мл m(HNO3)=0.85
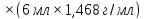 =7,486г
=7,486г
ν(HNO3)=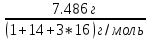 =0,11моль=νтеор.((NO)HSO4)
=0,11моль=νтеор.((NO)HSO4)
v((NO)HSO4)= =0,0352моль
=0,0352моль
ω0=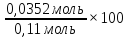 =32%
=32%
При растворении вещества в воде оно полностью гидролизовалось
2[NO+][HSO4] + Н2O = NO + NO2 + 2H2SO4
Универсальная индикаторная бумажка при погружении в раствор покраснела => в растворе среда кислая
При реакции с хлоридом бария выпал характерный белый осадок, что свидетельствует о наличии серной кислоты в продуктах гидролиза.
Ba2+ + SO42- = BaSO4(белый осадок)
При споласкивании колбы-реактора с остатками нитрозилсерной кислоты охлажденной ледяной уксусной кислотой можно было наблюдать голубой раствор. Это говорит о наличии азотистой кислоты которая может образовываться в результате гидролиза при пониженных температурах в очень разбавленных растворах.
(NO)HSO4
+ H2O
 H2SO4
+ HNO2
H2SO4
+ HNO2
Как мы можем наблюдать в обоих синтезах, выход оказался довольно маленьким. Это можно объяснить следующим образом.
Дымящая азотная кислота очень гигроскопичное вещество, которое вбирает в себя всю окружающую влагу в том числе и из воздуха, этим можно объяснить снижение концентрации азотной кислоты.
Нитрозилсерная кислота очень чувствительное к внешней среде вещество. Оно крайне не устойчиво в присутствии органики и при контакте с водой. В процессе синтеза даже при незначительном увеличении тока SO2 происходит разогревание реакционной смеси, что в совокупности с наличием воды в азотной кислоте приводит к тому, что часть основного продукта может разложиться с образованием оксидов азота.
Выводы
Были получены и охарактеризованы два вещества: дымящая азотная кислота и гидросульфат нитрозила.
В связи с их особенностями, выход оказался не высоким.
Для характеристики вещества использовались наблюдения за внешними признаками веществ, а так же качественные реакции.
Гидросульфат нитрозила относительно не устойчивое вещество.
Оба вещества обладают ярко выраженными окислительными свойствами.
Азотная кислота в растворах проявляет еще и кислотные свойства.
Нитрозосоединения очень богатый класс соединений, изучение которого представляет интерес и в настоящее время. Уже многие представители этого класса были подробно описаны и нашли применение в различных отраслях промышленности. Комплексные соединения очень разнообразны и представляют интерес в изучении. Ковалентные и ионные соединения отличаются высокой реакционной способностью и чувствительностью, что представляет некоторую трудность при их получении и изучении.
