
Силан получают при реакции тертрахлорида кремния с тетрагидроалюминатом лития в эфире
Силан – газ, поэтому
его очищают методом глубокого охлаждения
и низкотемпературной ректификации.
Процесс восстановления тетрахлорида
кремния и трихлорсилана проводят с
участием особо чистого водорода на
стержнях из особо чистого кремния,
разогреваемых до соответствующей
температуры электрическим током.
Температура восстановления тетрахлорида
кремния по реакции
 составляет
1050 – 11000С.
Трихлорсилан восстанавливается по
реакции
составляет
1050 – 11000С.
Трихлорсилан восстанавливается по
реакции
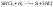 при температуре
1200 – 13000С.
В этом случае требуется меньшее количество
водорода, несмотря на то, что он берется
в избытке. Получаемый по последней
реакции кремний содержит меньше примесей.
Недостатком хлорсиланового метода
является взрывоопасность
при температуре
1200 – 13000С.
В этом случае требуется меньшее количество
водорода, несмотря на то, что он берется
в избытке. Получаемый по последней
реакции кремний содержит меньше примесей.
Недостатком хлорсиланового метода
является взрывоопасность
 Силан
термически разлагается при температуре
600 – 7000С
Силан
термически разлагается при температуре
600 – 7000С
 .
.
Силановый метод получения кремния в основном применяется для формирования пленок поликристаллического кремния, которые служат основой для изготовления резисторов, межсоединений, контактных площадок к эмиттеру и коллектору транзисторных структур интегральных схем. Главным недостатком метода является горючесть и взрывоопасность силана.
Химические
свойства.
В обычных
условиях кремний довольно инертен. С
простыми веществами (кроме фтора)
реагирует лишь при нагревании.

С водой кремний
реагирует только при высокой температуре
по реакции

С кислотами кремний не реагирует из-за наличия на его поверхности пленки оксида, который не растворяется в кислотах за исключением фтороводородной (плавиковой). В технологии микроэлектроники кремний растворяют (травят) в смеси азотной, плавиковой и уксусной кислот. Азотная кислота выполняет роль окислителя, плавиковая кислота – роль комплексообразующего соединения, уксусная – роль регулятора скорости травления. Процесс растворения кремния протекает по реакции


 или, суммарно
или, суммарно
 Уксусная
кислота в реакции не участвует, но ее
присутствие меняет степень диссоциации
плавиковой кислоты и, следовательно,
влияет на скорость образования
Уксусная
кислота в реакции не участвует, но ее
присутствие меняет степень диссоциации
плавиковой кислоты и, следовательно,
влияет на скорость образования
 ,
тем самым, определяя скорость всего
процесса.
,
тем самым, определяя скорость всего
процесса.
Согласно теории гетерогенной химической кинетики весь процесс травления делится на пять этапов:
1. Диффузия реагентов к поверхности твердого тела;
2. Адсорбция реагентов на поверхности твердого тела;
3. Химическая реакция;
4. Десорбция продуктов реакции с поверхности твердого тела;
5. Диффузия продуктов реакции от поверхности твердого тела в объем раствора.
Скорость суммарного процесса травления определяется (контролируется) скоростью самой медленной стадии. В зависимости от условий такой стадией может быть либо химическая реакция, либо диффузия, так как при химическом травлении процесс адсорбции – десорбции характеризуется малыми значениями энергии активации и поэтому протекает достаточно быстро.
Растворы, в которых самой медленной стадией будет диффузия (диффузионный контроль процесса травления), являются полирующими травителями. Они сглаживают все неровности и нечувствительны к физическим и химическим неоднородностям поверхности.
Растворы, в которых самой медленной стадией будет химическая реакция (кинетический контроль процесса), называются селективными. Такие травители выявляют неоднородности поверхности твердого тела: дефекты и несовершенства кристаллической структуры, p-n переходы, неравномерность в распределении примеси.
Растворы, применяемые для травления полупроводников, обычно состоят из пяти компонентов: растворителя, окислителя, комплексообразующего соединения, регулятора скорости травления и специальных добавок, усиливающих селективность действия травителя на отдельные участки поверхности полупроводника.
Растворитель – среда для образования гомогенной системы. В качестве растворителей в технологии чаще всего используются вода, безводная (ледяная) уксусная кислота, одно- и многоатомные спирты, а также комбинации всех перечисленных веществ. Изменяя количество растворителя можно регулировать концентрации остальных компонентов травителя, а также вязкость среды. Оба эти фактора влияют на скорость диффузии. С другой стороны природа растворителя определяет силу и окислительную способность растворенных в нем электролитов. Таким образом, растворитель способен выполнять функции регулятора скорости травления.
Окислитель –
окисляет полупроводник обычно до оксида
или какого-либо другого продукта. В
качестве окислителей чаще всего
используются
 ,
,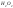 ,
, ,
,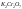 ,
,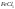 ,
, и ряд других соединений.
и ряд других соединений.
Комплексообразующее
соединение – способствует растворению
образовавшегося продукта окисления.
Для полупроводников роль этого компонента
чаще всего исполняют ионы
 и
и .
.
Регулятор скорости травления вводится в том случае, если скоростью процесса трудно управлять. Обычно в качестве регулятора скорости травления выступает растворитель. Но иногда в раствор вводят специальные вещества, которые могут менять вязкость растворителя, степень диссоциации комплексообразующего соединения, окислительную способность окислителя. Обычно это фосфорная и уксусная кислоты, глицерин, этиленгликоль, другие спирты.
Кремний энергично
растворяется в растворах сильных
оснований с выделением водорода. Например

В этой реакции окислителем является вода, комплексообразующим соединением – гидроксид калия, регулятором скорости травления – вода, как растворитель. Вместо сильных оснований могут использоваться гидразин, этилендиамин и другие, средние по силе органические основания, применение которых позволяет повысить селективность травления.
В технологии
микроэлектроники для травления германия
используют смесь азотной с плавиковой
или соляной кислотой («царскую водку»)

Иногда вместо
азотной кислоты в качестве окислителя
используется пероксид водорода. С
растворами сильных оснований германий
реагирует только в присутствии сильных
окислителей
 .
.
Кремний — элемент главной подгруппы четвёртой группы третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 14. Обозначается символом Si (лат. Silicium).
В промышленности кремний технической чистоты получают, восстанавливая расплав SiO2 коксом при температуре около 1800 °C в руднотермических печах шахтного типа. Чистота полученного таким образом кремния может достигать 99,9 % (основные примеси — углерод, металлы).
Химические свойства
Подобно атомам углерода, для атомов кремния является характерным состояние sp3-гибридизации орбиталей. В связи с гибридизацией чистый кристаллический кремний образует алмазоподобную решётку, в которой кремний четырёхвалентен. В соединениях кремний обычно также проявляет себя как четырёхвалентный элемент со степенью окисления +4 или −4. Встречаются двухвалентные соединения кремния, например, оксид кремния (II) SiO.
При нормальных условиях кремний химически малоактивен и активно реагирует только с газообразным фтором, при этом образуется летучий тетрафторид кремния SiF4. Такая «неактивность» кремния связана с пассивацией поверхности наноразмерным слоем диоксида кремния, немедленно образующегося в присутствии кислорода, воздуха или воды (водяных паров).
При нагревании до температуры свыше 400—500 °C кремний реагирует с кислородом с образованием диоксида SiO2, процесс сопровождается увеличением толщины слоя диоксида на поверхности, скорость процесса окисления лимитируется диффузией атомарного кислорода сквозь плёнку диоксида.
При нагревании до температуры свыше 400—500 °C кремний реагирует с хлором, бромом и иодом — с образованием соответствующих легко летучих тетрагалогенидов SiHalogen4 и, возможно, галогенидов более сложного состава.
5
6
