
- •Лабораторные работы по курсу «Неорганическая химия» Литература к модулю 1, 2, 3
- •Описание лабораторных работ. Работа 1 . Получение и изучение свойств комплексных соединений.
- •Опыт 1. Зависимость окраски аквакомплексов от типа комплексообразователя
- •Опыт 2. Зависимость окраски комплексов кобальта от типа лигандов
- •Опыт 3. Ступенчатая диссоциация бромидных комплексов меди(II)
- •Получение комплексных соединений. Написание уравнений комплексообразования. Названия.
- •Опыт 4. Получение аммиаката никеля
- •Опыт 5. Получение и изучение свойств ацидокомплекса ртути
- •Опыт 6. Получение соединения, содержащего комплексные катион и анион
- •Опыт 7. Влияние природы d–элемента на комплексо образование
- •Устойчивость комплексных соединений
- •Опыт 8. Влияние концентрации раствора на устойчивость комплексных соединений
- •Опыт 9. Сравнительная устойчивость хлоридных комплексов цинка и кобальта
- •Опыт 10. Сравнительная устойчивость роданидного и фторидного комплексов железа
- •Опыт 11. Разрушение комплексов а) Осаждение комплексообразователя
- •Б) Окислительно–восстановительные реакции разрушения комплексных соединений
- •Контрольные вопросы и упражнения для защиты лабораторной работы
- •Работа №2. Синтез комплексных соединений Задания к синтезу комплексных соединений Задание 1
- •Задание 2
- •Задание 3
- •Задание 4
- •Задание 5
- •Задание 6
- •Задание 7
- •Модуль 3 Элементы viib группы. Работа . Соединения марганца
- •Опыт 1. Получение гидроксида марганца (II)
- •Опыт 4. Окислительно-восстановительные свойства манганатов (реакция диспропорционирования)
- •Опыт 5. Окислительные свойства перманганатов
- •Опыт 6. Влияние среды на окислительные свойства перманганата
- •Контрольные вопросы и задания для защиты лабораторной работы
- •Содержание
Опыт 6. Получение соединения, содержащего комплексные катион и анион
Опыт проводить в вытяжном шкафу!
Выполнение опыта.В пробирку внести 2 капли раствораK4[Fe(CN)6] и 4 капли раствораNiSO4. К полученному осадку гексацианоферрата (II) никеля (II) добавить по каплям 25%–ный растворNH3. Наблюдать образование кристаллов комплексной соли [Ni(NH3)6]2[Fe(CN)6].
Написать уравнения всех происходящих в данном опыте реакций, назвать комплексные соединения.
Опыт 7. Влияние природы d–элемента на комплексо образование
Большинство гидроксидов d-элементов растворимы в концентрированных растворах аммиака с образованием комплексных аммиакатов, в щелочах же растворимы только амфотерные гидроксиды с образованием гидроксокомплексов, содержащих во внутренней сфере гидроксогруппыOH–.
Выполнение опыта.В две пробирки внести по 2 – 3 капли растворов: в одну – сульфата цинка, в другую – сульфата кадмия. Добавить по каплям раствор щелочиNaOHдо образования белых осадков. К полученным осадкам еще добавить по 1 – 2 капле избытка щелочи. Что наблюдается? Обратить внимание, что гидроксид цинка обладает амфотерным характером, а гидроксид кадмия – основным.
Написать уравнения соответствующих реакций получения гидроксидов и растворения гидроксида цинка в избытке щелочи с образованием гидроксокомплекса. Назвать комплексное соединение цинка.
Повторить опыт, заменив раствор щелочи раствором гидроксида аммония. Отметить растворение осадка в обеих пробирках.
Написать уравнения реакций образования аммиачных комплексов. В чем принципиальная разница между процессами растворения гидроксидов d–элементов в щелочах и растворе аммиака?
Устойчивость комплексных соединений
Устойчивость комплексных соединений характеризуется степенью диссоциации комплексных ионов, которая может быть выражена через константу равновесия, называемуюконстантой нестойкости Kн. Например, комплексное соединение [Ag(NH3)2]NО3диссоциирует по ступеням:
Iступень: [Ag(NH3)2]NО3 = [Ag(NH3)2]++NО3‑ – α = 100%;
IIступень: [Ag(NH3)2]+
![]() Ag++2NН3.
Ag++2NН3.
Константа равновесия (нестойкости):
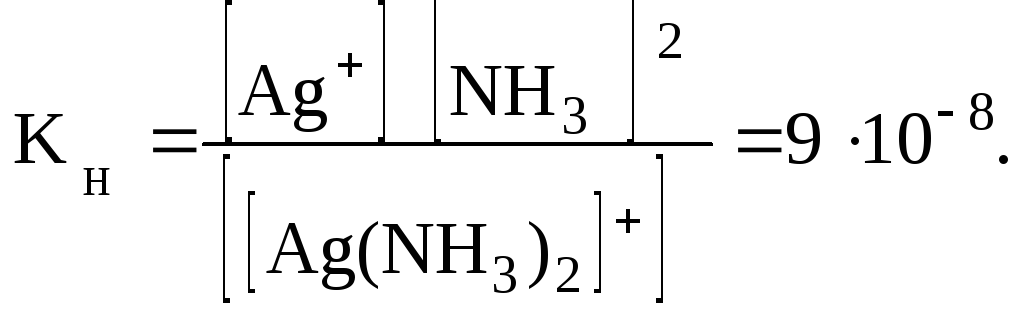
Процесс диссоциации и константа нестойкости комплексного иона [Ag(СN)2]–выражаются следующим образом:
[Ag(СN)2]–
![]() Ag+ + 2СN–
Ag+ + 2СN–
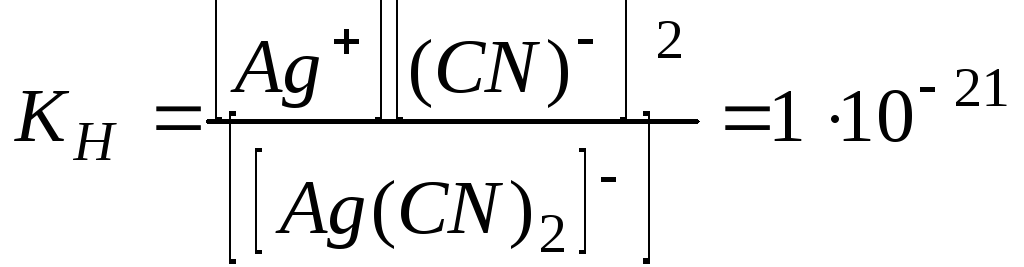 .
.
Второй комплекс более устойчив, так как характеризуется меньшей величиной константы нестойкости (табл. П3.8).
Разрушение комплексных ионов может быть осуществлено различными способами:
1) связыванием лигандов или комплексообразователя в более прочное образование (слабый электролит, например, воду, более прочный комплексный ион, осадок). Например:
Na2[Zn(OH)4+ 4HCl=ZnCl2+ 2NaCl+ 4H2O;
[Ag(NH3 )2NO3+ 2NaCN=Na[Ag(CN)2+NaNO3+ 2NH3;
[Ag(NH3 )2NO3+ 2NaBr = AgBr↓ + NaNO3 + 2NH3;
2) нагреванием (при наличии летучих лигандов). Например:
[Ag(NH3 )2NO3 → 2NH3 + AgNO3;
3)окислительно-восстановительными реакциями. Например:
2Na[Au(CN)4+ 3Zn+ 4NaCN= 2Au+ 3Na2[Zn(CN)4.
Опыт 8. Влияние концентрации раствора на устойчивость комплексных соединений
Выполнение опыта.В пробирку внести 3 – 4 капли раствора хлорида кобальта (II) и прибавить по каплям насыщенный раствор роданида аммонияNH4CNSдо образования соединения ярко-синего цвета. Раствор разделить на две части: к первой части добавить 5 – 7 капель амилового спирта, ко второй - столько же воды. Отметить окраску полученных растворов. Сделать вывод об устойчивости комплексного соединения в разбавленных и насыщенных растворах.
