
- •1.Основные понятия в химии: вещество, молекула, атом. Строение атома. Химический элемент. Изотопы. Атомная единица массы. Число Авогадро. Моль.
- •3.Понятие эквивалента вещества. Определение эквивалента. Определение эквивалентной массы кислот, оснований, солей, оксидов, простых веществ в овр. Закон эквивалентов. Объемный анализ.
- •5.Принципы и правила заполнения орбиталей. Принцип минимальной энергии. Принцип запрета Паули. Правило Хунда. Правило Клечковского.
- •6. Периодический закон и периодическая система
- •8. Ионная, металлическая, водородная связи. Влияние водородной связи на физико-химические свойства веществ.
- •9.Классификация неорганических соединений
- •10. Соли, их классификация, номенклатура, получение, химические свойства.
- •11.Скорость химической реакции. Гомогенные и гетерогенные реакции. Кинетическое уравнение реакции. Период полупревращения.
- •12.Влияние температуры на скорость реакции. Правило Вант-Гоффа. Энергия активации. Уравнение Аррениуса. Эндотермические и экзотермические реакции
- •13. Кинетика обратимых реакций. Химическое равновесие, выражение для константы равновесия, сдвиг химического равновесия. Принцип ле Шателье
- •14.Гомогенный и гетерогенный катализ, цели применения катализаторов. Ферментативный катализ и его особенности.
- •15. Тепловой эффект реакции. Первый закон термодинамики. Понятие энтальпии. Закон Гесса. Калорийность пищи.
- •16.Энтропия. Второй закон термодинамики. (постулат Планта): Энергия Гиббса.
- •18. Ионное произведение воды. Водородный и гидроксильный показатель (pH и pOh). Индикаторы. Расчет pH растворов слабых электролитов. Буферные растворы, расчет pH буферных систем.
- •19. Гидролиз солей. Степень и константа гидролиза. Расчет рН растворов солей, образованных слабой кислотой и сильным основанием, сильной кислотой и слабым основанием.
- •20 .Овр. Основные понятия. Метод электронного баланса. Метод полуреакций. Классификация овр.
- •21. Перманганатомерия; иодометрия: определение концентрации н2о2 и активного хлора в хлорной извести. Эквивалент в овр.
- •23.Коллигативные свойства, законы Рауля, закон Вант-Гоффа
- •24 . Комплексные соединения, классификация, структура, номенклатура. Химическая связь в кс.
- •25.Протеолитическая теория кислот и оснований.
- •26.Протолитический баланс.
- •27.Биогенные элементы- элементы ответственные за построение и жизнедеятельность клеток организма.
- •29Азот, его свойства. Аммиак. Кислородные соединения азота. Круговорот азота в природе.
- •30.Фосфор,его содинения
- •32.Кислород его свойства. Озон. Пероксид водорода его свойства. Круговорот кислорода в природе.
- •33.Сера
- •38. Сорбция и её виды: абсорбция, адсорбция. Коэффициент абсорбции. Удельная адсорбция. Уравнение Ленгмюра, его линейная аппроксимация.
- •39. Дисперсная система. Их классификация. Мицелла.
10. Соли, их классификация, номенклатура, получение, химические свойства.
Солями называются сложные вещества формула молекулы которых, состоит из атомов металлов и кислотных остатков (иногда могут содержать водород). Например, NaCl – хлорид натрия, СаSO4 – сульфат кальция и т. д.
Практически все соли являются ионными соединениями, поэтому в солях между собой связаны ионы кислотных остатков и ионы металла:
Na+Cl– – хлорид натрия
Ca2+SO42– – сульфат кальция и т.д.
Соль является продуктом частичного или полного замещения металлом атомов водорода кислоты. Отсюда различают следующие типы солей:
1. Средние соли – все атомы водорода в кислоте замещены металлом: Na2CO3, KNO3 2. Кислые соли – не все атомы водорода в кислоте замещены металлом. Разумеется, кислые соли могут образовывать только двух- или многоосновные кислоты. Одноосновные кислоты кислых солей давать не могут: NaHCO3, NaH2PO4 и т. д.
3. Основные соли можно рассматривать как продукты неполного, или частичного, замещения гидроксильных групп оснований кислотными остатками: Аl(OH)SO4 , Zn(OH)Cl и т.д.
По числу присутствующих в структуре катионов и анионов выделяют следующие типы солей.
Простые соли — соли, состоящие из одного вида катионов и одного вида анионов (NaCl)
Двойные соли — соли, содержащие два различных катиона (KAl(SO4)2·12 H2O).
Смешанные соли — соли, в составе которых присутствует два различных аниона (Ca(OCl)Cl).
Также различают гидратные соли (кристаллогидраты), в состав которых входят молекулы кристаллизационной воды, например,Na2SO4·10 H2O, и комплексные соли, содержащие комплексный катион или комплексный анион (K4[Fe(CN)6], Cu(NH3)4](OH)2
По международной номенклатуре название соли каждой кислоты происходит от латинского названия элемента. Например, соли серной кислоты называются сульфатами: СаSO4 – сульфат кальция, Mg SO4 – сульфат магния и т.д.; соли соляной кислоты называются хлоридами: NaCl – хлорид натрия, ZnCI2 – хлорид цинка и т.д.
В название солей двухосновных кислот добавляют частицу «би» или «гидро»: Mg(HCl3)2 – бикарбонат или гидрокарбонат магния.
При условии, что в трехосновной кислоте замещён на металл только один атом водорода, то добавляют приставку «дигидро»: NaH2PO4 – дигидрофосфат натрия.
Соли – это твёрдые вещества, обладающие самой различной растворимостью в воде.
Способы получения солей
Взаимодействие металла с кислотой.
Zn + 2HCl = ZnCl2 + H2
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
Взаимодействие основного оксида с кислотой
CaO + 2HCl = CaCl2 + 2H2O
FeO + H2SO4 = FeSO4 + H2O
Взаимодействие основания с кислотой (реакция нейтрализации).
Ba(OH)2 + 2HCl = BaCl2 + 2H2O
2NaOH + H2SO4 = Na2SO4 + H2O
При неполной нейтрализации кислоты основанием образуется кислая соль:
H2SO4 + NaOH = NaHSO4 + H2O
Взаимодействие соли с кислотой. В этом случаи образуется новая кислота и новая соль. Для осуществления этой реакции необходимо, что бы взятая кислота была сильнее образующейся или менее летучей.
2NaCl + H2So4 = Na2SO4 + 2HCl↑
Действием избытка кислоты на средние соли многоосновных кислот получают кислые соли:
Na2SO4 + H2SO4 = 2NaHSO4
CaCO3 + CO2 + H2O = Ca(HCO3)2
Взаимодействие основного оксида с кислотным оксидом.
CaО + SiО2 = CaSiO3
Взаимодействие основания с кислотным оксидом
6NaOH + P2O5 = 2Na3PO4 + 3H2O
Взаимодействие соли с кислотным оксидом. Вступающий в реакцию кислотный оксид должен быть менее летуч, чем образующийся после реакции.
CaCO3 + SiO2 =t CaSiO3 + CO2 ↑
Взаимодействие соли с основанием. Этим способом можно получить как средние соли, так и, при недостатке основания, основные соли. Кислые соли, взаимодействуют с основанием, переходят в средние:
Fe(NO3)3 + 3NaOH = 3NaNo3 + Fe(OH)3 ↓
ZnCl2 + KOH = ZnOHCl + KCl
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3 + 2H2O
Взаимодействие между двумя солями. Образуются две новые соли. Реакция протекает до конца лишь в том случае, если одна из образующихся солей выпадает в осадок:
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
AgNO3 + KJ = AgI↓ + KNO3
Взаимодействие между металлом и солью. Вступивший в реакцию металл должен находится в ряду напряжения металлов левее металла, входящего в состав исходной соли.
Fe + CuSO4 = FeSO4 + Cu
Взаимодействие металла с неметаллом
2Fe + 3Cl2 = 2FeCl3
Взаимодействие металла со щелочью.
Zn
+ 2NaOHкр
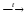 Na2ZnO2
+ H2
↑
Na2ZnO2
+ H2
↑
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2 ↑
Взаимодействие металла со щелочью
Cl2 + 2KOH = KCl + KClO + H2O
Взаимодействие неметалла с солью.
Cl2 + KJ = 2KCl + J2
Термическое разложение солей.
2KNO3
 2KNO2
+ O2↑
2KNO2
+ O2↑
2KClO3
 2KCl + 3O2↑
2KCl + 3O2↑
Химические свойства солей
Химические свойства солей определяются свойствами катионов и анионов, которые входят в их состав.
1. Некоторые соли разлагаются при прокаливании:
CaCO3 = CaO + CO2↑
2. Взаимодействуют с кислотами с образованием новой соли и новой кислоты. Для осуществление этой реакции необходимо, чтобы кислота была более сильная чем соль, на которую воздействует кислота:
2NaCl + H2 SO4 → Na2SO4 + 2HCl↑.
3. Взаимодействуют с основаниями, образуя новую соль и новое основание:
Ba(OH)2 + Mg SO4 → BaSO4↓ + Mg(OH)2.
4. Взаимодействуют друг с другом с образованием новых солей:
NaCl + AgNO3 → AgCl + NaNO3 .
5. Взаимодействуют с металлами, которые стоят в раду активности до металла, который входит в состав соли:
Fe + CuSO4 → FeSO4 + Cu↓.
