
- •1.Основные понятия в химии: вещество, молекула, атом. Строение атома. Химический элемент. Изотопы. Атомная единица массы. Число Авогадро. Моль.
- •3.Понятие эквивалента вещества. Определение эквивалента. Определение эквивалентной массы кислот, оснований, солей, оксидов, простых веществ в овр. Закон эквивалентов. Объемный анализ.
- •5.Принципы и правила заполнения орбиталей. Принцип минимальной энергии. Принцип запрета Паули. Правило Хунда. Правило Клечковского.
- •6. Периодический закон и периодическая система
- •8. Ионная, металлическая, водородная связи. Влияние водородной связи на физико-химические свойства веществ.
- •9.Классификация неорганических соединений
- •10. Соли, их классификация, номенклатура, получение, химические свойства.
- •11.Скорость химической реакции. Гомогенные и гетерогенные реакции. Кинетическое уравнение реакции. Период полупревращения.
- •12.Влияние температуры на скорость реакции. Правило Вант-Гоффа. Энергия активации. Уравнение Аррениуса. Эндотермические и экзотермические реакции
- •13. Кинетика обратимых реакций. Химическое равновесие, выражение для константы равновесия, сдвиг химического равновесия. Принцип ле Шателье
- •14.Гомогенный и гетерогенный катализ, цели применения катализаторов. Ферментативный катализ и его особенности.
- •15. Тепловой эффект реакции. Первый закон термодинамики. Понятие энтальпии. Закон Гесса. Калорийность пищи.
- •16.Энтропия. Второй закон термодинамики. (постулат Планта): Энергия Гиббса.
- •18. Ионное произведение воды. Водородный и гидроксильный показатель (pH и pOh). Индикаторы. Расчет pH растворов слабых электролитов. Буферные растворы, расчет pH буферных систем.
- •19. Гидролиз солей. Степень и константа гидролиза. Расчет рН растворов солей, образованных слабой кислотой и сильным основанием, сильной кислотой и слабым основанием.
- •20 .Овр. Основные понятия. Метод электронного баланса. Метод полуреакций. Классификация овр.
- •21. Перманганатомерия; иодометрия: определение концентрации н2о2 и активного хлора в хлорной извести. Эквивалент в овр.
- •23.Коллигативные свойства, законы Рауля, закон Вант-Гоффа
- •24 . Комплексные соединения, классификация, структура, номенклатура. Химическая связь в кс.
- •25.Протеолитическая теория кислот и оснований.
- •26.Протолитический баланс.
- •27.Биогенные элементы- элементы ответственные за построение и жизнедеятельность клеток организма.
- •29Азот, его свойства. Аммиак. Кислородные соединения азота. Круговорот азота в природе.
- •30.Фосфор,его содинения
- •32.Кислород его свойства. Озон. Пероксид водорода его свойства. Круговорот кислорода в природе.
- •33.Сера
- •38. Сорбция и её виды: абсорбция, адсорбция. Коэффициент абсорбции. Удельная адсорбция. Уравнение Ленгмюра, его линейная аппроксимация.
- •39. Дисперсная система. Их классификация. Мицелла.
3.Понятие эквивалента вещества. Определение эквивалента. Определение эквивалентной массы кислот, оснований, солей, оксидов, простых веществ в овр. Закон эквивалентов. Объемный анализ.
Эквивалент- количество вещества, которое входе реакции присоединяет, замещает, выделяет 1 моль (атомов) ионов водорода. В ОВР под эквивалентом понимают такое количество вещества, которое отдает или присоединяет 1 моль элементов.
Молярная концентрация(С)-отношение количества растворенного вещества, к общему раствора.
С=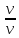 моль/л или М
моль/л или М
Нормальная
концентрация(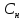 )-
отношение числа эквивалента вещества
к объему раствора.
)-
отношение числа эквивалента вещества
к объему раствора.
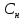 =
=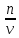 экв/л или Н
экв/л или Н
Связь нормальной и
молярной концентрации С= F*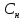 (С
(С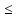
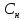 )
)
Эквивалентная масса(Э)-масса одного эквивалента вещества, выраженная в граммах. Э гр/экв
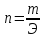
Расчет эквивалентных масс для соединений различных классов.
1 Оксиды- молярную массу вещества делят на число атомов элемента в оксиде, умноженное на его степень окисления.
Э(CuO)=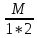 =
=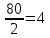 гр/экв (ν=
гр/экв (ν=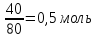 )
)
CuO
+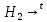 Cu +
Cu +
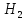 O
O
2 моль H → 1 моль CuO
1 моль H → 0,5 моль CuO
 + 3
+ 3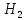 → 2Fe + 3
→ 2Fe + 3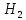 O
O
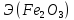 =
=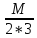 =
=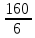 =27
г/экв
=27
г/экв
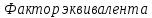 -концентрация,
на которую надо умножить массу при
расчете эквивалентной массы.
-концентрация,
на которую надо умножить массу при
расчете эквивалентной массы.
f (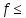
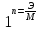 ) f =
) f =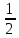
2 Кислоты - молярную массу делят на число атомов водорода, замещенных в молекуле кислоты входе реакции.
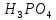 + 3NaOH
+ 3NaOH
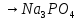 +3
+3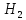 O
O
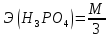 =
=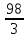 = 33 г/экв f =
= 33 г/экв f =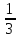
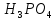 +
2NaOH
+
2NaOH
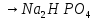 + 2
+ 2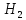 O
O
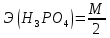 =
=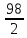 = 49 г/экв f =
= 49 г/экв f =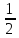
Для одноосновных кислот молярная масса и эквивалент равны .
3 Основания( щелочи ) – молярную массу делят на число гидроксильных групп, замещаемых в молекуле основания входе реакции.
 +
+
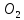 → 2NO
→ 2NO
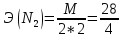 = 7 г/экв f =
= 7 г/экв f =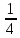
4 Соли- молярную массу делят на число атомов металла ,умноженных на его валентность.
Закон эквивалентов- в химических реакциях вещества реагируют и образуются в количествах, равных эквивалентам ( сколько эквивалентов в-ва расходовано, столько же эквивалентов другого в-ва образовалось)
Объемный анализ- является одним из методов количественного анализа. Сущность метода заключается в измерении объема раствора реактива известной концентрации, затраченного на реакцию. При анализе раствор реактива, концентрация которого известна, из калиброванного по объему сосуда (бюретки) по каплям приливают к исследуемому раствору до тех пор, пока тем или иным способом не будет установлено, что все вещество в исследуемом растворе прореагировало с добавляемым реактивом. Эта процедура называется титрование
4.Электронное строение атомов. Корпускулярно-волновой дуализм электронов. Атомная орбиталь. Энергетические уровни и подуровни. Квантовые числа, их физический смысл.
Электронное строение атома.
В атоме, с точки зрения механики, электрон рассматривается одновременно и как частица(имеет массу и заряд) и как волна(явление дифракции)или как говорят, обладает корпускулярно-волновым дуолизмом.
Область околоядерного пространства, в котором наиболее вероятно нахождение электрона -атомная орбиталь .В этой области как бы «размазан» заряд электронов.
Электроны с приблизительно равной энергией, находящиеся приблизительно на одинаковом расстоянии от ядра, образуют электронный слой(энергетический уровень). В пределах одного энергетического уровня электроны могут незначительно различаться по энергии, располагаясь на различных энергетических подуровнях.
Движение электронов в атоме описывается волновым уравнением Шредингера, решение которой- волновая функция пси (Ψ)- может быть отображено набором целых чисел, называемых квантовыми числами.
Главное квантовое число (n)-принимает значение натуральных чисел, показывает на каком энергетическом уровне от ядра расположен электрон.
Орбитальное(побочное) квантовое число(l)-зависит от n, принимая значения от 0 до n-1 включительно. Показывает на каком энергетическом подуровне находится электрон, определяет форму орбитали электрона. Число значений l для данного n показывает число подуровней на данном энергетическом уровне.
Числовым значениям l поставлено в соответствии буквенное обозначение.
|
Главное значение l |
0 |
1 |
2 |
3 |
|
Буквенное обозначение |
s |
p |
d |
f |
|
Форма орбитали |
|
|
|
|
|
Число орбиталей на подуровне |
1 |
3 |
5 |
7 |
|
Максимальное число электронов на подуровне |
2 |
6 |
10 |
14 |
Электронное строение атомов всех хим. элементов описывается четырьмя видами орбиталей: s, p, d, f. Электроны, располагающиеся на s подуровне- s электроны, и т. д
Магнитное квантовое
число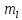 зависит от l, принимает целые значения
от –l…., 0….,+l. Определяет взаимную
ориентацию орбиталей. Число значений
зависит от l, принимает целые значения
от –l…., 0….,+l. Определяет взаимную
ориентацию орбиталей. Число значений
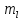 определяет число орбиталей на данном
подуровне.
определяет число орбиталей на данном
подуровне.
Для полного описания электрона в атоме потребовалось ввести четвертое квантовое число-
Спиновое квантовое
число
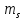 которое принимает 2 значения ±0,5. В
приближенной форме можно сказать, что
которое принимает 2 значения ±0,5. В
приближенной форме можно сказать, что
 отражает возможность вращения электрона
вокруг своей оси как по часовой стрелке,
так и против нее.
отражает возможность вращения электрона
вокруг своей оси как по часовой стрелке,
так и против нее.

