
- •2)Згорання палива
- •1. Електричне поле
- •2.Напруженість поля.
- •1. Струм
- •2. Сила струму.
- •3.Опір провідників та залежність його від температур.
- •4. Закон Ома.
- •5. Джерело струму. Електрорушійна сила.
- •6. Робота та потужність постійного струму.
- •1.Магнітне поле.
- •2. Взаємодія струмів.
- •3.Закон Ампера.
- •4.Закон Біо – Савара – Лапласа.
- •5.Сила Лоренца.
- •1. Досліди Фарадея.
- •2. Закон Фарадея.
- •3. Явище електромагнітної індукції.
- •1. Електромагнітні хвилі та їх властивості.
- •2. Закони геометричної оптики.
- •2. Дифракція
- •3. Дисперсія.
- •1. Квантова оптика
- •2. Фотоефект
- •3. Енергія фотона рівняння Планка
- •4. Рівняння Ейнштейна. Маса, імпульс фотона.
- •5. Фотосинтез та його роль в с.-г.
Модуль 3 Термодинаміка.
Лекція Внутрішня енергія системи.
План:
1.Внутрішня енергія тіл
2.Внутрішня енергія ідеального газу. Число ступеня свободи.
3.Способи зміни внутрішньо енергії тіла.
4.Види теплопередачі . Теплоємність. Рівняння Маєра
5.Робота в термодинаміці. Фізичний зміст універсальної газової сталоії.
6.Перший закон термодинаміки
7.Другий закон термодинаміки
8.Третій закон термодинаміки
9.Перший закон термодинаміки в ізопроцесі.
10.Робота теплових двигунів
11.Цикл Карно
12.ККД теплових двигунів
13.Реальні гази рівняння Ван-дер-Вальса
1.Внутрішньою енергією тіл називається сума кінетичних енергій руху та потенційних енергій взаємодій частинок із яких складаються тіла (всі тіла в природі мають внутрішню енергію) :
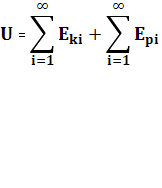
2. Внутрішня енергії
ідеального газу: ![]()
і- ступінь молекул свободи руху молекул в просторі
а)Одноатомний газ i=3; б)Двоатомний газ і=5; В)Трьохатомний і=7
3)Зміна внутрішньої
енергії
![]()
![]()
3. Існує два способи зміни внутрішньої енергії:
1)Теплопередача
2)Виконання роботи системою або над системою
4.Види теплопередачі. Теплоємність. Теплопередача.
Теплопередача-це процес передачі кількості теплоти в результаті теплообміну двох, або декілька тіл.
Види теплопередачі:
1)Нагрівання, Охолодження
![]()
с- питома теплоємність
Q1·-кількість теплоти в Дж
Питома
теплоємність-це кількість теплоти яку
необхідно передати системі масою 1кг,що
нагріти 1К.
![]()
![]() -
Питома теплоємність
-
Питома теплоємність
![]()
Теплоємність -
це кількість теплоти яка передається
системі щоб змінити її температуру на
1К .![]()
![]()
С= с![]() -
молярна теплоємність
-
молярна теплоємність
Теплоємність при ізотермічному процесі Ст
Ст. -(Т=const)
Теплоємність при
ізохорному Сv
![]()
![]()
![]()
Сv-(V=const)
Сv=![]()
Теплоємність при ізобарному процесі Сp
Cp-(P=const)
Cp=![]()
Де: i-це ступінь вільності молекул
Рівняння Маєра
Ср =Сv+R
б) Плавління і кристалізація
![]()
![]() питома
теплота плавління
питома
теплота плавління
Одиниця вимірювання
![]() =
Дж /кг
=
Дж /кг
Питома теплота плавління і температура плавління і кристалізація для кожної конкретної речовини однакова.
в)Пароутворення і конденсація
Q=![]()
L- це питома теплота
пароутворення Дж /кг
![]()
Кожна речовин має свою температуру кипіння і береться із таблиці
2)Згорання палива
Q=q![]()
Q- питома теплота згорання палива
![]()
5.Робота в термодинаміці
A=F![]() тиску(h1-h2)
тиску(h1-h2)
P=![]()
![]() Fтиску=
ρ
Fтиску=
ρ![]()
A=p![]() (h1-h2)
(h1-h2)
A=p![]()
A=-pDV![]()
A=-p![]() – робота в термодинаміці.
– робота в термодинаміці.
“-“ ставиться коли А виконується над системою
“+” самою системою
6.Перший закон термодинаміки
![]()
dU=dA+dQ
Змінна внутрішня енергія системи відбувається завдяки виконання роботи над системою або системою і теплопередачею.
Перший закон термодинаміки в ізопроцесі
A=-p![]()
![]() DT
DT
1. Ізотермічний процес
Tconst
![]() =
=![]()
![]() =0
=0
![]()
A=Q
Система виконує роботу в результаті теплопередачі
2.Ізобарний процес
P=const
![]() =
=![]()
![]()
![]()
3.Ізохорний процес
V=const
![]() =
=![]()
![]()
A=0
![]()
Зміна внутрішньої енергії системи відбувається завдяки теплопередачі
4.Адіабатичний процес
Q=0
![]()
Система може виконувати роботу завдяки зміні внутрішньо енергії
Висновок: неможливо зробити вічний двигун первинного роду
Другий закон термодинаміки:
Теплові процеси в природі не обернені. Гаряче тіло може передавати енергію холодному тілу, а оберненому процесу не існує.
Третій закон термодинаміки
Третій закон термодинаміки неможливо досягти абсолютного 0 температури так як неможливо повністю зупинити рух частинок з яких складається тіло.
Теплові двигуни
Q1=A+![]()
Нагріте тіло Q1
Робоче тіло A=Q1-Q2
Холодильник Q2
Нагрівач -![]() -
кількість теплоти нагрівача
-
кількість теплоти нагрівача
Робоче тіло –
A=![]() -
-![]() корисна робоча тепло
корисна робоча тепло
Холодильник
![]() -кількість
теплоти холодильника
-кількість
теплоти холодильника
Робота теплової машини основна на першому законі термодинаміки .Кількість теплоти яка виділяється при згоранні палива йде на виконання робочого ходу теплової машини і на зміну внутрішньої енергії
системи.
Для того щоб тепловий двигун міг виконувати поставлену задачу в кінці кожного процесу повинна спрацювати система охолодження яка забере енергію що пішла на нагрівання системи, для того щоб перевести в початковий стан .
Цикл Карно для опису роботи ідеальної теплової машини .
 1-1'
ізометричне розширення
1-1'
ізометричне розширення
1'–2 адіабатичне розширення
2- 2' ізометричне стискання
2'-1 адіабатичне стискання
ККД теплового двигуна
ККД=![]() ККД=
ККД=![]()
Реальні гази .Рівняння Ван-дер-Вальса
В реальних газах частинки газу мають розміри і взаємодіють між собою
PV=![]() RT-рівняння
Менделєєва
RT-рівняння
Менделєєва
Рівняння Ван –дер –Вальса
![]()
a i b сталі Ван-дер-Вальса які враховують відповідні розміри молекули газу та ступінь взаємодії. Для ложного виду реального газу ці сталі і їх можна взяти для кожного виду газу і їх можна взяти постійні рівняння Ван-дер-Вальса.
Модуль 4. Електричний струм.
Лекція. Електростатика
План: 1.Електричне поле.
2. Напруженість поля.
3. Робота. Потенціал.
4. Напруга.
5. Електроємність.
6. Конденсатори та їх з’єднання.
7. Енергія електричного поля.
8. Діелектрична проникність.
