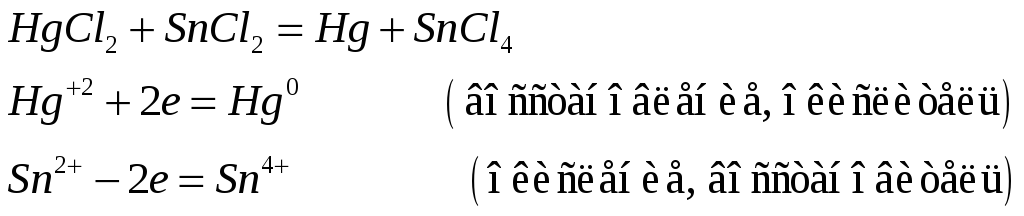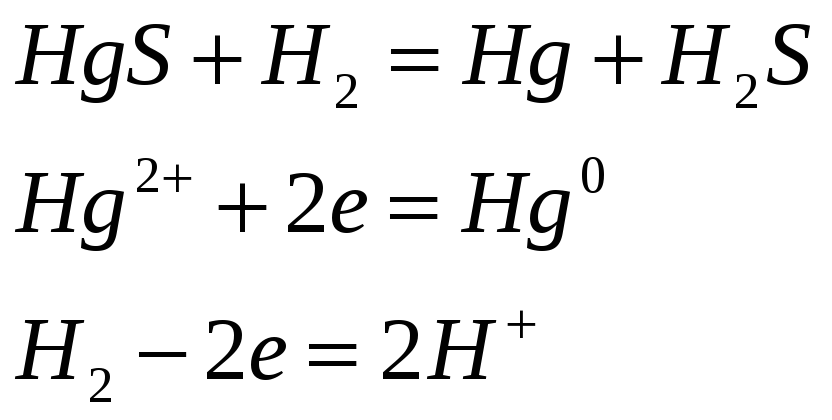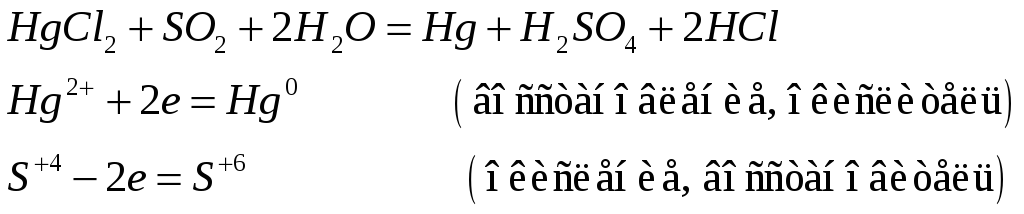- •Звездочкой обозначены разрыхляющие молекулярные орбитали. Для молекулы f2:
- •Таким образом, более высокая энергия связи объясняется более высоким её порядком.
- •Звездочкой обозначены разрыхляющие молекулярные орбитали. Для молекулы о2:
- •Таким образом, более высокая энергия связи объясняется более высоким её порядком.
- •Звездочкой обозначены разрыхляющие молекулярные орбитали. Для молекулы о2:
- •Восстановительные свойства могут проявлять катионы ванадия и хрома, так как они находятся в промежуточной степени окисления
- •Чем отличается взаимодействие германия и свинца с концентрированной азотной кислотой? Почему? Составьте электронные и молекулярные уравнения реакций:
- •Составьте электронные и молекулярные уравнения реакций:
- •Составьте электронные и молекулярные уравнения реакций:
- •Кислород в перекиси водорода имеет промежуточную степень окисления –1.
- •Вследствие несимметричности распределения связей о – н, Ме – о молекулы пероксидов сильно полярны. Пероксид – радикал может, не изменяясь переходить из соединения в соединение:
- •Закончите уравнения реакций:
- •Приведенные реакции относятся к реакциям внутримолекулярного окисления-восстановления.
- •Сера способна как окислятся, так и восстанавливаться, ввиду того, что нулевая степень окисления является промежуточной.
Закончите уравнения реакций:
![]()
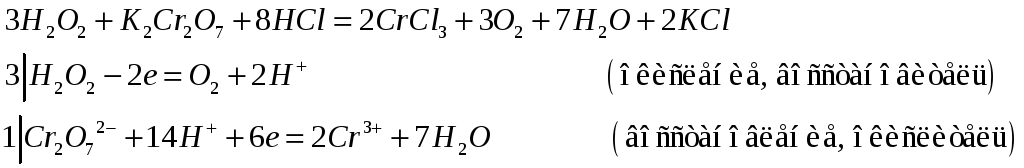
464
BaO2 + 2H2O = Ba(OH)2 + H2O2
O3 + SO2 → SO3 + O2
H2O2 + 2H+ + 2e = 2H2O / 1
2I- - 2e = I2 / 1
H2O2 + MgI2 + H2SO4 → MgSO4 + I2 + 2H2O
466
Cl5+ + 6e = Cl- / 2
2O2- - 4e = O2 / 3
2KClO3 → 2KCl + 3O2
Mn7+ + e = Mn6+ / 4 / 1
Mn7+ + 3e = Mn4+ / 4 / 1
2O2- - 4e = O2 / 4 / 1
2KMnO4 = K2MnO4 + MnO2 + O2
Cr6+ + 3e = Cr3+ / 4
2O2- - 4e = O2 / 3
2K2Cr2O7 = 4KCrO2 + 3O2
Приведенные реакции относятся к реакциям внутримолекулярного окисления-восстановления.
467
Сера способна как окислятся, так и восстанавливаться, ввиду того, что нулевая степень окисления является промежуточной.
2S + 6OH- - 4e → S2O32- + 3H2O / 1
2S + 2e → S22- / 2
6NaOH + 6S → 2Na2S2 + Na2S2O3 + 3H2O
468
а) H2S x = -2 cероводородная
б) Н2S2 x = -1 дисероводородная
в) H2SO2 х = +2 сульфоксиловая
г) H2SO3 x = +4 сернистая
д) H2SO4 x = +6 серная
е) H2S2O7 x = +6 пиросерная
469
H – O O
\ //
S
/ \\
H – S O
То есть центральный атом серы имеет степень окисления +6, а второй атом серы имеет степень окисления –2.
S2+ - 4e = S6+ / 2
Cl2 + 2e = 2Cl- / 4
Na2S2O3 + 4Cl2 + 5H2O → Na2SO4 +8HCl + H2SO4
470
Оксид селена (окислитель) легче восстанавливается, чем сернистый газ.
2SO2 + SeO2 → Se + 2SO3
Окислительные свойства р-элементов в периоде возрастают и хлор более сильный окислитель, чем сера.
S + 3Cl2 + 4H2O → H2SO4 + 6HCl
Сероводород может быть только восстановителем, так как сера находится в низшей степени окисления.
H2SO3 + 2H2S → 3S + 3H2O
471
Очевидно, в данном случае азотная кислота будет слишком сильным окислителем и выделяющийся сероводород будет окисляться далее до серной кислоты.
S2- + 4H2O - 8e = SO42- + 8H+ / 1
NO3- + 2H+ + e = NO2 + H2O / 8
S2- + 4H2O + 8NO3- + 16H+ = 8NO2 + 8H2O + SO42- + 8H+
S2- + 8NO3- + 8H+ = 8NO2 + 4H2O + SO42-
FeS + 8HNO3 = 8NO2 + 4H2O + FeSO4
№472
При прибавлении
к сахару (![]() )
концентрированной серной кислоты
наблюдается обугливание и выделение
газов. Объясните эти явления, составив
уравнения соответствующих реакций.
)
концентрированной серной кислоты
наблюдается обугливание и выделение
газов. Объясните эти явления, составив
уравнения соответствующих реакций.
Концентрированная серная кислота обугливает органические вещества – сахар, бумагу, дерево, волокна, отнимая от них элементы воды. При этом образуются гидраты серной кислоты. Обугливание сахара можно выразить уравнением:
![]()
Образовавшийся уголь частично вступает во взаимодействие с кислотой:
![]()
№473
Чем можно объяснить восстановительные свойства сероводорода? Составьте электронные и молекулярные уравнения реакций:
А)
![]()
Б)
![]()
В)
![]()
В молекуле сероводорода сера проявляет минимальную степень окисления, поэтому в реакциях является восстановителем.



№ 475
Приведите уравнения реакций, которые следует осуществить, чтобы исходя из элементарных селена и теллура получить селеновую и теллуроводородную кислоты.
![]() селеновая
селеновая
![]()
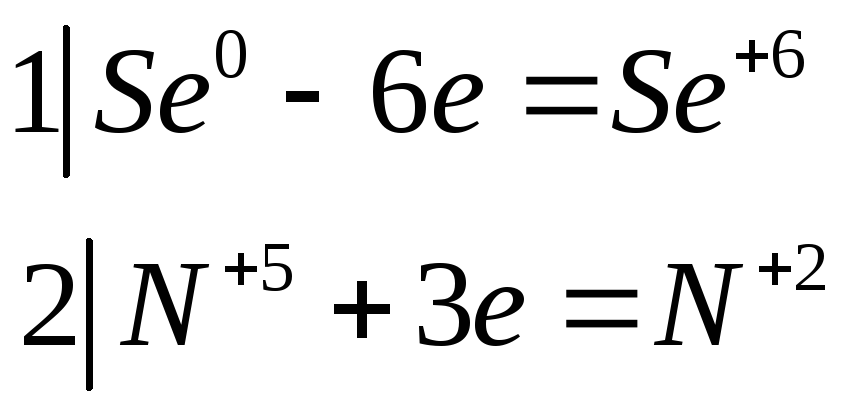
![]() теллуроводородная
теллуроводородная
![]()
476
Сера в сернистой кислоте имеет степень окисления +4, поэтому она может окиасляться до S6+ и восстанавливаться до S2-.
Cr6+ + 3e = Cr3+ / 2
S4+ - 2e = S6+ / 3
3SO3 + K2Cr2O7 + H2SO4 → K2SO4 + Cr2(SO4)3 + H2O
O2 + 4e = 2O2- / 1
S4+ - 2e = S6+ / 2
2K2SO3 + O2 → 2K2SO4
O22- + 2e = 2O2- / 1
S4+ - 2e = S6+ / 1
Na2SO3 +H2O2 → Na2SO4 + H2O
477
S – 4e = S4+ / 2 / 1
S6+ + 2e = S4+ / 4 / 2
S + 2H2SO4 → 2H2O + 3SO2
2Cl- – 2e = Cl2 / 1
Se6+ + 2e = Se4+ / 1
H2SeO4 + 2HCl → Cl2 + H2SeO3 + H2O
Cl5+ + 6e = Cl- / 1
Se4+ - 2e = Se6+ / 3
3H2SeO3 + HClO3 → HCl + 3H2SeO4
№478
Приведите электронные и молекулярные уравнения реакций:
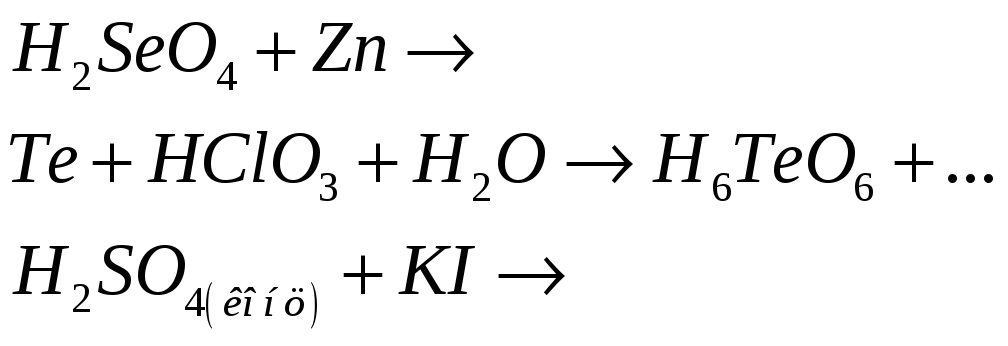
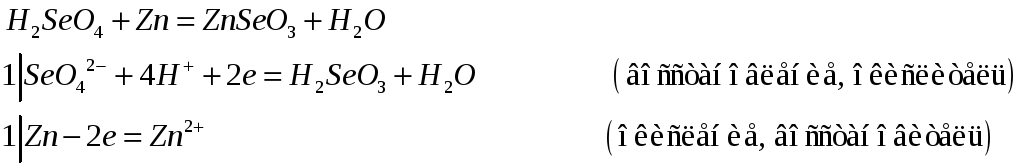

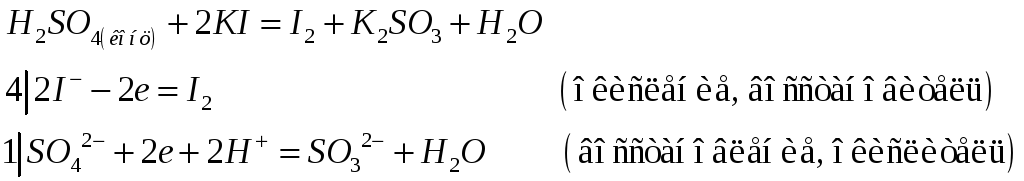
№479
Как изменяются
восстановительные и окислительные
свойства в ряду
![]() ?
Почему? Допишите уравнения реакций:
?
Почему? Допишите уравнения реакций:
![]()
В ряду
![]() уменьшается окислительная и возрастает
восстановительная активность. Это
объясняется увеличением радиусов
атомов.
уменьшается окислительная и возрастает
восстановительная активность. Это
объясняется увеличением радиусов
атомов.


480
Кислотные свойства в указанном ряду осабевают, так как увеличение радиуса атомов ведет к уменьшению энергии ионизации, что характеризует усиление металлических основных свойств.
TeO2 +2 KOH → K2TeO3 + H2O
PoO2 + H2SO4 → PoSO4 + 2H2O
481
Хлор может проявлять степени окисления равные
-1 0 +1 +3 +5 +7
Кислородные соединения хлора получаются при пропускании хлора через растворы щелочей. Например:
2Сa(OH)2 + 2Cl2 → Ca(OCl)2 + CaCl2 + 2H2O
Все подобные процессы являются реакциями диспропорционирования.
В горячем растворе протекает реакция:
6KOH + 3Cl2 → 5KCl + KClO3 + 3H2O
Сl0 + e = Cl- / 5
Сl 0 + 6OH- - 5e = ClO3- + 3H2O / 1
Её можно рассматривать как суммарный процесс двух реакций:
2KOH + Cl2 → KCl + KClO + H2O
3KClO → 2KCl + KClO3 нагревание.
483
Фтороводород получают из плавикового шпата действием концентрированной серной кислоты:
СaF2 + H2SO4 (конц) → 2HF + CaSO4
Плавиковая кислота – довольно слабая, вследствие высокой прочности связи H-F, фтороводород в водных растворах диссоциирует плохо.
Плавиковую кислоту хранят в посуде из полиэтилена или тефлона, так как стекло в ней растворяется:
SiO2 + 6HF → H2[SiF6] + 2H2O
образующаяся кислота хорошо растворима в воде.
486
NH3 + 6OH- – 8e = NO3- + 3H2O + 3H+ / 6 / 3
ClO3- + 3H2O + 6e = Cl- + 6OH- / 8 / 4
3NH3 + 18OH- + 4ClO3- + 12H2O = 4Cl- + 24OH- + 3NO3- + 9H2O + 9H+
3NH3 + 18OH- + 4ClO3- + 12H2O = 4Cl- + 15OH- + 3NO3- + 18H2O
3NH3 + 3OH- + 4ClO3- = 4Cl- + 3NO3- + 6H2O
3NH3 + 4NaClO3 + 3NaOH → 3NaNO3 + 4NaCl + 6H2O
№487
Какие свойства в окислительно-восстановительных реакциях может проявлять бром? Почему? Составьте ионные и молекулярные уравнения реакций брома с горячим раствором соды. К какому типу окислительно-восстановительных реакций она относится?
Бром может проявлять степени окисления от –1 до +7, поэтому в реакциях может играть роль и окислителя и восстановителя.
Реакция брома с горячим раствором соды:
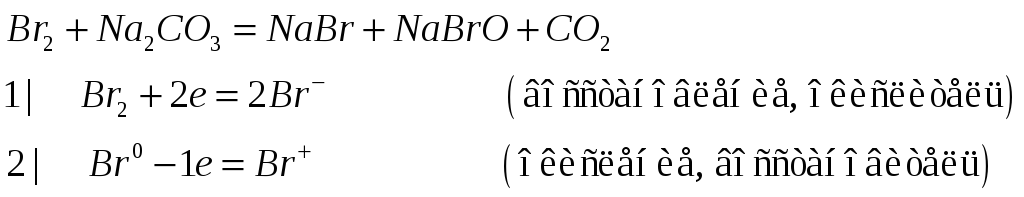
Данная реакция относится к типу реакций диспропорционирования, так как степени окисления меняет один элемент.
488
Йодид калия окисляется до йода
Cl2 + 2KI → I2 + 2KCl
2I- - 2e = I2 / 1
Cl2 + 2e = 2Cl- / 1
Образующийся иод растворяется в растворе иодида калия, придавая ему коричневую окраску.
I2 + KI → KI3
Затем происходит дальнейшее окисление так, что продуктами реакции являются бесцветные вещества.
KI3 + 8Cl2 + 9H2O → 3HIO3 + 15HCl + KCl
I3- - 16e = 3I5+ / 1
Cl2 + 2e = 2Cl- / 8
489
I2 - 10e = 2I5+ / 3
N5+ + 3e = N2+ / 10
3I2 + 10HNO3 → 6HIO3 + 2H2O + 10NO
I2 + 2e = 2I- / 5
I2 - 10e = 2I5+ / 1
3I2 + 6KOH → 5KI + KIO3 + 3H2O
KI + I2 → KI3
I- + I2 = I3-
№ 490
Как получают и какой состав имеет хлорная (белильная) известь? Какими свойствами она обладает? Составьте уравнения реакций разложения хлорной извести под действием: а) оксида углерода (IV); б) соляной кислоты.
Наибольший практический интерес (как отбеливающее средство, средство для дегазации, дешевый окислитель) представляет гипо-хлорит кальция Са(С1О)2. Получается он при взаимодействии хлора с гашеной известью:
2Са(ОН)2 + С1а = Са(С10)2 + СаС12 + 2Н2О
Как видно из приведенного уравнения реакции, одновременно с Са(С1О)2 образуется СаС12. Поэтому получаемый в технике продукт — белильная или хлорная известь — можно рассматривать как смешанное соединение Са(С1О)С1, т. е. гипохлорит — хлорид кальция.
а)
![]()
б)
![]()
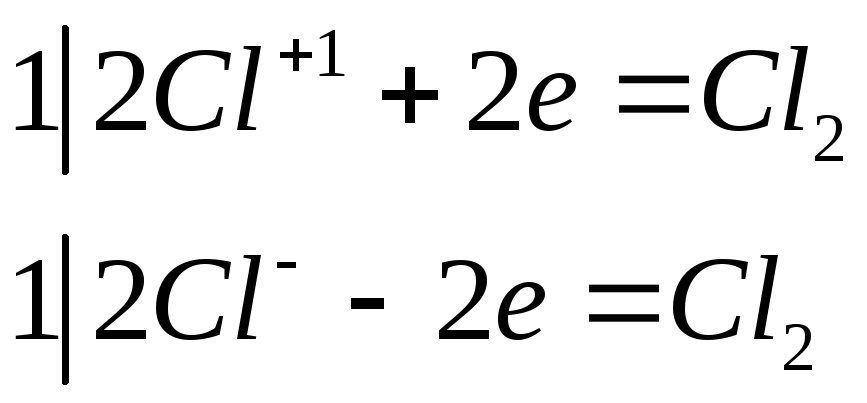
491
Окислительные свойства р-элементов в группе с увеличением номера ослабевают.
5Сl2 + I2 + 6H2O → 10HCl + 2HIO3
Йодоводород может быть только восстановителем, так как Йод в этом соединении находится в минимальной степени окисления -1.
5HI + HIO3 → 3I2 + 3H2O
Хлорная кислота - сильнейший окислитель, хлор имеет максимальную валентность +7.
HClO4 + 2C → 2CO2 + HCl
492
2NH4ClO4 + 4C → 4CO + N2 + Cl2 + 4H2O
2N3- - 6e = N2 / 1
2Cl7+ + 14e = Cl2 / 1
C – 2e = C2+ / 4
№493
Фтор очень сильный окислитель. Почему? В атмосфере фтора горят многие вещества. Закончите уравнения реакций:
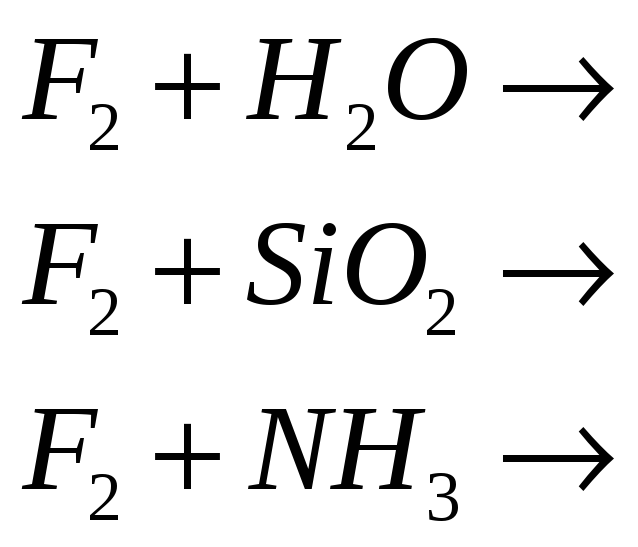
Высокая
химическая активность фтора объясняется
тем, что его молекула имеет низкую
энергию диссоциации (159кДж/моль), в то
время как химическая связь в большинстве
соединений фтора отличается большой
прочностью (порядка 200-600 кДж/моль). Кроме
того, энергия активации реакций с
участием атомов фтора низка
![]() .
.



№495
Составьте электронно-ионные, ионно-молекулярные и молекулярные уравнения реакций:
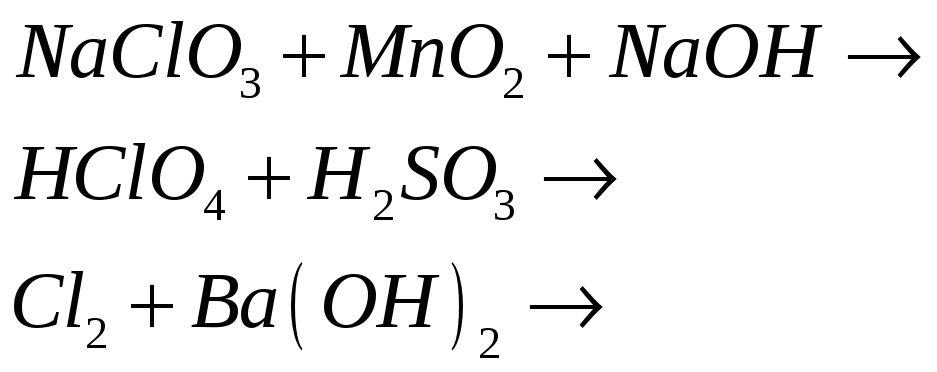

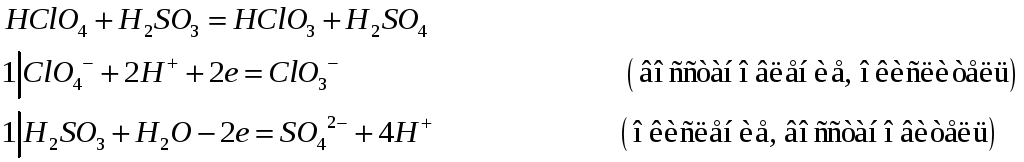
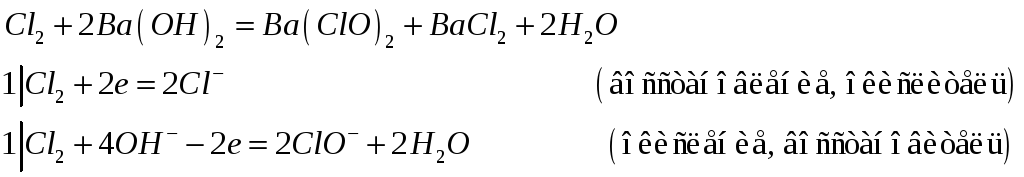
№496
При взаимодействии
![]() с разбавленными
с разбавленными
![]() и
и
![]() выделяется водород. Чем это объяснить?
Составьте электронные и молекулярные
уравнения этих реакций, учитывая, что
раствор приобретает фиолетовый цвет.
выделяется водород. Чем это объяснить?
Составьте электронные и молекулярные
уравнения этих реакций, учитывая, что
раствор приобретает фиолетовый цвет.
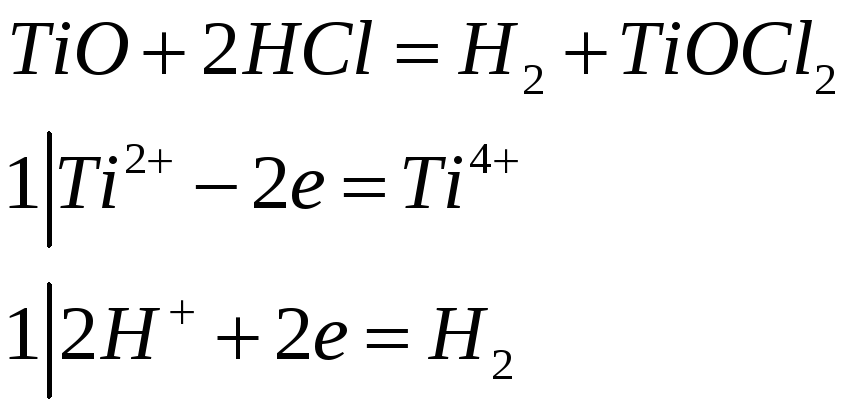

497
4Ti(OH)2 + O2 + 2H2O → 4Ti(OH)3 фиолетовый, в смеси с черным
Ti2+ - e = Ti3+ / 4 Ti(OH)2 кажется коричневым.
O2 + 4e = 2O2- / 1
4Ti(OH)3 + O2 + 2H2O → 4Ti(OH)4 Белый.
Ti3+ - e = Ti4+ / 4
O2 + 4e = 2O2- / 1
Или:
2Ti(OH)3 + O2 + 2H2O → 2Ti(OH)4 + H2O2
Ti3+ - e = Ti4+ / 2
O2 + 2e = O22- / 1
498
2TiO2 + 4C + N2 → 2TiN + 4CO
Ti4+ + e = Ti3+ / 2
C – 2e = C2+ / 1
По этому методу получают очень чистый нитрид титана, но для проведения реакции требуется температура 12500.
500
3TiCl4 + 4NH3 → Ti3N4 + 12HCl
3ZrCl4 + 4NH3 → Zr3N4 + 12HCl
Реакции протекают при нагревании. В обычных условиях равновесие сдвинуто в обратную сторону.
№502
Напишите уравнения реакций:
А) прокаливание титана на воздухе;
Б) растворение диоксида титана в концентрированной серной кислоте;
В) сплавление диоксида титана со щелочью.
В реакции (б) наряду с сульфатом титана образуется сульфат титанила.
А) прокаливание титана на воздухе
![]()
Б) растворение диоксида титана в концентрированной серной кислоте
![]()
В) сплавление диоксида титана со щелочью
![]()
№ 505
Хлорид циркония (IV) обычно получают прокаливанием смеси ZnO2 с углем в атмосфере хлора. Составьте электронные и молекулярное уравнения этой реакции. Почему при растворении полученного продукта раствор приобретает кислую реакцию?
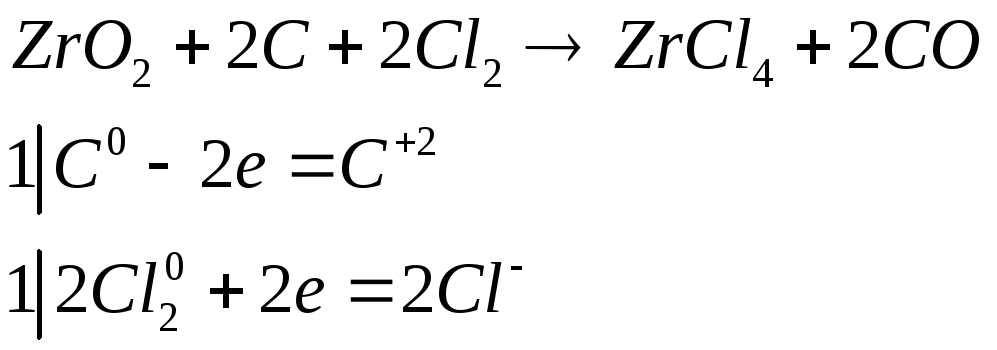
При растворении происходит гидролиз
![]()
присутствие сильной кислоты, диссоциированной на ионы обуславливает кислую реакцию раствора.
№502
Напишите уравнения реакций:
А) прокаливание титана на воздухе;
Б) растворение диоксида титана в концентрированной серной кислоте;
В) сплавление диоксида титана со щелочью.
В реакции (б) наряду с сульфатом титана образуется сульфат титанила.
А) прокаливание титана на воздухе
![]()
Б) растворение диоксида титана в концентрированной серной кислоте
![]()
В) сплавление диоксида титана со щелочью
![]()
№ 505
Хлорид циркония (IV) обычно получают прокаливанием смеси ZnO2 с углем в атмосфере хлора. Составьте электронные и молекулярное уравнения этой реакции. Почему при растворении полученного продукта раствор приобретает кислую реакцию?
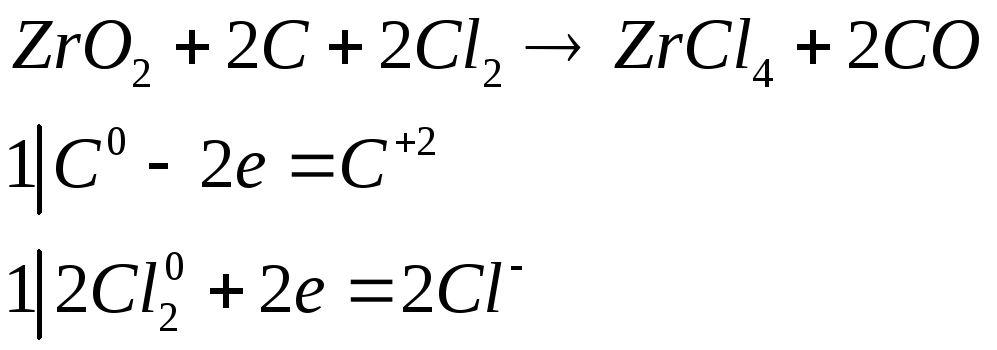
При растворении происходит гидролиз
![]()
присутствие сильной кислоты, диссоциированной на ионы обуславливает кислую реакцию раствора.
№508
Титан, цирконий и гафний растворяются в кислотах, если при этом образуются устойчивые анионные комплексы, содержащие эти металлы в степени окисления +4. Составьте электронные и молекулярные уравнения реакций:
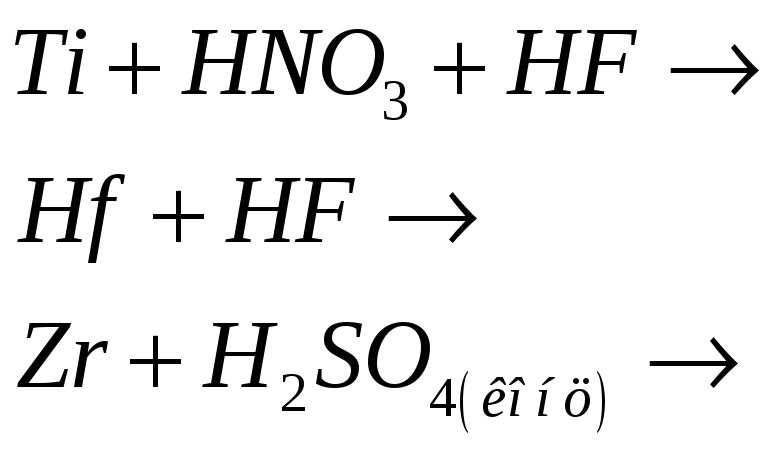
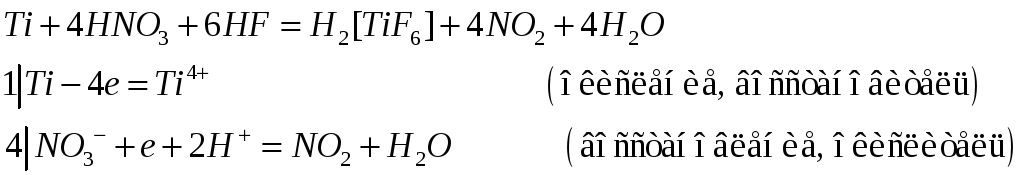

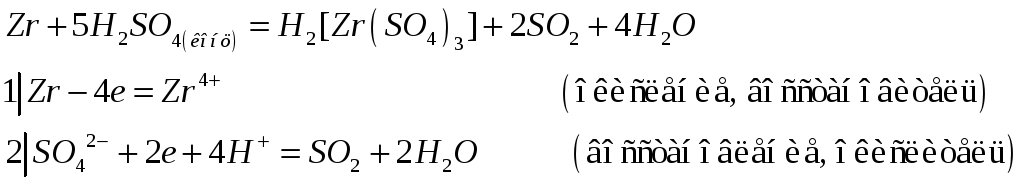
№509
Какая степень окисления наиболее характерна для титана? Составьте электронные и молекулярные уравнения реакций:
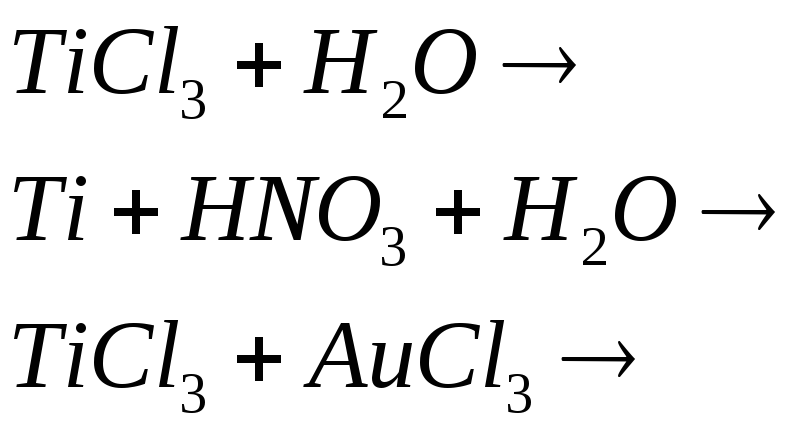
![]()
![]() (окисление, восстановитель)
(окисление, восстановитель)
![]() (восстановление,
окислитель)
(восстановление,
окислитель)
![]()
![]() (окисление,
восстановитель)
(окисление,
восстановитель)
![]() (восстановление,
окислитель)
(восстановление,
окислитель)
![]()
![]() (восстановление, окислитель)
(восстановление, окислитель)
![]() (окисление, восстановитель)
(окисление, восстановитель)
№512
К синему
раствору сульфата ванадия
![]() прибавили немного щелочи. Образовавшийся
розовый осадок гидроксида ванадила
поместили в две пробирки, в первую из
которых добавили раствор щелочи, а во
вторую – соляную кислоту. Осадки в обеих
пробирках растворились. Какой цвет
приобрели растворы в каждой из этих
пробирок? Напишите молекулярные и
ионно-молекулярные уравнения всех
осуществленных реакций.
прибавили немного щелочи. Образовавшийся
розовый осадок гидроксида ванадила
поместили в две пробирки, в первую из
которых добавили раствор щелочи, а во
вторую – соляную кислоту. Осадки в обеих
пробирках растворились. Какой цвет
приобрели растворы в каждой из этих
пробирок? Напишите молекулярные и
ионно-молекулярные уравнения всех
осуществленных реакций.
1)реакция сульфата ванадия со щелочью. Образуется раствор светло-синего цвета.
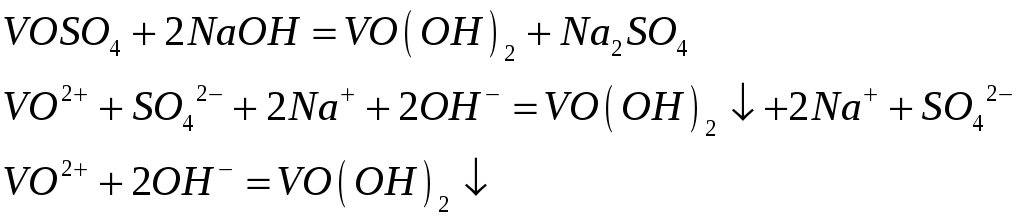
2)растворение гидроксида ванадила в соляной кислоте. Образуется оксохлорид ванадия (дихлорид ванадила). Образуется раствор синего цвета.
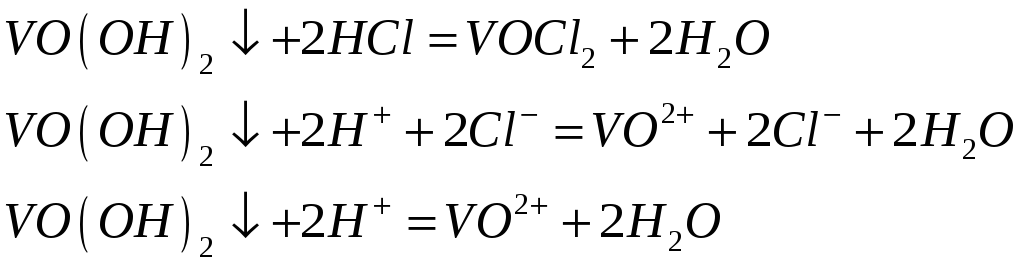
3)растворение гидроксида ванадила в щелочи. Образуется оксованадат бурого цвета.
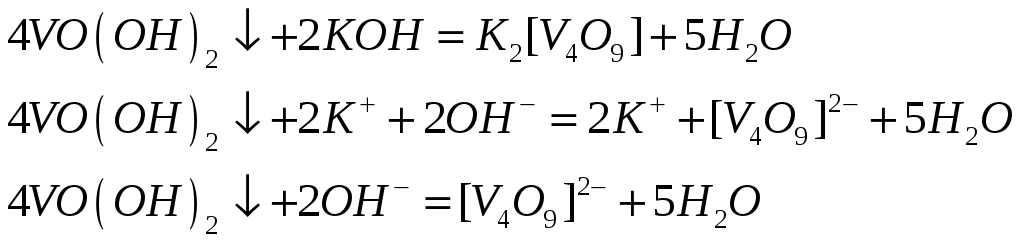
№517
Устойчивые
по отношению к минеральным кислотам
ниобий и тантал хорошо растворяются в
смеси
![]() ,
а также в концентрированных растворах
щелочей в присутствии окислителей. На
основании электронных уравнений
закончите уравнения реакций:
,
а также в концентрированных растворах
щелочей в присутствии окислителей. На
основании электронных уравнений
закончите уравнения реакций:
![]()


№520
Допишите уравнения реакций:
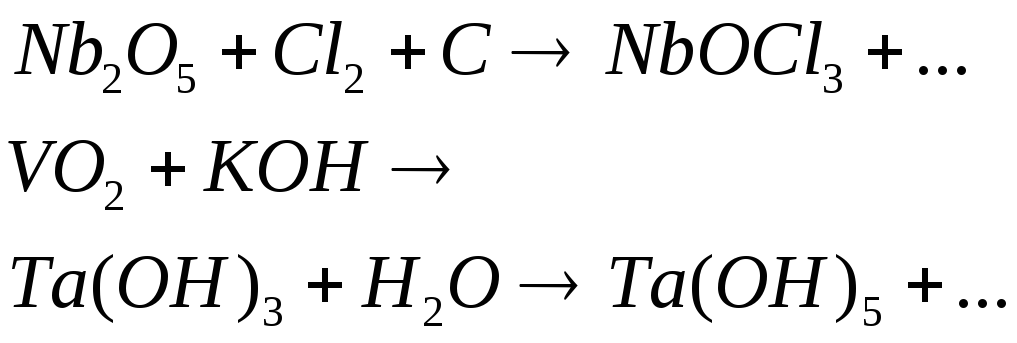
![]()
![]() (восстановление,
окислитель)
(восстановление,
окислитель)
![]() (окисление,
восстановитель)
(окисление,
восстановитель)
![]()
![]()
![]() (окисление, восстановитель)
(окисление, восстановитель)
![]() (восстановление,
окислитель)
(восстановление,
окислитель)
№524
Составьте электронные и молекулярные уравнения реакций, в которых соединения ванадия (Y) восстанавливаются в соединения ванадия со степенью окисления +2:
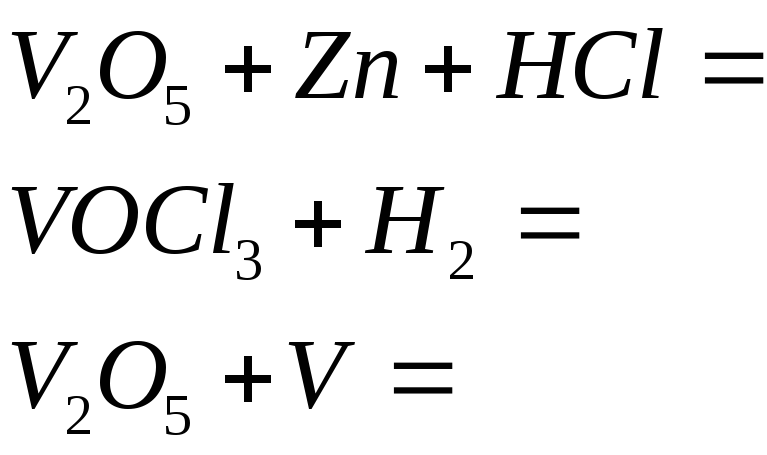
![]()
![]() (восстановление,
окислитель)
(восстановление,
окислитель)
![]() (окисление,
восстановитель)
(окисление,
восстановитель)
![]()
![]() (окисление,
восстановитель)
(окисление,
восстановитель)
![]() (восстановление,
окислитель)
(восстановление,
окислитель)
![]()
![]() (восстановление,
окислитель)
(восстановление,
окислитель)
![]() (окисление,
восстановитель)
(окисление,
восстановитель)
№524
Составьте электронные и молекулярные уравнения реакций, в которых соединения ванадия (Y) восстанавливаются в соединения ванадия со степенью окисления +2:
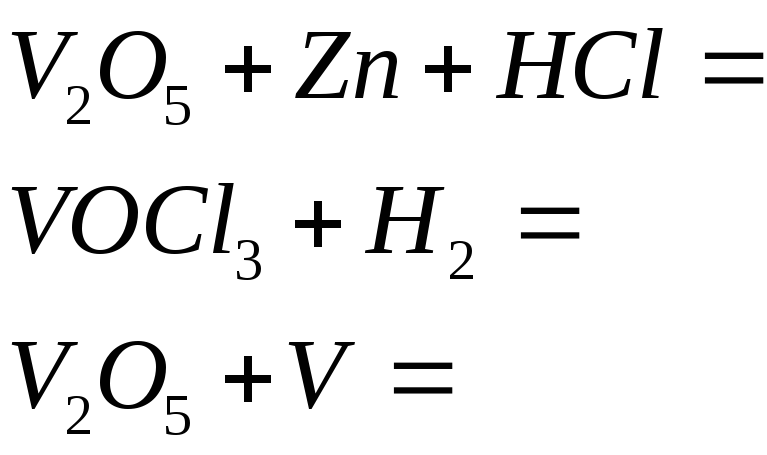
![]()
![]() (восстановление,
окислитель)
(восстановление,
окислитель)
![]() (окисление,
восстановитель)
(окисление,
восстановитель)
![]()
![]() (окисление,
восстановитель)
(окисление,
восстановитель)
![]() (восстановление,
окислитель)
(восстановление,
окислитель)
![]()
![]() (восстановление,
окислитель)
(восстановление,
окислитель)
![]() (окисление,
восстановитель)
(окисление,
восстановитель)
№528
Как перевести
хромат калия в дихромат и, наоборот,
дихромат калия в хромат? Составьте
электронные и молекулярное уравнения
реакций, происходящих при сплавлении
![]() с нитратом и карбонатом натрия (селитрой
и содой).
с нитратом и карбонатом натрия (селитрой
и содой).
Взаимные переходы хромата и дихромата можно выразить уравнением обратимой реакции:
![]()
Реакция
сплавления
![]() с карбонатом натрия (содой) и селитрой:
с карбонатом натрия (содой) и селитрой:
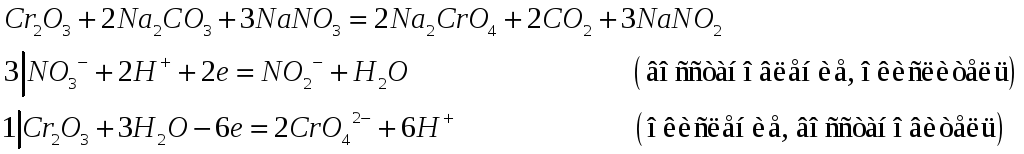
№532
Составьте электронно-ионные и молекулярные уравнения реакций:

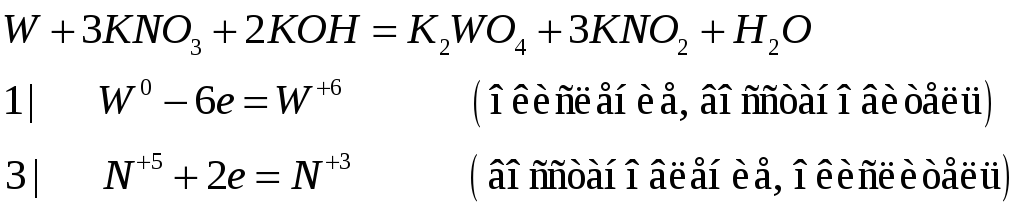
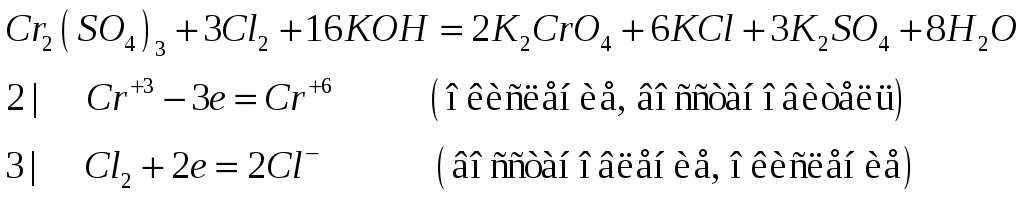
№532
Составьте электронно-ионные и молекулярные уравнения реакций:
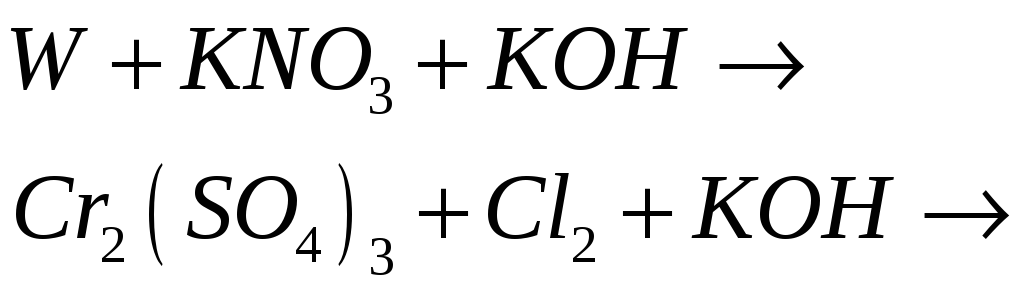
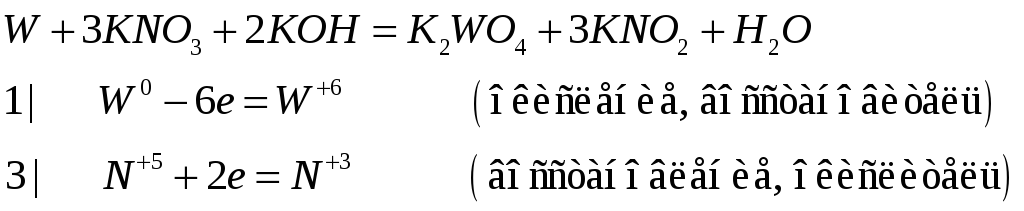
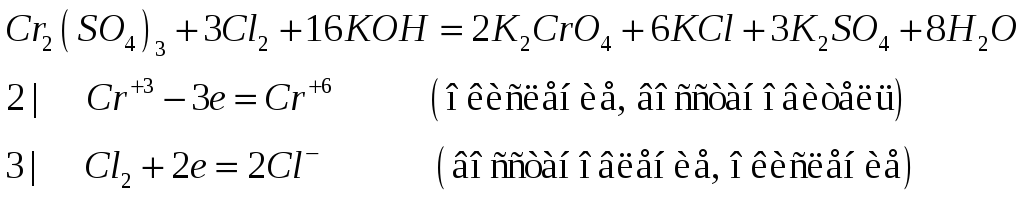
№533
Приведите уравнения реакций, с помощью которых можно осуществить превращения:
![]() .
Перевод молибдена в растваоримый
молибдат натрия легче всего осуществляется
путем сплавления молибдена с нитратом
и карбонатом натрия (селитрой и содой).
О каких свойствах гидроксида молибдена
(IY) говорит последнее
превращение?
.
Перевод молибдена в растваоримый
молибдат натрия легче всего осуществляется
путем сплавления молибдена с нитратом
и карбонатом натрия (селитрой и содой).
О каких свойствах гидроксида молибдена
(IY) говорит последнее
превращение?
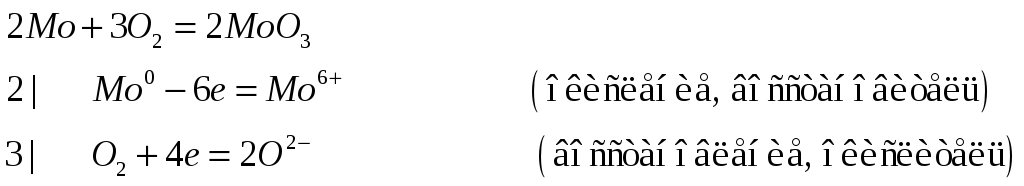

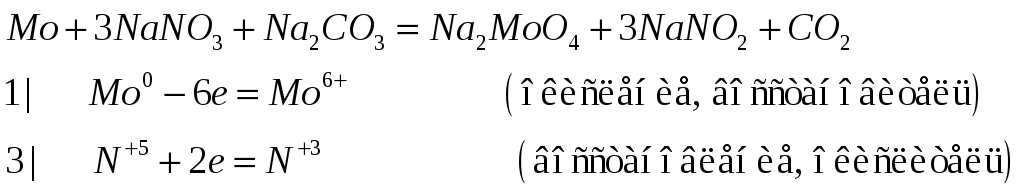
![]()
![]()
Данная реакция говорит об основных свойствах гидроксида.
№535
Природное
соединение молибдена (IY)
![]() служит источником для получения молибдена
и его соединений. На основании электронных
уравнений закончите уравнения реакций:
служит источником для получения молибдена
и его соединений. На основании электронных
уравнений закончите уравнения реакций:
![]()
![]()
![]() (окисление, восстановитель)
(окисление, восстановитель)
![]() (восстановление,
окислитель)
(восстановление,
окислитель)
![]()
![]() (окисление, восстановитель)
(окисление, восстановитель)
![]() (восстановление, окислитель)
(восстановление, окислитель)
№538
Металлический вольфрам можно получить при нагревании в результате восстановления соединений вольфрама (YI). Составьте электронные уравнения и закончите уравнения реакций:
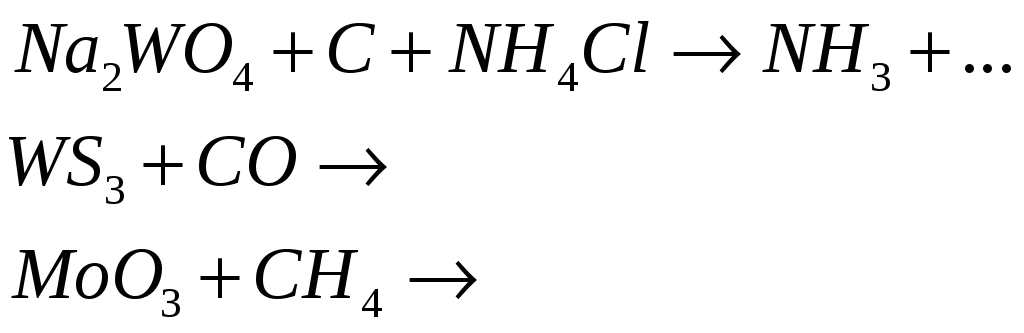

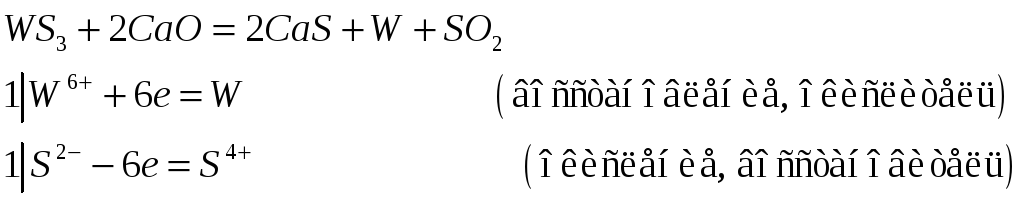

№539
Допишите уравнения реакций, в результате которых образуется диоксид молибдена:
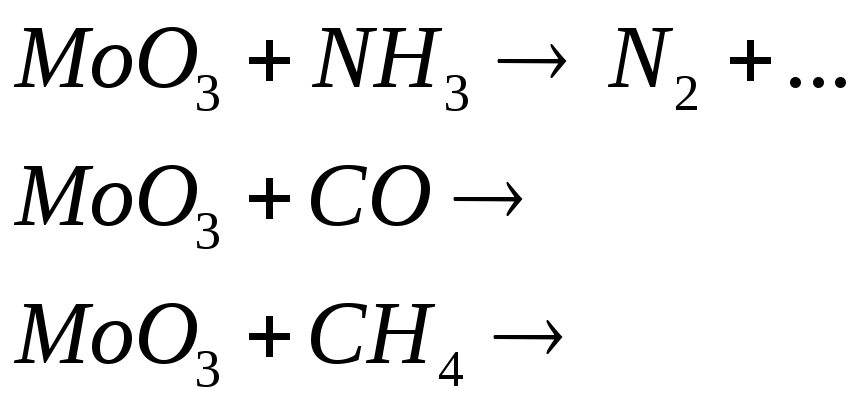
![]()
![]() (восстановление,
окислитель)
(восстановление,
окислитель)
![]() (восстановление,
окислитель)
(восстановление,
окислитель)
![]()
![]() (восстановление, окислитель)
(восстановление, окислитель)
![]() (окисление, восстановитель)
(окисление, восстановитель)
![]()
![]() (восстановление, окислитель)
(восстановление, окислитель)
![]()
![]() (восстановление,
окислитель)
(восстановление,
окислитель)
№539
Допишите уравнения реакций, в результате которых образуется диоксид молибдена:
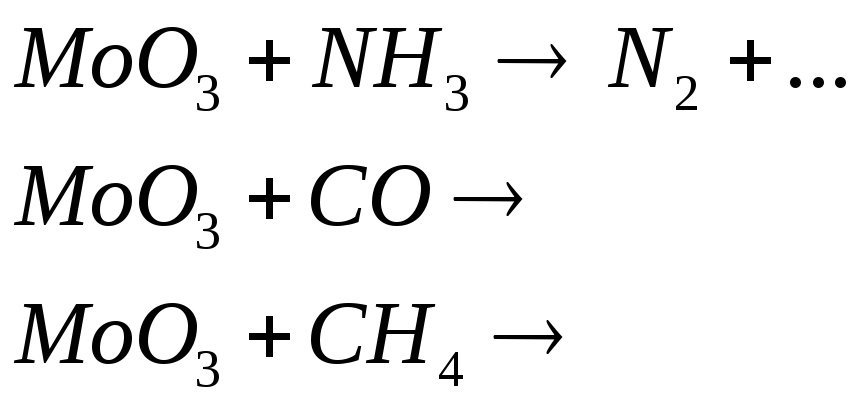
![]()
![]() (восстановление,
окислитель)
(восстановление,
окислитель)
![]() (восстановление,
окислитель)
(восстановление,
окислитель)
![]()
![]() (восстановление, окислитель)
(восстановление, окислитель)
![]() (окисление, восстановитель)
(окисление, восстановитель)
![]()
![]() (восстановление, окислитель)
(восстановление, окислитель)
![]()
![]() (восстановление,
окислитель)
(восстановление,
окислитель)
№544
Как влияет
реакция среды на характер восстановления
перманганата калия? Приведите электронные
и молекулярные уравнения реакций
![]() с нитритом калия: а) при рН=12; б) при рН=3.
с нитритом калия: а) при рН=12; б) при рН=3.
Возможны
следующие направления восстановления
иона
![]()
|
среда |
полуреакция |
Потенциал,
|
|
Кислая |
|
1,58В |
|
Нейтральная и щелочная |
|
1,23В |
|
Сильно щелочная |
|
0,56В |
А) При рН=12
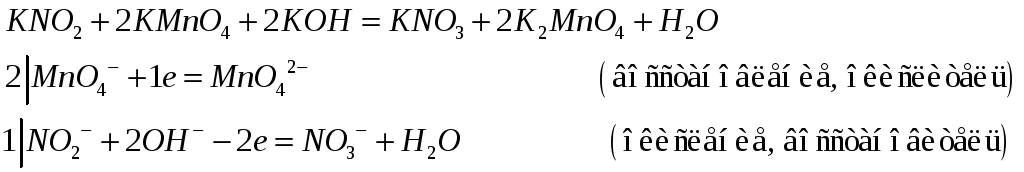
б) при рН=3
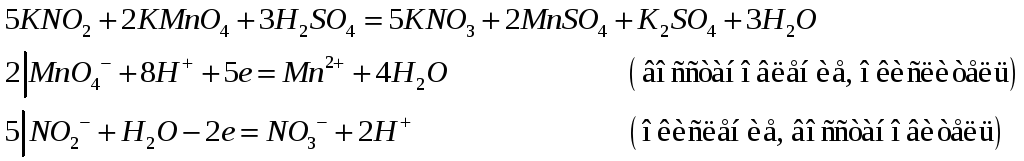
№547
Учитывая окислительно-восстановительные свойства различных соединений марганца, составьте электронные и молекулярные уравнения реакций:
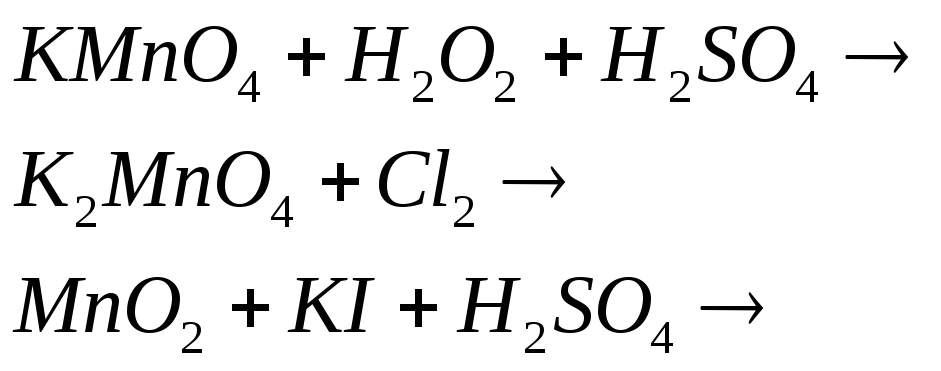
![]()
![]() (восстановление, окислитель)
(восстановление, окислитель)
![]() (окисление, восстановитель)
(окисление, восстановитель)
![]()
![]() (восстановление, окислитель)
(восстановление, окислитель)
![]() (окисление, восстановитель)
(окисление, восстановитель)
![]()
![]() (восстановление, окислитель)
(восстановление, окислитель)
![]() (окисление, восстановитель)
(окисление, восстановитель)
№548
Какие свойства
в окислительно-восстановительных
реакциях может проявлять
![]() ?
Почему? На основании электронных
уравнений составьте уравнения реакций:
?
Почему? На основании электронных
уравнений составьте уравнения реакций:
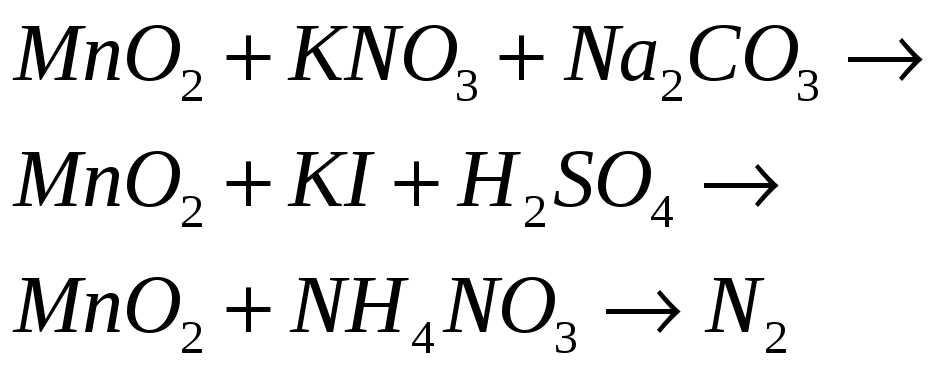
Марганец в оксиде (IY) проявляет промежуточную степень окисления, поэтому может играть роль и окислителя и восстановителя в химических реакциях.
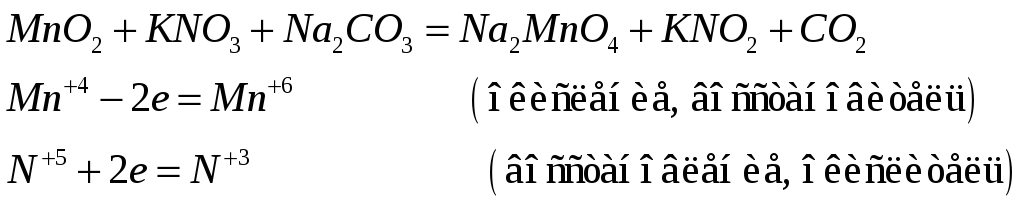
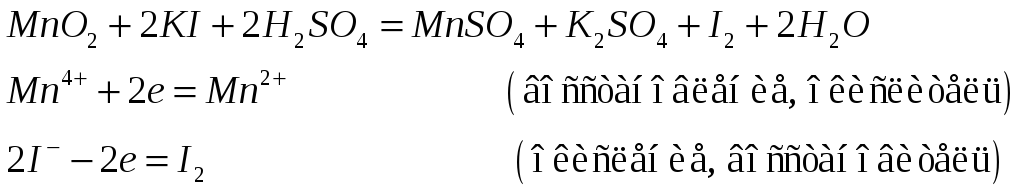
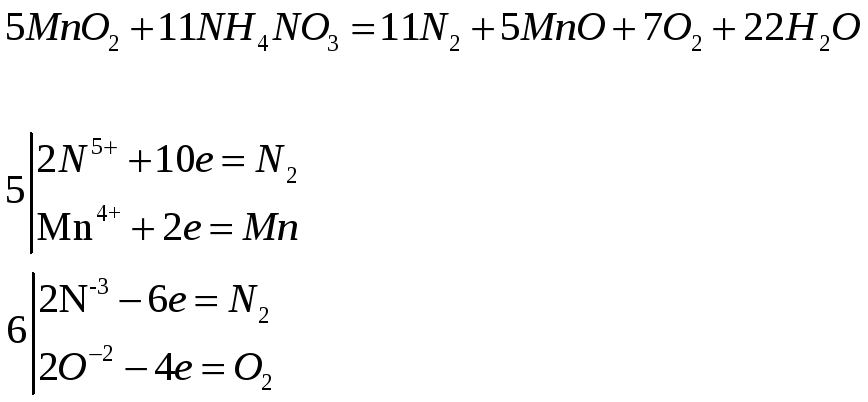
№550
Напишите электронные и молекулярные уравнения реакций, в результате которых образуется диоксид марганца:
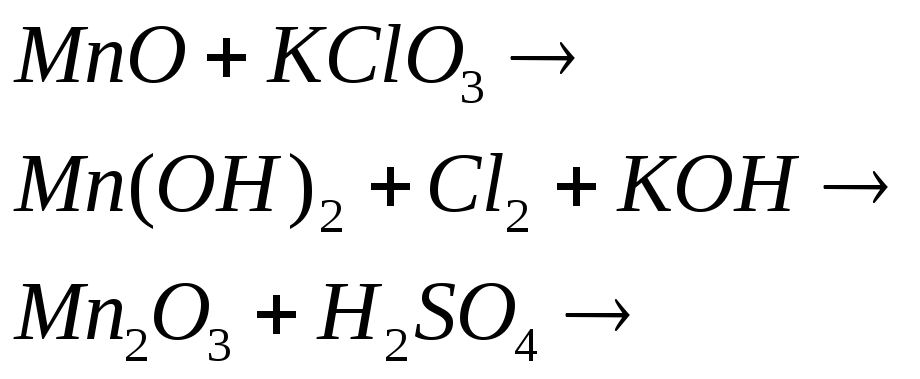
![]()
3|
![]() ((окисление, восстановитель)
((окисление, восстановитель)
1|
![]() (восстановление, окислитель)
(восстановление, окислитель)
![]() 1|
1|
![]() (восстановление, окислитель)
(восстановление, окислитель)
(окисление, восстановителль)
![]()
![]() (окисление, восстановителль)
(окисление, восстановителль)
![]() (восстановление, окислитель)
(восстановление, окислитель)
№550
Напишите электронные и молекулярные уравнения реакций, в результате которых образуется диоксид марганца:
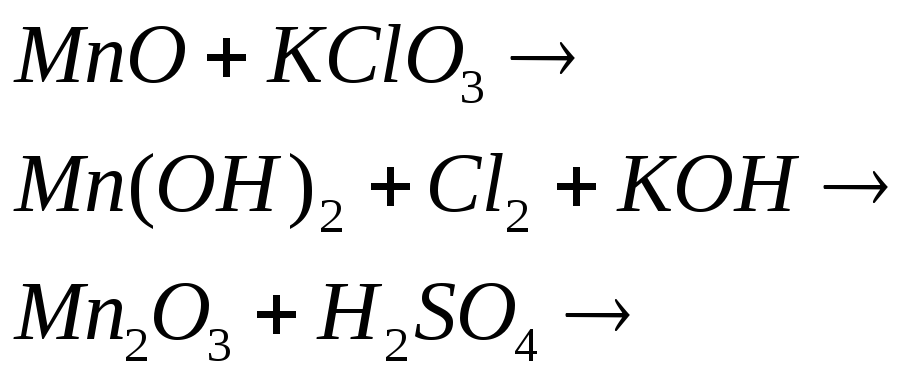
![]()
3|
![]() ((окисление, восстановитель)
((окисление, восстановитель)
1|
![]() (восстановление, окислитель)
(восстановление, окислитель)
![]() 1|
1|
![]() (восстановление, окислитель)
(восстановление, окислитель)
(окисление, восстановителль)
![]()
![]() (окисление, восстановителль)
(окисление, восстановителль)
![]() (восстановление, окислитель)
(восстановление, окислитель)
№553
Как изменится окраска раствора в результате реакций:

![]()
![]()
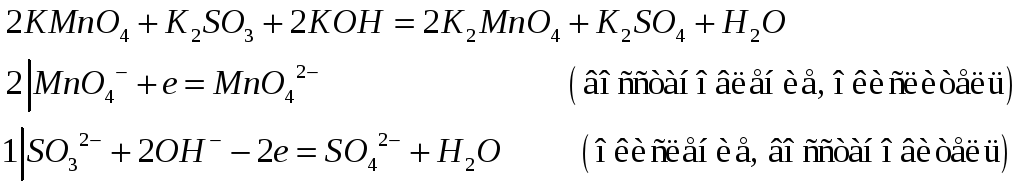
№554
Какая степень окисления наиболее характерна для рения? Составьте электронные и молекулярные уравнения реакций:
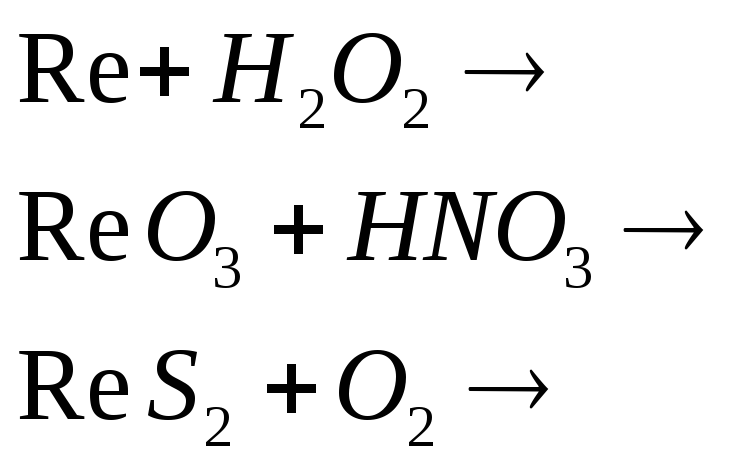
![]()
![]() (восстановление,
окислитель)
(восстановление,
окислитель)
![]() (окисление,
восстановитель)
(окисление,
восстановитель)
![]()
![]() (окисление,
восстановитель)
(окисление,
восстановитель)
![]() (восстановление,
окислитель)
(восстановление,
окислитель)
![]()
![]() (восстановление,
окислитель)
(восстановление,
окислитель)
![]() (восстановление,
окислитель)
(восстановление,
окислитель)
![]() (окисление,
восстановитель)
(окисление,
восстановитель)
№560
Составьте уравнения реакций, с помощью которых можно осуществить превращения:
![]()
![]()
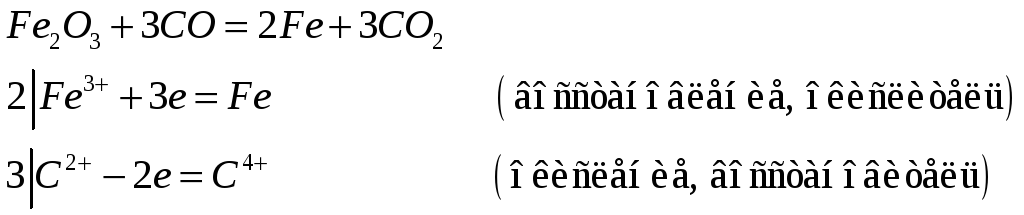

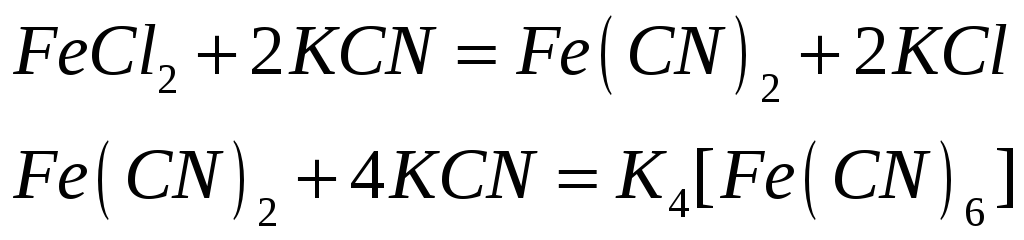

№562
Исходя из
строения магнетита, составьте уравнения
реакций
![]() с соляной и азотной кислотами. Какая
из этих реакций окислительно-восстановительная?
с соляной и азотной кислотами. Какая
из этих реакций окислительно-восстановительная?
Магнетит –
оксид железа (II, III)
![]()
![]()

№563
Гексацианоферрат
калия (красную кровяную соль)
![]() нельзя получить непосредственным
взаимодействием соединений железа
(III) с цианидом калия, так
как последний окисляется при этом в
нельзя получить непосредственным
взаимодействием соединений железа
(III) с цианидом калия, так
как последний окисляется при этом в
![]() и образуется
и образуется
![]() .
Составьте электронные и молекулярное
уравнения реакции
.
Составьте электронные и молекулярное
уравнения реакции
![]() с
с![]() в водной среде, принимая степень окисления
углерода в цианиде калия равной +2.
в водной среде, принимая степень окисления
углерода в цианиде калия равной +2.
Решение:
![]()
№565
Составьте уравнения реакций, с помощью которых можно осуществить следующие превращения:
![]()
![]()
![]() (восстановление,
окислитель)
(восстановление,
окислитель)
![]() (окисление, восстановитель)
(окисление, восстановитель)
![]()
![]() (окисление,
восстановитель)
(окисление,
восстановитель)
![]() (восстановление, окислитель)
(восстановление, окислитель)
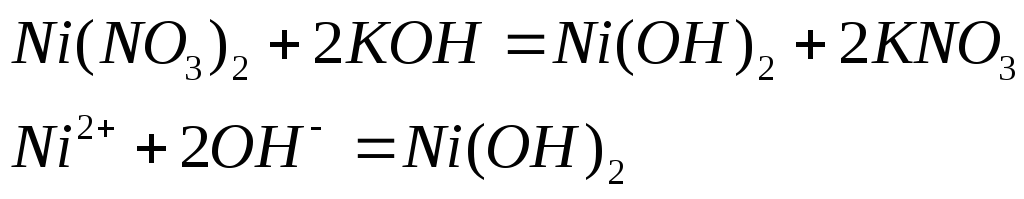
![]()
![]() (окисление,
восстановитель)
(окисление,
восстановитель)
![]() (восстановление,
окислитель)
(восстановление,
окислитель)
![]()
![]() (восстановление,
окислитель)
(восстановление,
окислитель)
![]() (окисление, восстановитель)
(окисление, восстановитель)
№568
Палладий в отличие от платины легко растворяется в азотной и горячей концентрированной серной кислотах. Составьте электронные и молекулярные уравнения реакций растворения палладия в серной кислоте, а платины в царской водке. Учтите наиболее характерную степень окисления этих металлов.
растворение палладия в серной кислоте

растворение платины в царской водке
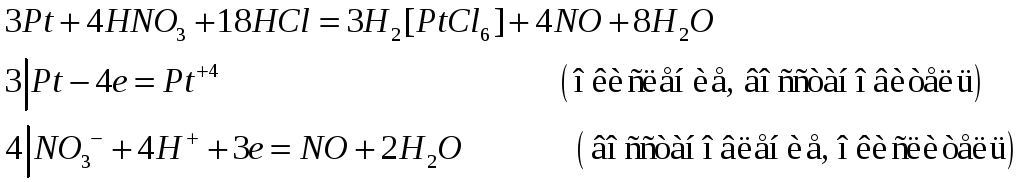
№569
Иридий в отличие от кобальта и родия образует устойчивые соединения, в которых проявляет степень окисления +4. Исходя из этого, составьте электронные и молекулярные уравнения реакций:
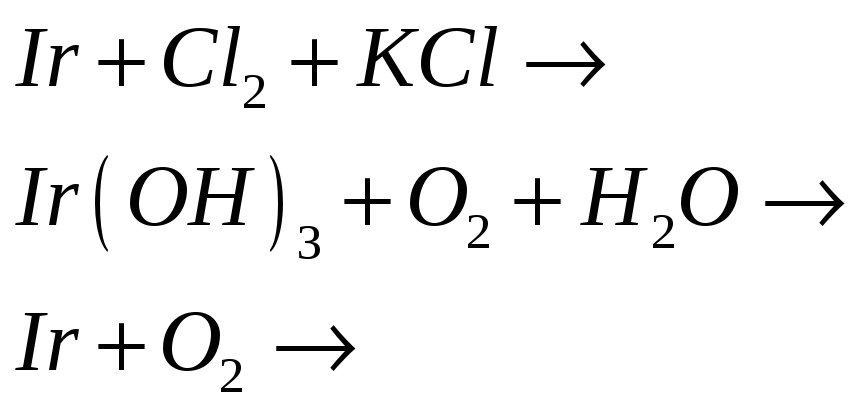
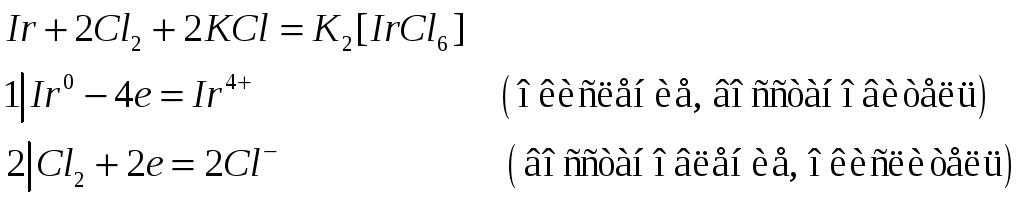

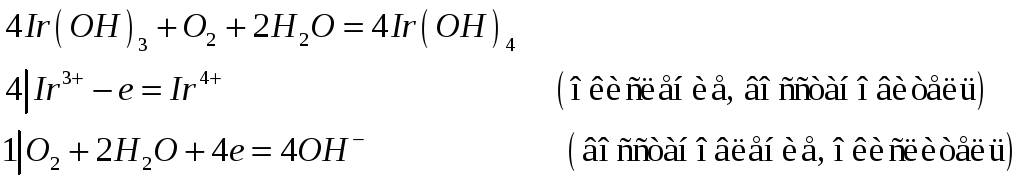
№576
Составьте уравнения реакций, с помощью которых можно осуществить следующие превращения:
![]()
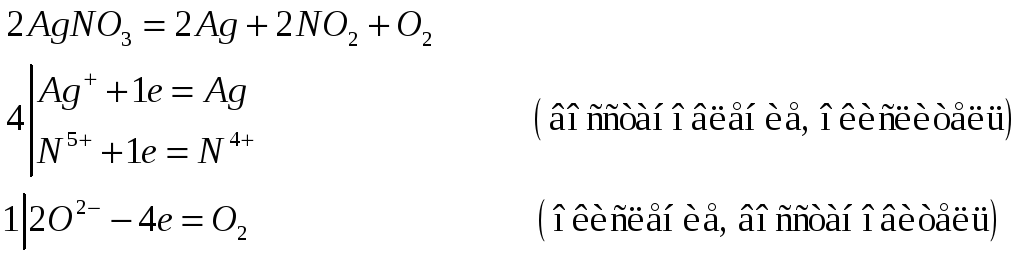
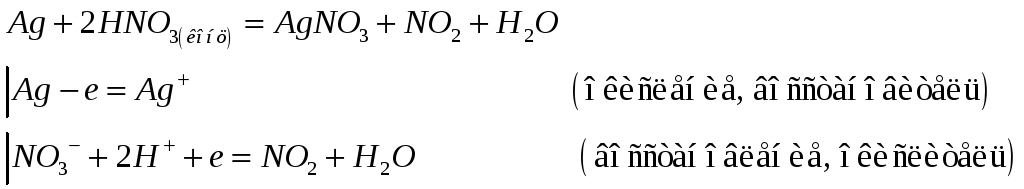
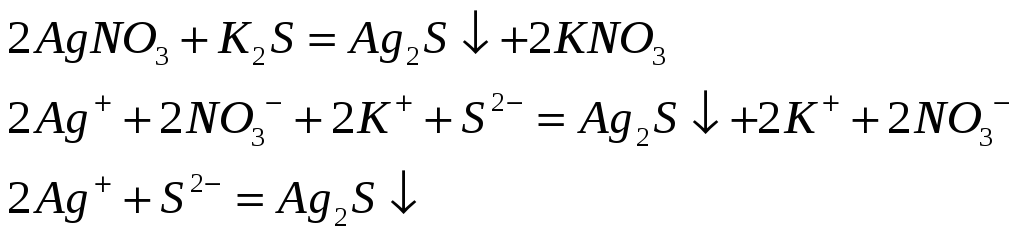
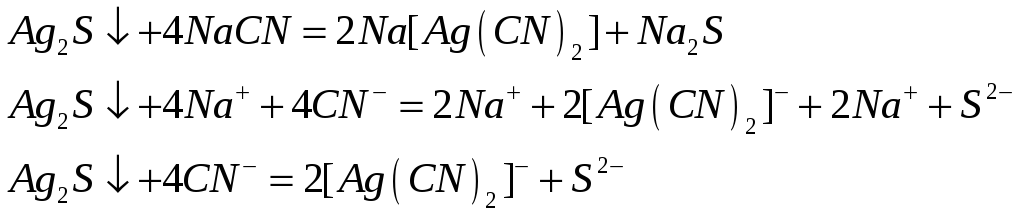
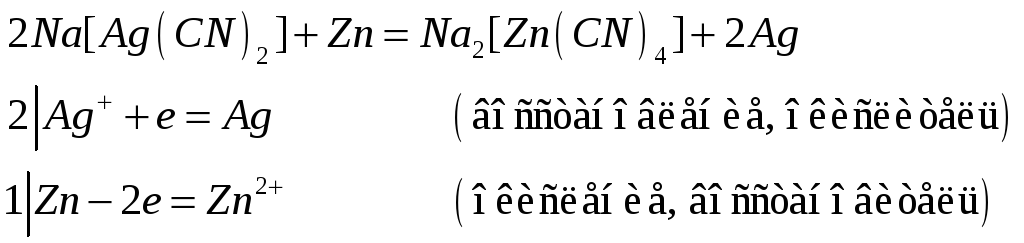
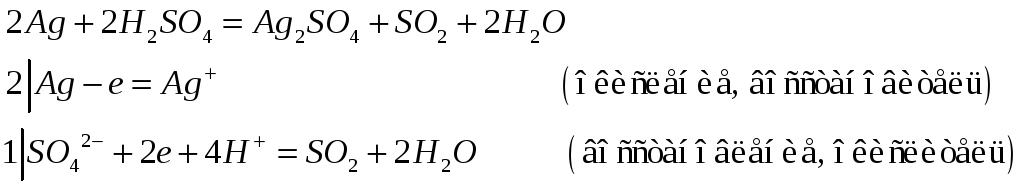
№577
Почему хлорид серебра растворяется в концентрированных растворах аммиака, хлорида натрия и тиосульфата натрия? Напишите молекулярные и ионно-молекулярные уравнения реакций.
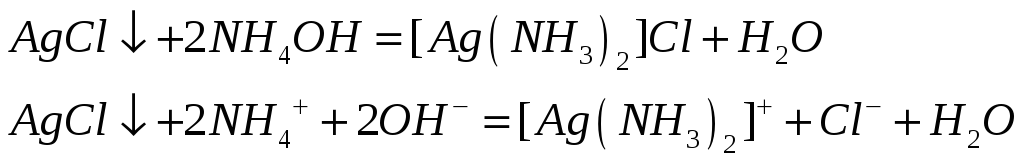
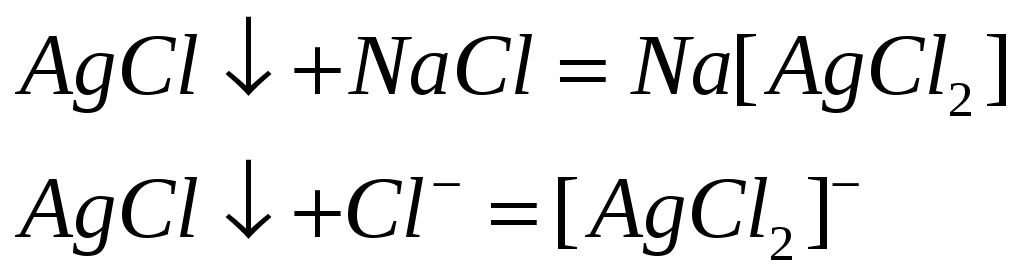
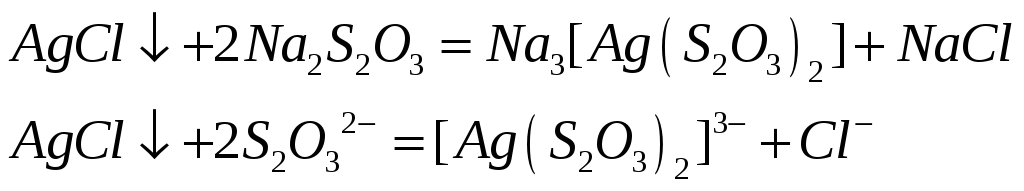
№580
Соединения меди, серебра и золота хорошие окислители. Почему? Составьте электронные и молекулярные уравнения реакций:
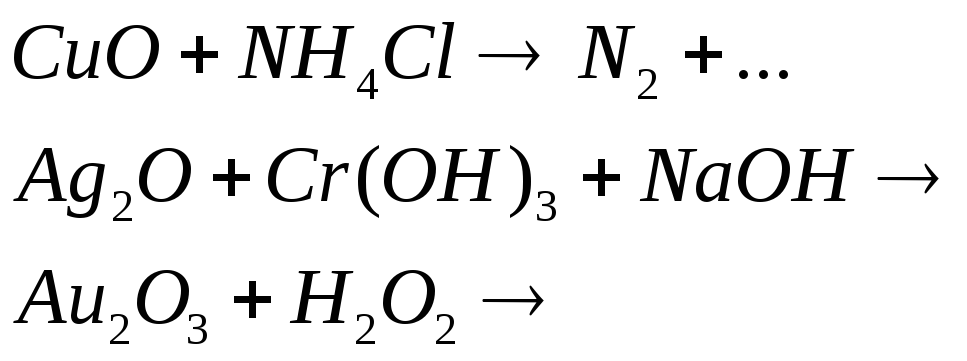
![]()
![]() (восстановление,
окислитель)
(восстановление,
окислитель)
![]() (окисление,
восстановитель)
(окисление,
восстановитель)
![]()
![]() (окисление, восстановитель)
(окисление, восстановитель)
№583
Какие кислотно-основные свойства проявляют гидроксиды меди (III) и золота (III)? Исходя из этого составьте уравнения реакций:
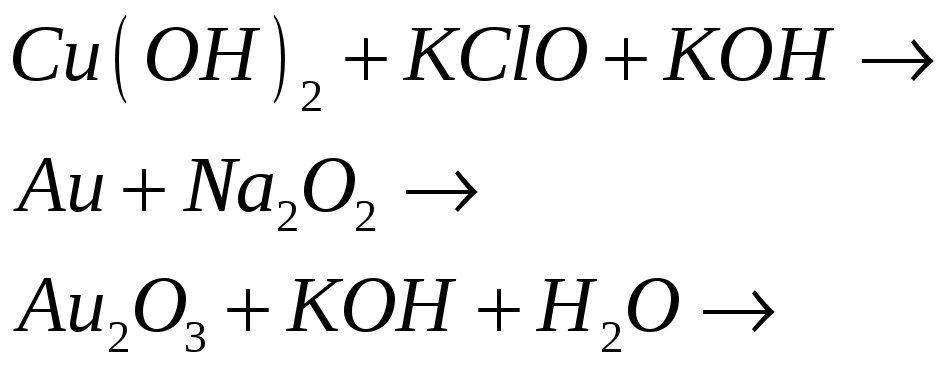
Гидроксиды меди (III) и золота (III) проявляют амфотерный характер.
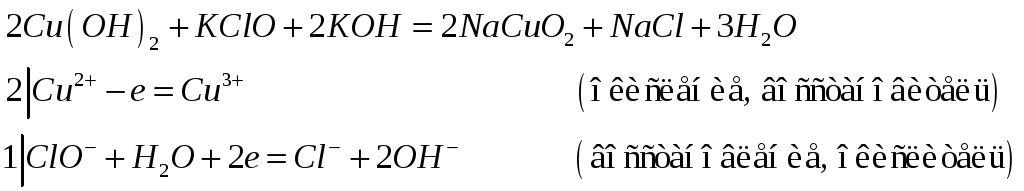
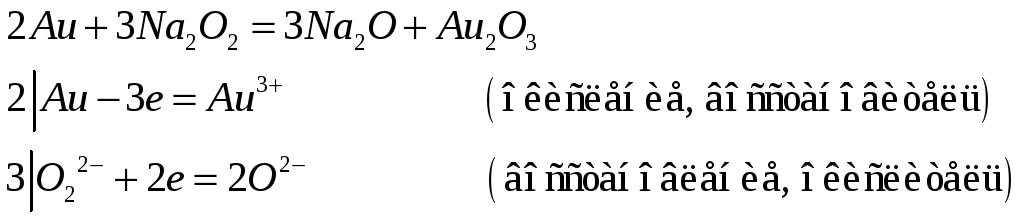
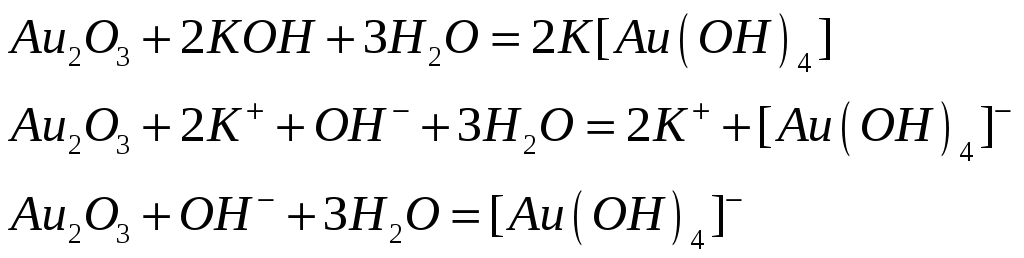
№584
Учитывая характерную степень окисления меди, серебра и золота, напишите электронные и молекулярные уравнения:
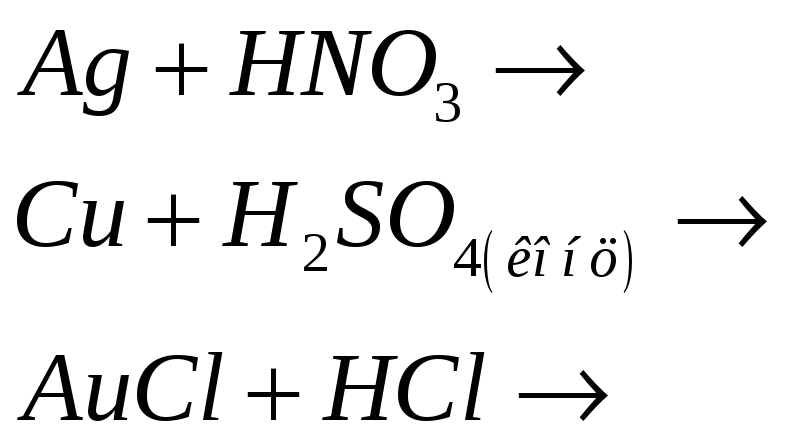
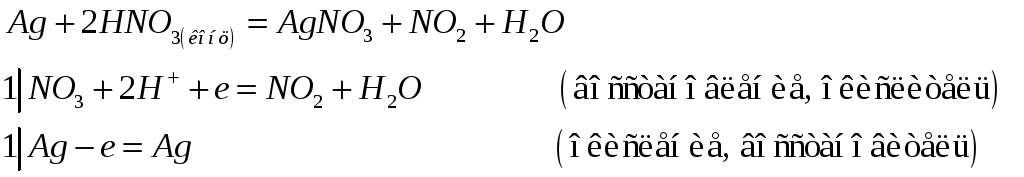
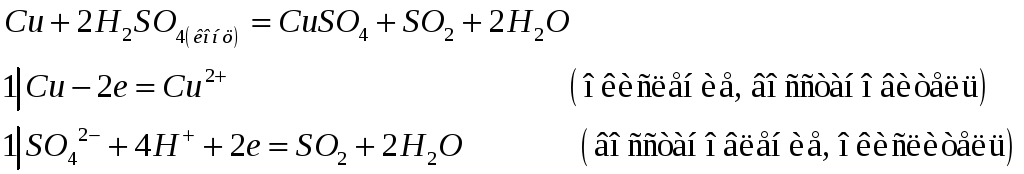
![]()
№592
В отличие от
сульфидов цинка и кадмия
![]() растворяется в концентрированном
растворе
растворяется в концентрированном
растворе
![]() .
Составьте уравнения реакций
.
Составьте уравнения реакций
![]() с концентрированными растворами:
с концентрированными растворами:
А) сульфида натрия;
Б) азотной кислоты.
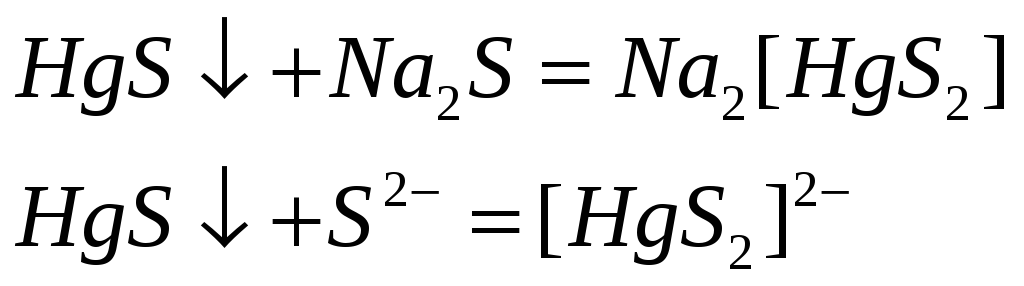
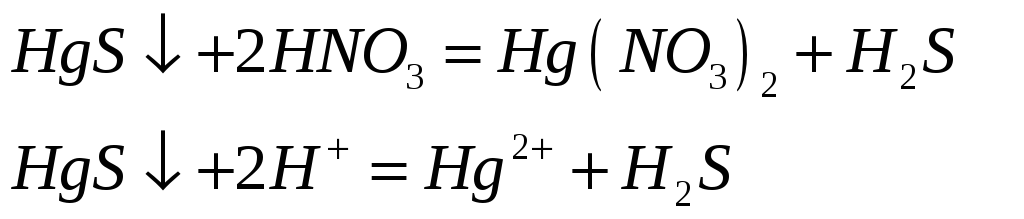
№592
В отличие от
сульфидов цинка и кадмия
![]() растворяется в концентрированном
растворе
растворяется в концентрированном
растворе
![]() .
Составьте уравнения реакций
.
Составьте уравнения реакций
![]() с концентрированными растворами:
с концентрированными растворами:
А) сульфида натрия;
Б) азотной кислоты.
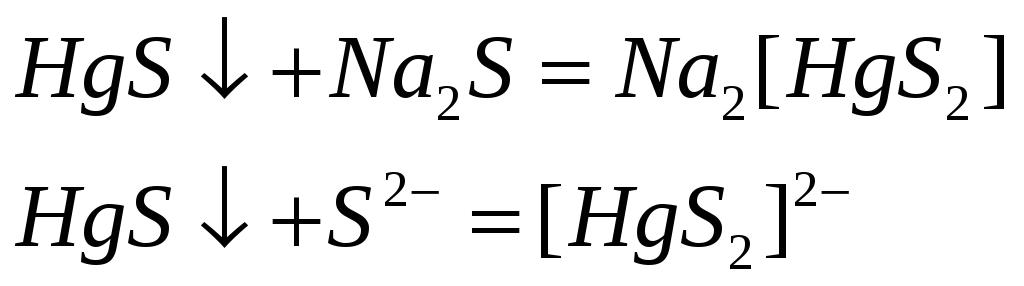
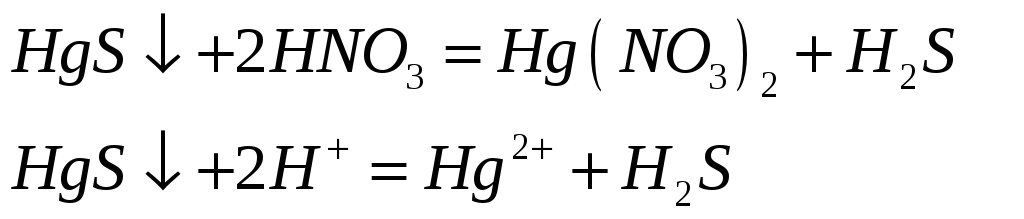
№593
приведите уравнения реакций цинка: а) с концентрированным раствором аммиака;
б) с очень разбавленной азотной кислотой.
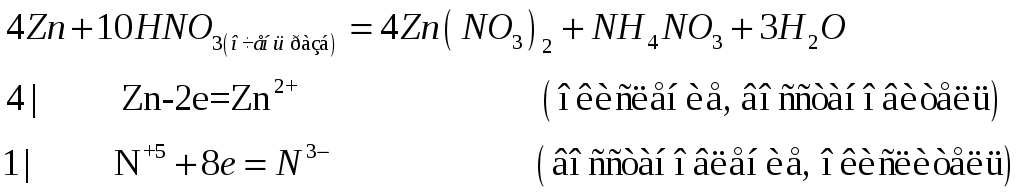
![]()
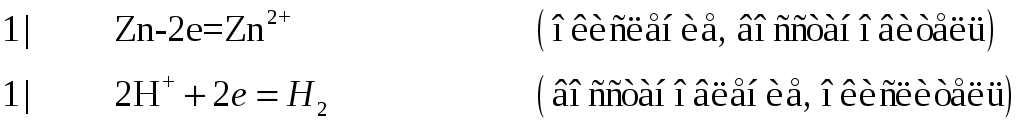
№593
приведите уравнения реакций цинка: а) с концентрированным раствором аммиака;
б) с очень разбавленной азотной кислотой.
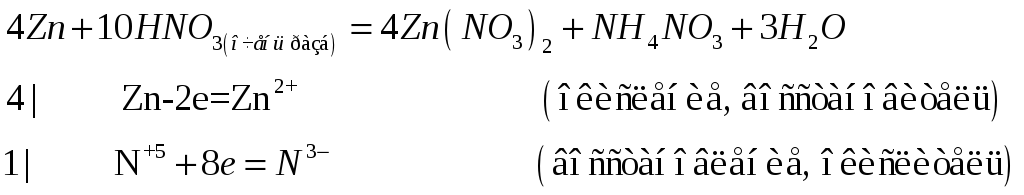
![]()
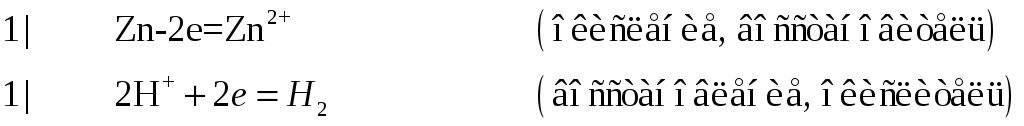
№ 595
Являясь хорошим восстановителем, цинковая пыль при кипячении с сильнощелочными растворами нитратов восстанавливает их максимально. Составьте электронные и молекулярные уравнения этой реакции, один из продуктов которой — тетрагидроксоцинкат натрия.
![]() тетрагидроксоцинкат натрия
тетрагидроксоцинкат натрия
![]()
![]()
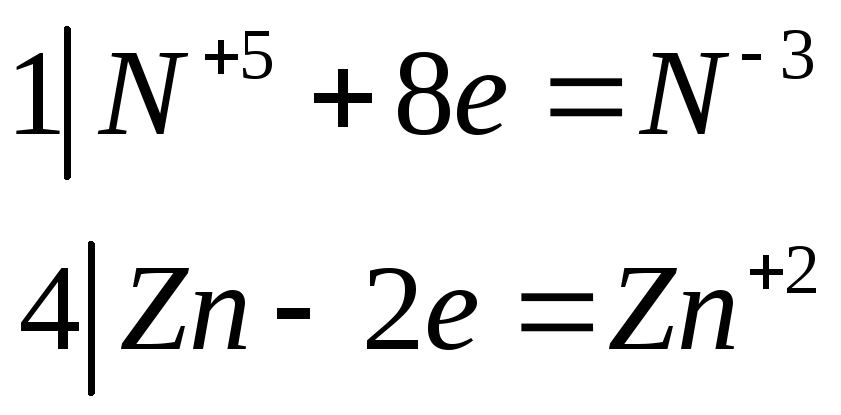
№598
Приведите уравнения реакций, с помощью которых можно осуществить следующие превращения:
![]()
![]()
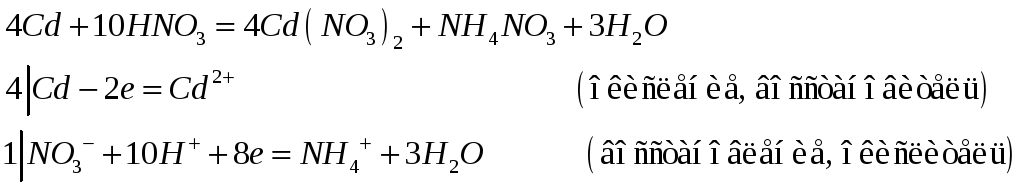

![]()
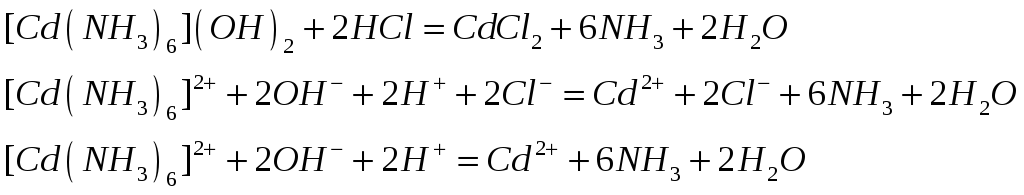
№599
Какими кислотно-основными свойствами обладает оксид и гидроксид цинка?
Исходя из этого, составьте уравнения реакций:
![]()
![]()
![]()
Оксид и гидроксид цинка обладают амфотерными свойствами:
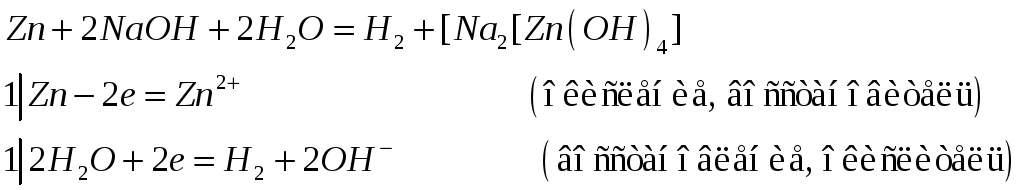
![]()
![]()
№600
Соединения ртути (II) хорошие окислители. Почему? Составьте электронные и молекулярные уравнения реакций:
![]()
![]()
![]()
Поскольку +2 – максимальная степень окисления ртути, то в химических реакциях ртуть (II) будет восстанавливаться, т.е. проявлять окислительные свойства.