
- •Звездочкой обозначены разрыхляющие молекулярные орбитали. Для молекулы f2:
- •Таким образом, более высокая энергия связи объясняется более высоким её порядком.
- •Звездочкой обозначены разрыхляющие молекулярные орбитали. Для молекулы о2:
- •Таким образом, более высокая энергия связи объясняется более высоким её порядком.
- •Звездочкой обозначены разрыхляющие молекулярные орбитали. Для молекулы о2:
- •Восстановительные свойства могут проявлять катионы ванадия и хрома, так как они находятся в промежуточной степени окисления
- •Чем отличается взаимодействие германия и свинца с концентрированной азотной кислотой? Почему? Составьте электронные и молекулярные уравнения реакций:
- •Составьте электронные и молекулярные уравнения реакций:
- •Составьте электронные и молекулярные уравнения реакций:
- •Кислород в перекиси водорода имеет промежуточную степень окисления –1.
- •Вследствие несимметричности распределения связей о – н, Ме – о молекулы пероксидов сильно полярны. Пероксид – радикал может, не изменяясь переходить из соединения в соединение:
- •Закончите уравнения реакций:
- •Приведенные реакции относятся к реакциям внутримолекулярного окисления-восстановления.
- •Сера способна как окислятся, так и восстанавливаться, ввиду того, что нулевая степень окисления является промежуточной.
Чем отличается взаимодействие германия и свинца с концентрированной азотной кислотой? Почему? Составьте электронные и молекулярные уравнения реакций:
Германий и
олово полные электронные аналоги.
Валентными у них являются
![]() -электроны.
В ряду
-электроны.
В ряду
![]() уменьшается роль внешней электронной
уменьшается роль внешней электронной
![]() -пары
в образовании химических связей
(участвуют не 4, а только 2 электрона).
Поэтому для германия наиболее характерна
степень окисления +4, а для свинца +2. В
результате при взаимодействии с азотной
кислотой германий переходит в германиевую
кислоту
-пары
в образовании химических связей
(участвуют не 4, а только 2 электрона).
Поэтому для германия наиболее характерна
степень окисления +4, а для свинца +2. В
результате при взаимодействии с азотной
кислотой германий переходит в германиевую
кислоту
![]() ,
а свинец по отношению к азотной кислоте
любых концентраций выступает как металл.
,
а свинец по отношению к азотной кислоте
любых концентраций выступает как металл.
![]()
1|
![]() (окисление, восстановитель)
(окисление, восстановитель)
4|
![]() (восстановление,
окислитель)
(восстановление,
окислитель)
![]()
3|
![]() (окисление, восстановитель)
(окисление, восстановитель)
2|
![]() (восстановление,
окислитель)
(восстановление,
окислитель)
401
Ge2+ - 2e = Ge4+ / 1
N5+ + e = N4+ / 2
GeS + 2HNO3 → GeO2 + 2NO2 + H2S
Sn2+ - 2e = Sn4+ / 6 / 3
2N3+ + 6e = N2 / 2 / 1
3SnCl2 + 2HNO2 + 6HCl → N2 + 3SnCl4 + 4H2O
Ge - 4e = Ge4+ / 6 / 3
Cl5+ + 6e = Cl- / 4 / 2
3Ge + 2KClO3 + 6KOH → 3K2GeO3 + 2KCl + 3H2O
№403
Составьте уравнения реакций, с помощью которых можно осуществить превращения:
![]()



![]()
![]()
![]()
405
Ge + O2 → GeO2
GeO2 + 2H2 → Ge + 2H2O
Ge + 2Cl2 → GeCl4
GeCl4 + 2H2S = GeS2 + 4HCl
GeS2 + K2S → K2GeS3
K2GeS3 + 2HCl →GeS2 + H2S + 2KCl
406
1) +5 HNO3
H – O – N = O
||
O
2) +4 N2O4
O = N – O – N = O
||
O
3) +3 HNO2
H – O – N = O
4) +2 N=O
5) +1 N2O
N- = N+ = O
6) 0 N2
N ≡ N
7) -1 NH2OH
H – N – O – H
|
H
8) -2 N2H4
H – N – N – H
| |
H H
9) -3 NH3
H – N – N – H
| |
H H
406
1) +5 HNO3
H – O – N = O
||
O
2) +4 N2O4
O = N – O – N = O
||
O
3) +3 HNO2
H – O – N = O
4) +2 N=O
5) +1 N2O
N- = N+ = O
6) 0 N2
N ≡ N
7) -1 NH2OH
H – N – O – H
|
H
8) -2 N2H4
H – N – N – H
| |
H H
9) -3 NH3
H – N – N – H
| |
H H
407
Способ получения:
2NH3 + NaClO = N2H4 + NaCl + H2O
H-N-N-H
│ │
H H
Гидразин является сильным восстановителем:
4KMnO4 + 5N2H4 + 6H2SO4 = 5N2 + 4MnSO4 + 2K2SO4 + 16H2O
N2H4 + O2 = N2 + 2H2O
2N-2 →-4e N2 *1
O2 →+4e 2O2- *1
2SnCl2 + N2H4 = 2Sn + N2 + 4HCl
2N-2 →-4e N2 *1
Sn2+ →+2e Sn0 *2
408
Нитриды – это соединения, в которых степень окисления азота - 3. Амиды – производные NH2-. Имиды – производные NH2-.
HNO3 + 6H →электролиз NH2OH + 2H2O
N+5 → +6 N-1 *1
H0 → -1 H+1 *6
NH2OH + HI = [NH3OH]I
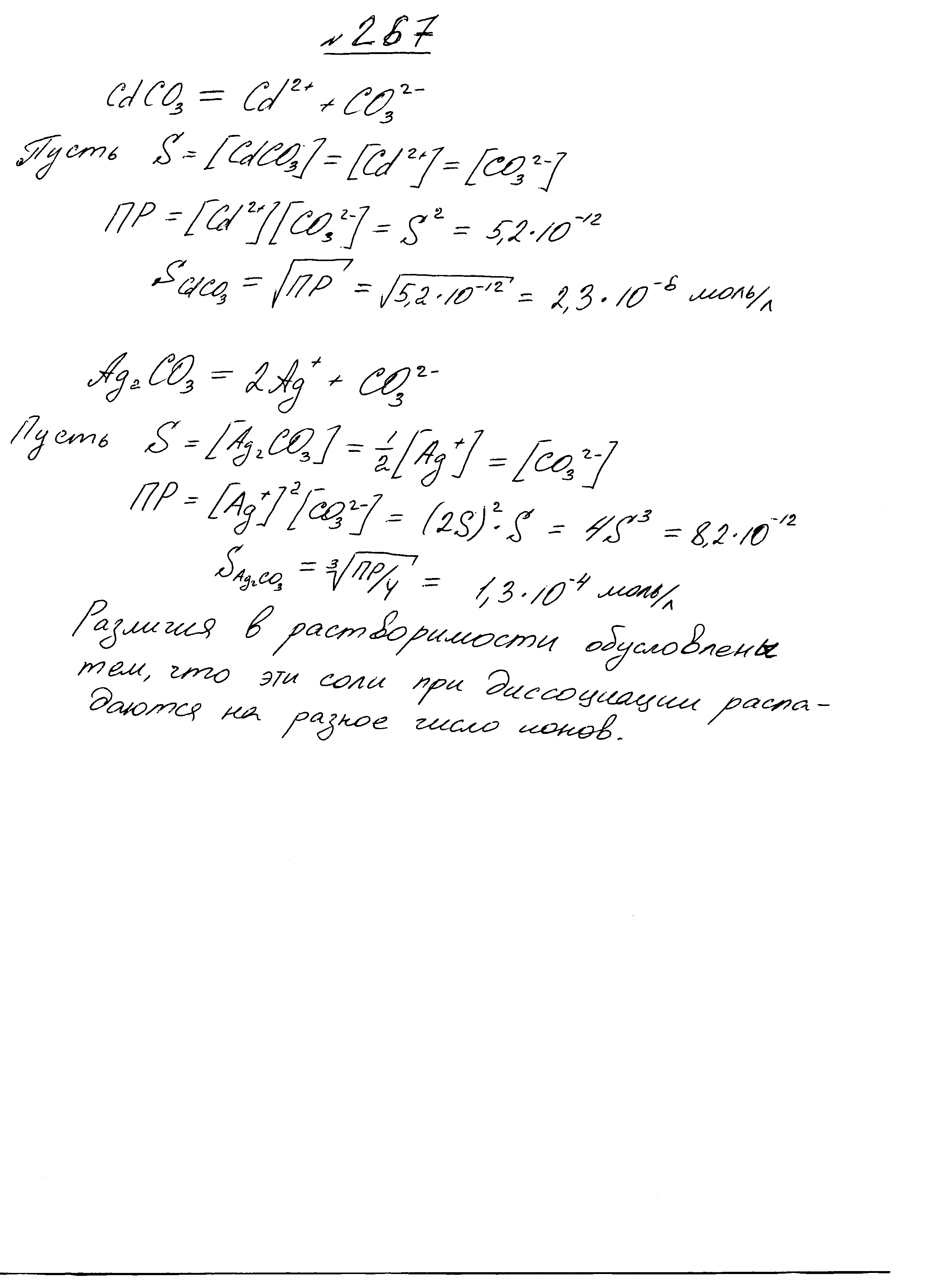
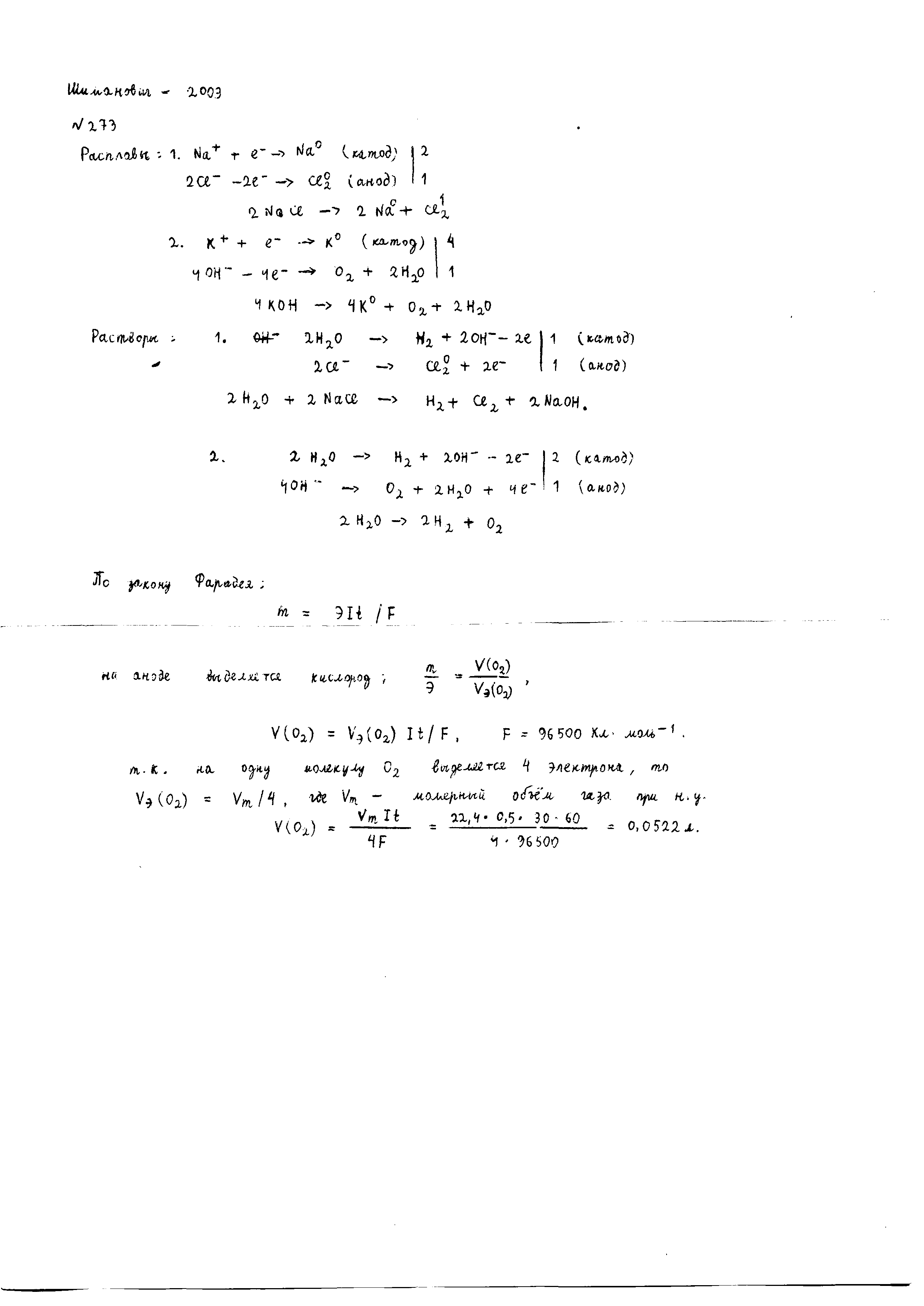




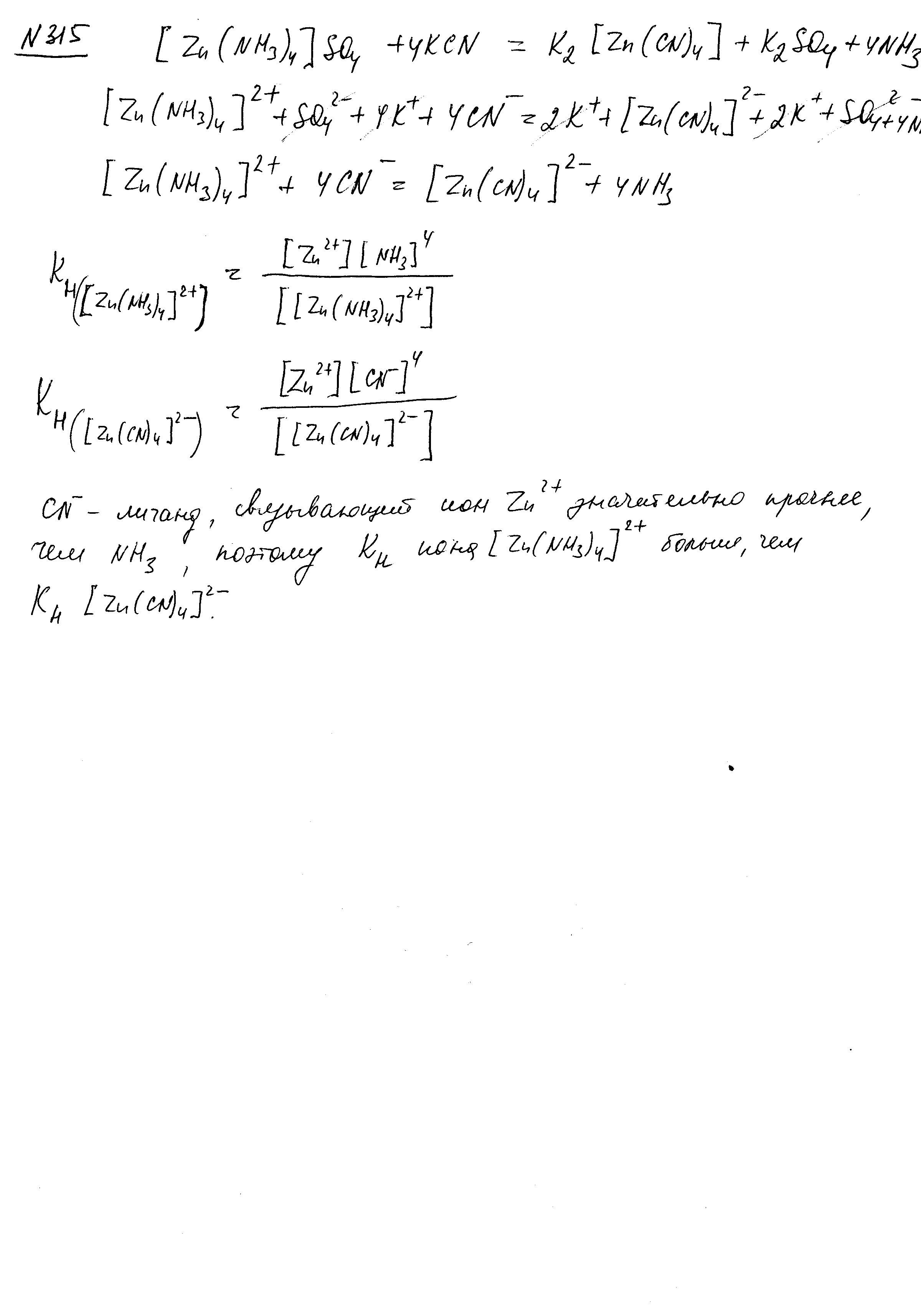










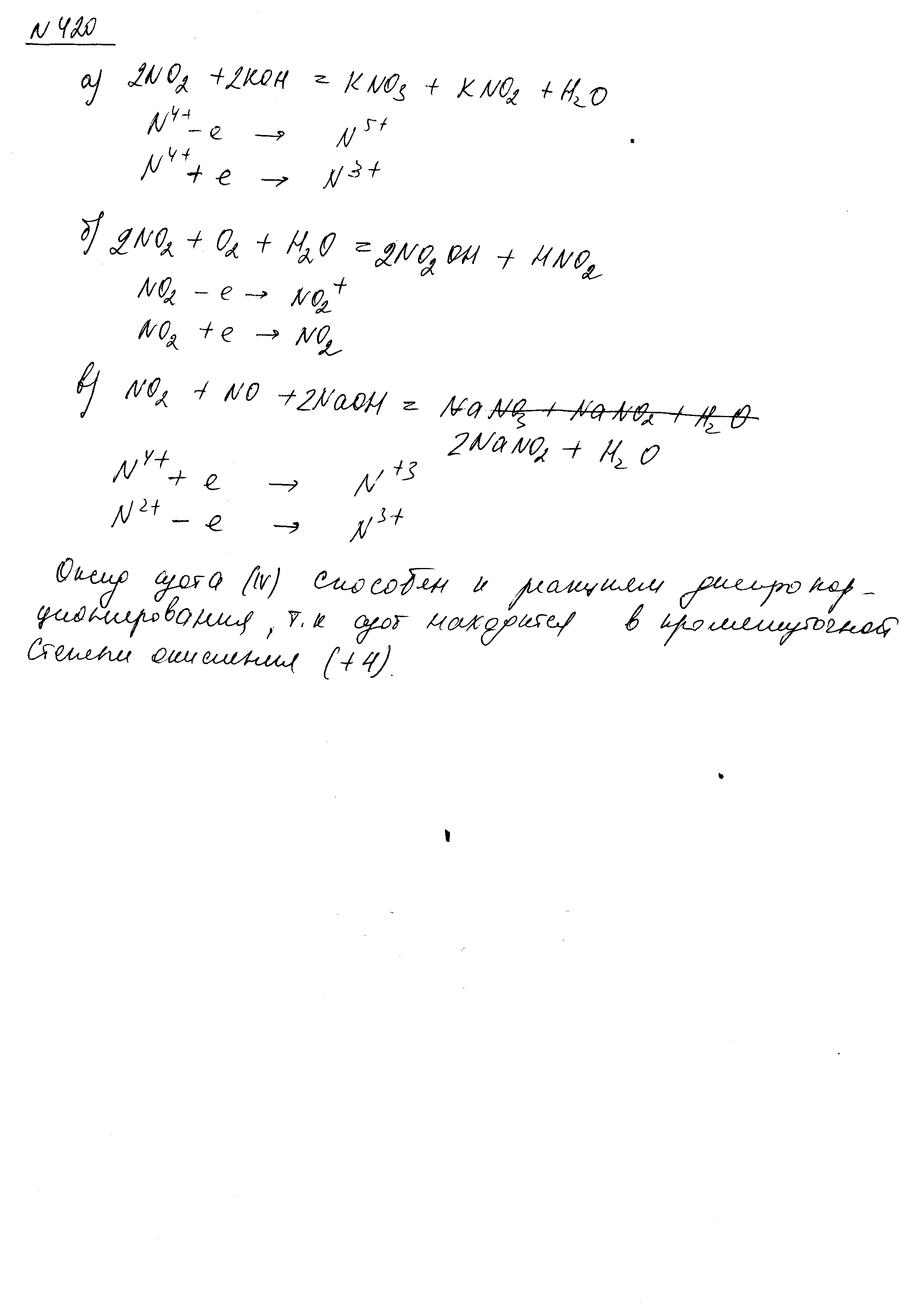


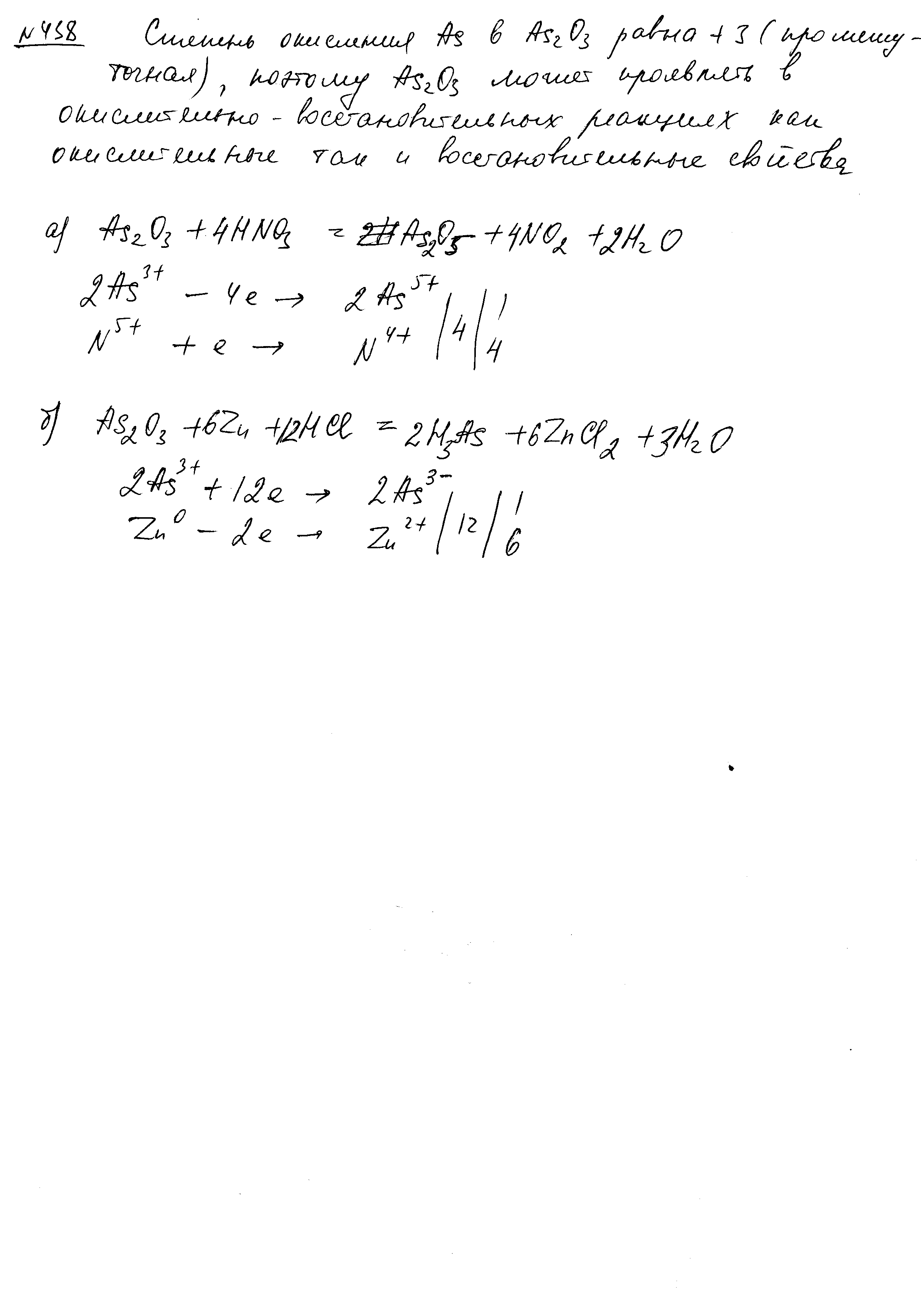








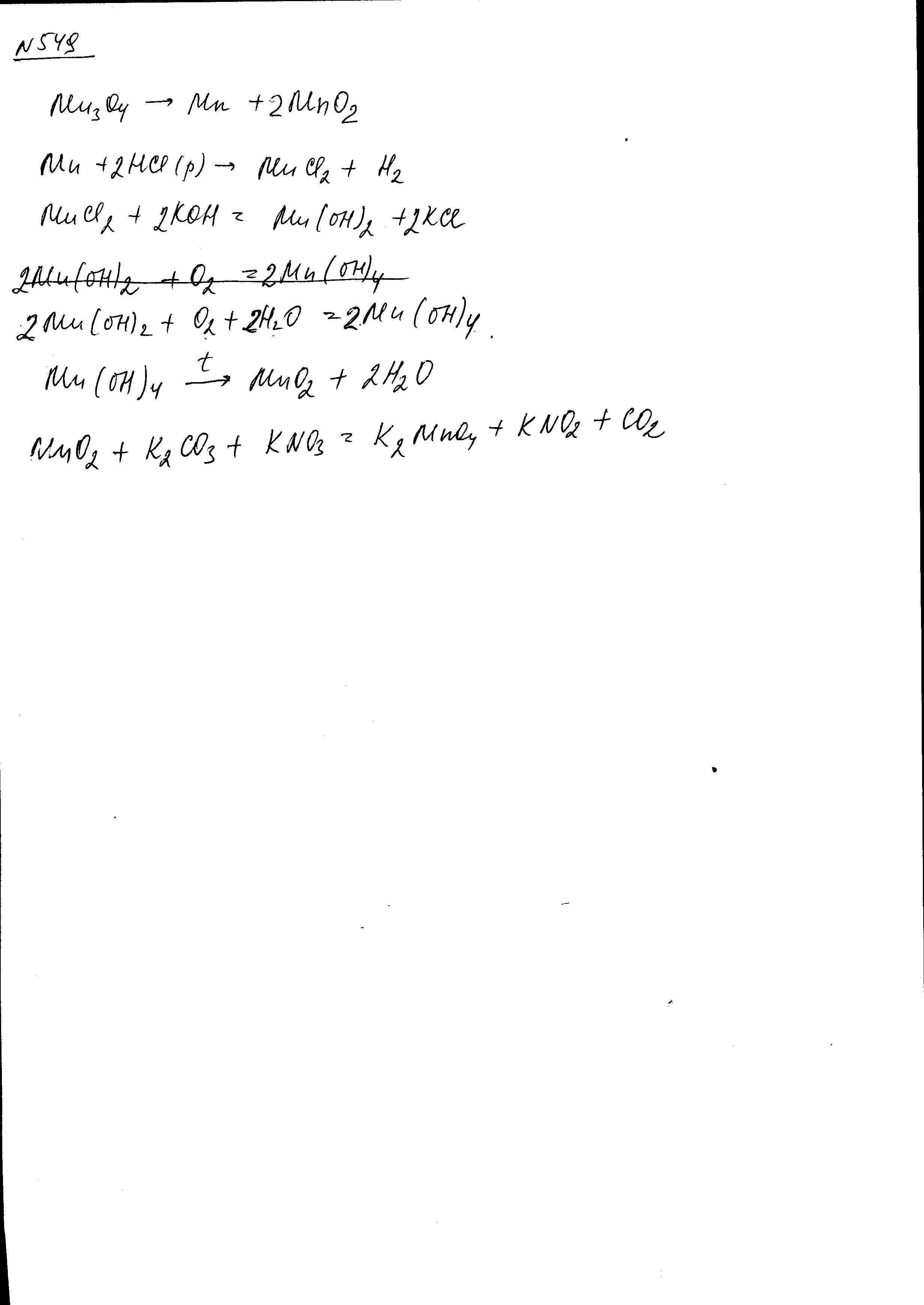


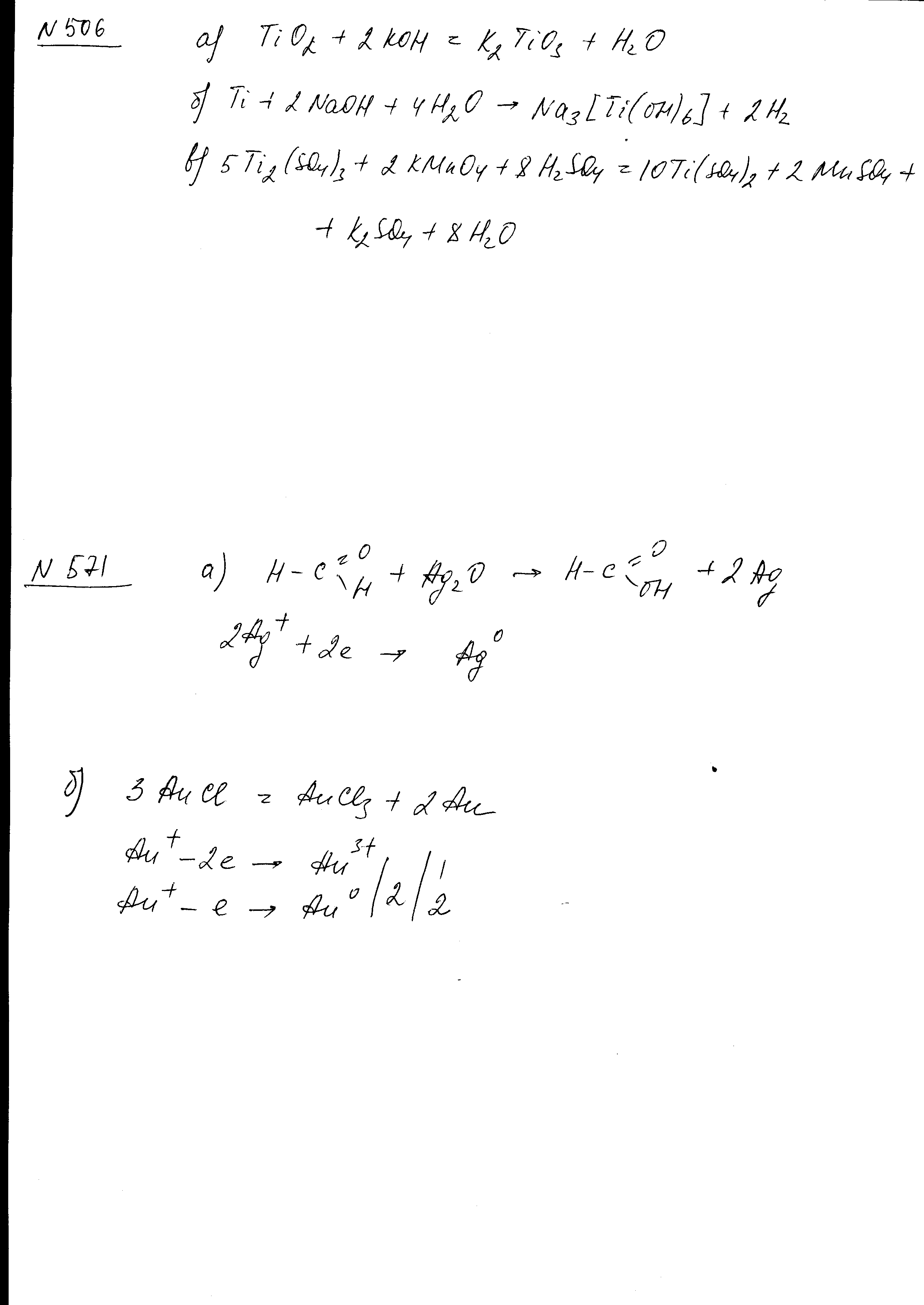


№410
Как получают аммонийные соли? Что образуется при нагреваннии солей аммония? Покажите это на примере разложения фосфата и дихромата аммония. Как доказать, что белый налет на лабораторной посуде содержит ион аммония?
Аммоний ные соли получают при взаимодействии аммиака с кислотами, например:
![]()
При этом чем сильнее кислоты, тем устойчивее их аммонийные производные.
При нагревании соли аммония разлагаются или возгоняются:

![]()
Качественной реакцией на ион аммония является реакция с раствором щелочи. Если в лабораторную посуду добавить раствор щелочи и нагреть, то в случае присутствия иона аммония выделяется аммиак:
![]()
411
S – 6e = S6+ / 3 / 1
N5+ + 3e = N2+ / 6 / 2
S + 2HNO3 = H2SO4 + 2NO
Ag – e = Ag+ / 1
N5+ + e = N4+ / 1
Ag + 2HNO3 = AgNO3 + NO2 + H2O
1) Получение азотной кислоты из селитры:
NaNO3 + H2SO4 = HNO3 + NaHSO4
2) Получение азотной кислоты из воздуха дуговым методом:
N2 + O2 = 2NO
2NO + O2 = 2NO2
4NO2 + O2 + 2H2O = 4HNO3
3) Получение азотной кислоты окислением аммиака на катализаторе:
4NH3 + 5O2 = 4NO + 6H2O
2NO + O2 = 2NO2
4NO2 + O2 + 2H2O = 4HNO3
412
Азотистая кислота образуется, например, при действии концентрированной серной кислоты на водный раствор нитрита натрия:
2NaNO2 + H2SO4 → 2HNO2 + Na2SO4
Так как азот в азотистой кислоте имеет промежуточную степень окисления +3, он может как восстанавливаться, так и окисляться.
2HNO2 + 6H+ + 6e = N2 + 4H2O / 1
H2S - 2e = S + 2H+ / 3
3H2S + 2HNO2 → N2 + 3S + 4H2O
HNO2 + H2O - 2e = NO3- + 3H+ / 3
MnO4- + 4H+ + 3e = MnO2 + 2H2O / 2
3HNO2 + 3H2O + 2MnO4- + 8H+ = 2MnO2 + 4H2O + 3NO3- + 9H+
3HNO2 + 2MnO4- = 2MnO2 + H2O + 3NO3- + H+
3HNO2 + 2HMnO4 = 2MnO2 + H2O + 3HNO3
№413
Составьте электронные и молекулярные уравнения реакций разложения:
А) азотной кислоты;
Б) азотистой кислоты;
В) гидразина;
Г) нитрата серебра.
К какому типу реакций относится каждая из них?
А) разложение азотной кислоты
![]()
в данной реакции разложения элементы не меняют степени окисления.
Б) разложение азотистой кислоты
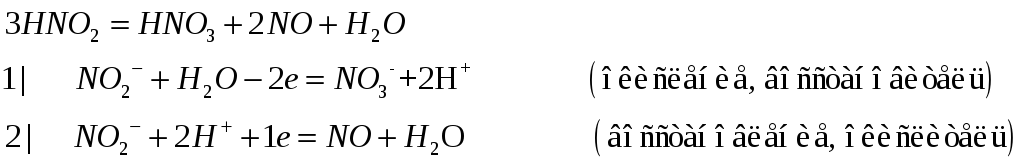
в) разложение гидразина

данная реакция относится к типу внутримолекулярного окисления-восстановления
г) разложение нитрата серебра

данная реакция относится к типу внутримолекулярного окисления-восстановления.
414
N3- - 3e = N / 1
N3+ + 3e = N / 1
NH4NO2 → N2 + 2H2O
N3- - 3e = N / 5 / 10
N5+ + 5e = N / 3 / 6
5(NH4)2SO4 + 6HNO3 → 8N2 + 5H2SO4 + 18H2O
Fe - 3e = Fe3+ / 10
2N5+ + 10e = N2 / 3
10Fe + 6KNO3 → 3N2 + 5Fe2O3 + 3K2O
ф№ 415
Слабая азотистоводородная кислота, гидразин и гидроксиламин проявляют как окислительные, так и восстановительные свойства. Почему? Составьте электронно-ионные, ионные и молекулярное уравнения реакции, происходящей в сернокислой среде между HN3 и КМnО4. В результате реакции образуется свободный азот.
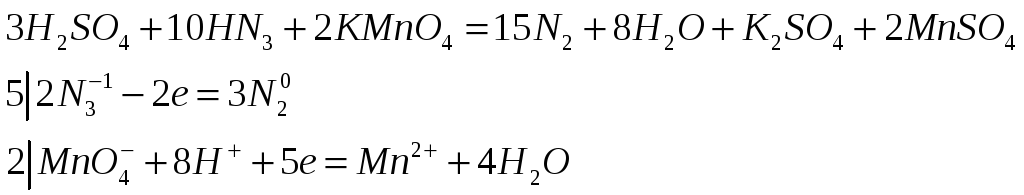
В
гидразине
![]() ,
гидроксиламине
,
гидроксиламине
![]() ,
азотистоводородной кислоте
,
азотистоводородной кислоте
![]() азот имеет промежуточные степени
окисления, поэтому эти соединения могут
быть и окислителями и восстановителями.
азот имеет промежуточные степени
окисления, поэтому эти соединения могут
быть и окислителями и восстановителями.
416
2I- - 2e = I2 / 3
2NO2- + 8H+ +6e = N2 + 4H2O / 1
6I- + 2NO2- + 8H+ = N2 + 4H2O + 3I2
2KNO2 + 6HI + H2SO4 → 3I2 + N2 +K2SO4 + 4H2O
PbO2 + 4H+ + SO42- + 2e = PbSO4 + 2H2O / 1
NO2- + H2O – 2e = NO3- + 2H+ / 1
PbO2 + 4H+ + SO42- + NO2- + H2O = NO3- + 2H+ + PbSO4 + 2H2O
PbO2 + 2H+ + SO42- + NO2- = NO3- + PbSO4 + H2O
PbO2 + H2SO4 + KNO2 → KNO3 + PbSO4 + H2O
2Hg2+ + 2e = Hg22+ / 2
2N2- - 4e = N2 / 1
N2H4 + 4HgCl2 → 2Hg2Cl2 + N2 + 4HCl
N4+ + e = N3+ / 1 / 2
N4+ - e = N5+ / 1 / 2
4NO2 + 2Ba(OH)2 → Ba(NO2)2 + Ba(NO3)2 + 2H2O
417
2N- - 2e = N2 / 5
Mn7+ + 5e = Mn2+ / 2
10NH2OH + 2KMnO4 + 3H2SO4 → 2MnSO4 + 5N2 + K2SO4 + 18H2O
2N2- - 4e = N2 / 1
Fe3+ + e = Fe2+ / 4
N2H4 + 4K3[Fe(CN)6] + 4KOH → N2 + 4K4[Fe(CN)6] + 4H2O
2N2+ + 4e = N2 / 1
Cr2+ - e = Cr3+ / 4
2NO + 4CrCl2 + 4HCl → N2 + 4CrCl3 + 2H2O
№418
