
- •Звездочкой обозначены разрыхляющие молекулярные орбитали. Для молекулы f2:
- •Таким образом, более высокая энергия связи объясняется более высоким её порядком.
- •Звездочкой обозначены разрыхляющие молекулярные орбитали. Для молекулы о2:
- •Таким образом, более высокая энергия связи объясняется более высоким её порядком.
- •Звездочкой обозначены разрыхляющие молекулярные орбитали. Для молекулы о2:
- •Восстановительные свойства могут проявлять катионы ванадия и хрома, так как они находятся в промежуточной степени окисления
- •Чем отличается взаимодействие германия и свинца с концентрированной азотной кислотой? Почему? Составьте электронные и молекулярные уравнения реакций:
- •Составьте электронные и молекулярные уравнения реакций:
- •Составьте электронные и молекулярные уравнения реакций:
- •Кислород в перекиси водорода имеет промежуточную степень окисления –1.
- •Вследствие несимметричности распределения связей о – н, Ме – о молекулы пероксидов сильно полярны. Пероксид – радикал может, не изменяясь переходить из соединения в соединение:
- •Закончите уравнения реакций:
- •Приведенные реакции относятся к реакциям внутримолекулярного окисления-восстановления.
- •Сера способна как окислятся, так и восстанавливаться, ввиду того, что нулевая степень окисления является промежуточной.
Кислород в перекиси водорода имеет промежуточную степень окисления –1.
2KI + H2O2 → 2KOH + I2
H2O2 + 2e → 2OH- / 1
2I- - 2e → I2 / 1
H2O2 + 2I- → I2 + 2OH-
2KMnO4 + 5H2O2 + 3H2SO4 = 2MnSO4 + 5O2 + K2SO4 + 8H2O
MnO4- + 8H+ + 5e → Mn2+ + 4H2O / 2
H2O2 – 2e → 2H+ + O2 / 5
2MnO4- + 16H+ + 5H2O2 → 10H+ + 5O2 + 2Mn2+ + 8H2O
2MnO4- + 6H+ + 5H2O2 → 5O2 + 2Mn2+ + 8H2O
453
H
│
O – O
│
H
do-o = 0,148 нм do-H = 0,095 нм угол между кислородом и водородом равен 95º
Вследствие несимметричности распределения связей о – н, Ме – о молекулы пероксидов сильно полярны. Пероксид – радикал может, не изменяясь переходить из соединения в соединение:
BaO2 + H2SO4 = BaSO4 + H2O2
PbO2 + H2SO4 = Pb(SO4)2 + 2H2O
455
3O3 + 2CrCl3 + 10KOH → …
O3 + H2O + 2e = O2 + 2OH- / 3
Cr3+ + 8OH- - 3e = CrO42- + 4H2O / 2
3O3 + 3H2O + 2Cr3+ + 16OH- = 2CrO42- + 8H2O + 3O2 + 6OH-
3O3 + 2Cr3+ + 10OH- = 2CrO42- + 5H2O + 3O2
3O3 + 2CrCl3 + 10KOH → 2K2CrO4 + 3O2 + 6KCl + 5H2O
3O3 + 2MnO2 + 2NaOH → …
O3 + H2O + 2e = O2 + 2OH- / 3
MnO2 + 4OH- - 3e = MnO4- + 2H2O / 2
3O3 + 3H2O + 2MnO2 + 8OH- = 2MnO42- + 4H2O + 3O2 + 6OH-
3O3 + 2MnO2 + 2OH- = 2MnO42- + H2O + 3O2
3O3 + 2MnO2 + 2NaOH → 2NaMnO4 + 3O2 + H2O
O3 + H2O2 → …
O3 + 2H+ + 2e = O2 + H2O / 1
H2O2 - 2e = O2 + 2H+ / 1
O3 + 2H+ + H2O2 = O2 + 2H+ + O2 + H2O
O3 + H2O2 = 2O2 + H2O
O3 + H2O2 → 2O2 + H2O
456
2H2O2 → 2H2O + O2 диспропорционирование
H2O2 – 2e → 2H+ + O2 / 1
H2O2 + 2e → 2OH- + O2 / 1
2KMnO4 + 5H2O2 → 2MnO2 + 4O2 + 4H2O + 2KOH
MnO4- + 4H+ + 3e → MnO2 + 2H2O / 2
H2O2 - 2e → 2H+ + O2 / 3
2MnO4- + 2H+ + 3H2O2 → 3O2 + 2MnO2 + 4H2O
4H2O2 + PbS → PbSO4 + 4H2O
№457
Какие свойства пероксида водорода выражены сильнее: окислительные или восстановительные? Ответ мотивируйте значениями соответствующих потенциалов. Пероксид натрия поглощает сероводород, максимально его окисляя. Составьте электронные и молекулярные уравнения этой реакции
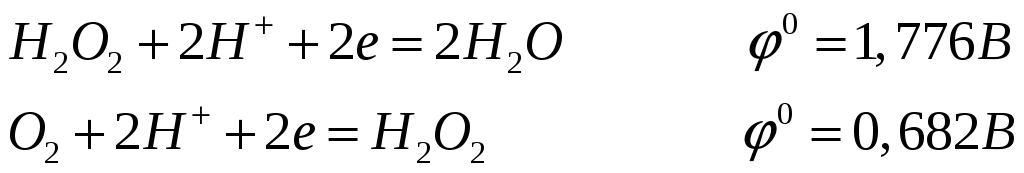
Потенциал первой полуреакции выше, поэтому окислительные свойства пероксида водорода выражены сильнее.
Реакция пероксида натрия с сероводородом:
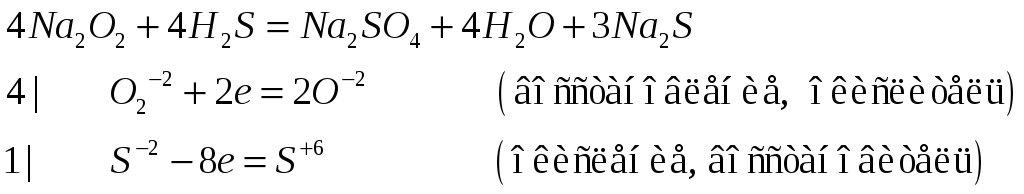
459
Озон О3 – это аллотропная модификация кислорода. Бесцветный газ, сильнейший окислитель. Озон получают пропусканием кислорода (воздуха) между обкладками высоковольтного конденсатора (это устройство называют озонатором). Этот газ всегда образуется при электрическом разряде в воздухе, ультрафиолетовом и рентгеновском излучении.
3O2 = 2O3
O3 + H2O + 2e = O2 + 2OH- / 1
2I- - 2e = I2 / 1
O3 + 2KI + H2O → 2KOH + I2 + O2
O3 + 2e = O2 + O2- / 1
S2- - 2e = S / 1
O3 + PbS → PbO + S + O2
O3 + 2e = O2 + O2- / 1
N4+ - e = N5+ / 2
O3 + 2NO2 → N2O5 + O2
№460
Пероксодисерная кислота и ее соли являются сильными окислителями. Закончите уравнения реакций:
![]()
![]()
![]() (восстановление,
окислитель)
(восстановление,
окислитель)
![]() (окисление,
восстановитель)
(окисление,
восстановитель)
![]()
![]() (восстановление,
окислитель)
(восстановление,
окислитель)
![]() (окисление, восстановитель)
(окисление, восстановитель)
461
O3 + 2H+ + 2e = O2 + H2O
O3 + 6H+ + 6e = 3H2O
O3 + H2O + 2e = O2 + 2OH-
H2O2 + 2H+ + 2e = 2H2O
H2O2 + 2e = 2OH–
S2O82- + 2e = 2SO42-
S2O82- + 2H+ + 2e = 2HSO4-
S2O82- + 2e = 2SO42- / 1
Fe2+ - e = Fe3+ / 2
(NH4)2S2O8 + 2FeSO4 → Fe2(SO4)3 + (NH4)2SO4
H2O2 + 2e = 2OH– / 3
Cr3+ + 8OH- - 3e = CrO42- + 4H2O / 2
3H2O2 + 2Cr3+ + 16OH- = 2CrO42- + 8H2O +6OH–
3H2O2 + 2Cr3+ + 10OH- = 2CrO42- + 8H2O
3H2O2 + 2CrCl3 + 10KOH → 2K2CrO4 + 6KCl + 8H2O
462
H2O2 + 2e = 2OH– / 1
Mn2+ + 2H2O - 2e = MnO2 + 4H+ / 1
H2O2 + Mn2+ + 2H2O = MnO2 + 4H+ + 2OH–
H2O2 + Mn2+ + 2H2O = MnO2 + 2H+ + 2H2O
H2O2 + Mn2+ = MnO2 + 2H+
H2O2 + MnSO4 = MnO2 + H2SO4
H2O2 - 2e = 2H+ + O2 / 3
Cr2O72- + 14H+ + 6e = 2Cr3+ + 7H2O / 1
3H2O2 + Cr2O72- + 14H+ = 2Cr3+ + 7H2O + 6H+ + 3O2
3H2O2 + Cr2O72- + 8H+ = 2Cr3+ + 7H2O + 3O2
3H2O2 + K2Cr2O7 + 8HCl = 2CrCl3 + 7H2O + 3O2 + 2KCl
№463
