
- •Тема1. Строение атома
- •Примеры тестовых заданий к приложению1
- •Приложение 2. Химическая связь
- •Примеры тестовых заданий к приложению 2
- •Приложение 3. Понятие о гибридизации
- •Sp-гибридизация
- •6С 1s22s22p2 → c* 1s22s12p3
- •8O 1s22s22p4
- •6С 1s22s2p2 → c* 1s22s12p3
- •6С 1s22s22p2 → c* 1s22s12p3
- •1H 1s1
- •7N 1s22s22p3
- •1H 1s1
- •8О 1s22s22p4
- •1H 1s1
- •Примеры тестовых заданий к приложению 3
- •Приложение 4. Гидролиз солей
- •Примеры тестовых заданий к приложению 5
6С 1s22s22p2 → c* 1s22s12p3
8O 1s22s22p4
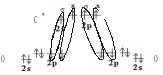
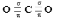
Атом углерода образует по обменному механизму две - и две -связи:
Из четырех валентных электронов углерод два затратил на образование -связей. Причем в образовании -связей участвуют s- и р-электроны углерода, т.к. s-орбитали не могут образовать -связь. Таким образом, гибридизоваться будут только орбитали, участвующие в образовании -связей: 2s и 2р. Тип гибридизации – sp.

= 180о, молекула – линейная
sp-гибридизация характерна для атомных орбиталей углерода, находящихся при тройной связи, в молекуле ацетилена,:
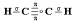
6С 1s22s2p2 → c* 1s22s12p3
1H 1s1
Каждый атом углерода образует по две -связи и по две -связи по обменному механизму. Следовательно, тип гибридизации – sp-гибридизация. Геометрия молекулы – линейная. Валентный угол = 180о.

Негибридизованные р-орбитали атомов углерода перекрываются во взаимноперпендикулярных плоскостях, образуя -связи.
sp2-гибридизация
Гибридизуются одна s- и две р-орбитали, образуются три гибридные орбитали, которые располагаются в одной плоскости под углом 120о.


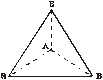

Молекула общего вида АХ3 имеет треугольную (тригональную), плоскую структуру. -. sp2-гибридизация характерна для орбиталей углерода в молекулах этилена, бутадиена-1,3, бензола.
Строение
молекулы С2Н4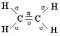
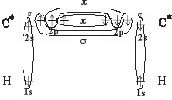
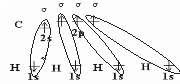
6С 1s22s22p2 → C* 1s22s12p3
1H 1s1
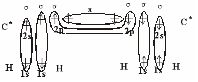
Каждый атом углерода образует три -связи и одну -связь. Т.к. в образовании -связей участвуют одна s-орбиталь и две р-орбитали углерода, тип гибридизации sp2. У каждого атома углерода остается р-орбиталь, которая не гибридизуется. Три sp2-гибридные орбитали располагаются в плоскости под углом = 120о, определяя геометрию молекулы. Негибридные р-орбитали перекрываются над и под плоскостью молекулы, образуя -связь.

sp3-гибридизация
Гибридизуются одна s- и три р-орбитали. Четыре sp3-гибридных облака направлены к вершинам тетраэдра(тетрагональная геометрия молекулы) и располагаются в пространстве под углом 109о28/
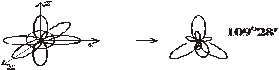
Молекула общего вида АВ4 имеет форму тетраэдра.
Поскольку
гибридизоваться могут не только орбитали
электронов, участвующих в образовании
химических связей, но и орбитали с
неподделенными электронными парами,
данный тип гибридизации характерен для
центральных атомов молекул аммиака и
воды.
Строение
молекулы метана
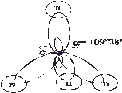
6С 1s22s22p2 → c* 1s22s12p3
1H 1s1
Атом углерода образует четыре одинарные связи с атомами водорода, все эти связи - -связи. Следовательно, орбитали всех валентных электронов углерода гибридизуются. Четыре sp3-гибридные орбитали углерода располагаются вокруг ядра углерода под углом 109о28/, орбитали водорода перекрываются с sp3-гибридными орбиталями углерода. Образуется прочная молекула метана с четырьмя одинаковыми связями:
Строение молекулы NH3
7N 1s22s22p3
1H 1s1

Атом азота образует с атомами водорода три -связи по обменному механизму. В гибридизации участвуют три р-орбитали атома азота и s-орбиталь, занятая неподеленной парой электронов. Тип гибридизации – sp3. Молекула NH3 имеет структуру пирамиды, в вершине которой находится атом азота, а в углах основания – атомы водорода. Валентный угол составляет 107о3/. Таким образом, валентный угол в молекуле NH3 меньше, чем в молекуле СН4 с учетом неодинакового отталкивания между неподеленной парой и связывающими парами электронов.
Строение молекулы Н2О
