
- •Тема1. Строение атома
- •Примеры тестовых заданий к приложению1
- •Приложение 2. Химическая связь
- •Примеры тестовых заданий к приложению 2
- •Приложение 3. Понятие о гибридизации
- •Sp-гибридизация
- •6С 1s22s22p2 → c* 1s22s12p3
- •8O 1s22s22p4
- •6С 1s22s2p2 → c* 1s22s12p3
- •6С 1s22s22p2 → c* 1s22s12p3
- •1H 1s1
- •7N 1s22s22p3
- •1H 1s1
- •8О 1s22s22p4
- •1H 1s1
- •Примеры тестовых заданий к приложению 3
- •Приложение 4. Гидролиз солей
- •Примеры тестовых заданий к приложению 5
Примеры тестовых заданий к приложению1
1. Число нейтронов в ядре атома 39Ca равно
1.19 2.20 3.39 4.40
2.Ядро изотопа фосфора 31 Р содержит
1.15 2.46 3.16 4.31
3. Электронная конфигурация 1s22s22p63s23p6соответствует частице
1) Li+ 2) K+ 3) Cs+ 4) Na+
4.Иону О2- соответствует электронная конфигурация…
1. 1s22s22p3 2. 1s22s22p4 3. 1s22s22p5 4. 1s22s22p6
5. Изотопы одного и того же элемента отличаются друг от друга
1) числом нейтронов и атомной массой 3) числом протонов и числом электронов
2) числом электронов и числом нейтронов 4) зарядом ядра и числом протонов
6.Орбитальное квантовое число может принимать значения…
1.1,2,3,…,∞ 2. 0,…,(n-1) 3. -l,0,+l 4. ±1/2
7. Химический элемент, формула высшего оксида которого R2O7, имеет электронную конфигурацию атома
1) 1s2 2s22р63s1 2) 1s22s22р63s23р5 3) 1s2 2s22р63s23р64s1 4) 1s2 2s1
8.Формула водородного соединения элемента, образующего высший оксид Э2О5, имеет вид…
1.ЭН 2.ЭН2 3. ЭН3 4. ЭН4
9.На внешнем энергетическом уровне атома элемента, образующего высший гидроксид состава НЭО4 содержится ____ электронов
1. 4 2. 5 3. 6 4. 7
10.В основном состоянии неспаренные электроны отсутствуют у атома
1. кремния 2.алюминия 3.магния 4.фосфора
11.Атом углерода в основном состоянии содержит__ неспаренных электронов
1. 2 2. 3. 3. 4 4. 0
12. наибольшее число неспаренных электронов в основном состоянии содержит атом…
1.хлора 2.фосфора 3.кремния 4.кислорода
13.Магнитное квантовое число может принимать значения…
1.1,2,3,…,∞ 2. 0,…,(n-1) 3. --ℓ,…0,…,ℓ 4. ±1/2
14. Неспаренные электроны в основном состоянии содержит частица…
1.Zn2+ 2.Ni2+ 3.Ca2+ 4.Ba2+
15. Число неспаренных электронов в атоме алюминия в основном состоянии равно
1)1 2)2 3)3 4)0
16. Сульфид-иону соответствует электронная формула
1) 1s2 2s22р63s23р6 3) 1s2 2s2 2р6
2)1s22s22р63s23р4 4)1s2 2s2 2р63s23р2
17. Электронная конфигурация 1s22s22р63s23р6 соответствует иону '
1)Sc2+ 2) Al3+ 3)Cr3+ 4) Ca2+
18. На 4s-энергетическом подуровне расположены все валентные электроны атома
1) железа 2) кальция 3) углерода 4) серы
19. Атом элемента, максимальная степень окисления которого +4, в основном состоянии имеет электронную конфигурацию внешнего энергетического уровня
1) 3s23р4 2)2s22р2 3)2s22р4 4) 2s22р6
20. Электронную формулу 1s22s22р63s23р64s2 имеет атом элемента
1) Ba 2) Mg 3) Са 4) Sr
Ответы к тестовым заданиям к приложению1: 1.1; 2.3;3.2;4.4;5.1;6.2;7.2; 8.3; 9.4; 10.3; 11.1; 12.2; 13.3; 14.2; 15.1; 16.1; 17.4; 18.2; 19.2;20.3
Приложение 2. Химическая связь
Ковалентная связь – связь, образованная за счет общей электронной пары.
Важнейшие характеристики химической связи: длина, энергия, полярность и поляризуемость. Энергия связи – это энергия, выделяющаяся при образовании связи или необходимая для разъединения двух связанных атомов. Длина связи – это расстояние между центрами связанных атомов Полярность связи обусловлена неравномерным распределением (поляризацией) электронной плотности. Полярность молекулы количественно оценивают величиной ее дипольного момента. Полярность связи можно показать стрелкой, указывающей направление смещения электронной пары: Н+ → F. Таким образом, двухатомная молекула HF обладает электрическим дипольным моментом, который обусловлен пространственным разделением положительного и отрицательного зарядов. Чем больше дипольный момент, тем полярнее связь. Причиной полярности связи служит различие в электроотрицательностях связанных атомов. Электроотрицательность – мера способности атома смещать к себе электронную плотность химической связи. С увеличением электроотрицательности атома возрастает степень смещения в его сторону электронов связи. Шкала электроотрицательности по Полингу
|
Элемент |
K |
Na |
H |
P |
C |
S |
I |
Br |
Cl |
N |
O |
F |
|
О.э.о. |
0,8 |
0,9 |
2,1 |
2,1 |
2,5 |
2,5 |
2,5 |
2,8 |
3,0 |
3,0 |
3,5 |
4,0 |
∆э.о.=0 – ковалентная неполярная связь
∆э.о.≤ 0,4 – малополярная ковалентная связь
∆э.о.>0,5 – сильно полярная ковалентная связь
∆э.о.> 2,0 – ионная связь
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость π-связи выше, т.к. π-электроны находятся дальше от ядра и более подвижны.
Классификация ковалентной связи по типу перекрывания электронных облаков
Поскольку электронные облака имеют различную форму, их взаимное перекрывание может осуществляться разными способами. В зависимости от способа перекрывания различают и -связи.
-связь осуществляется при лобовом перекрывании орбиталей вдоль линии, соединяющей центры атомов. Все одинарные связи являются -связями.





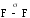
-связь возникает при боковом перекрывании р-орбиталей по обе стороны от линии соединения ядер атомов.
Например, возникновение π-связи в молекуле этилена СН2=СН2:

Или, например, в молекуле азота одна -связь и две -связи.


Электроны s-орбиталей могут участвовать лишь в -связывании, а р-электроны – как в -, так и в -связывании.
-связи являются энергетически самыми выгодными связями, т.к. имеет место глубокое перекрывание облаков. Если между двумя атомами возникает единственная связь, то непременно -связь.
-связи возникают в том случае, если между двумя атомами образуются кратные связи (двойные или тройные). Например, в молекуле СО2 атом углерода образует с каждым атомом кислорода одну -связь и одну -связь:

