
Методичка_Громов
.pdf
N |
hν1 |
N |
|
hν2 |
|||
|
|
Рисунок 10 – Сигматропный сдвиг.
Для того, чтобы разобраться в синхронных реакциях, заглянем в историю. В 30-е годы 20-го века английский химик Эванс предположил, что реакция Дильса-Альдера протекает как синхронный процесс через циклическое переходное состояние. Это переходное состояние содержит, как и бензол, 6 делокализованных электронов и является по своей природе ароматическим. Если применить этот подход к гипотетическому переходному состоянию для реакции [2+2]-циклоприсоединения двух молекул этилена, то окажется, что оно содержит 4 электрона и эквивалентно крайне нестабильному бутадиену. Следовательно, это состояние не будет ароматическим, и данная реакция не может протекать термически (что наблюдали экспериментально).
Ароматичность – одна из важнейших концепций в органической химии. Правило Хюккеля, согласно которому плоские циклические полиены с (4n+2)-электронами (n – целое число) более стабильны, чем соответствующие ациклические соединения, в то время как циклические системы с 4nπ-электронами менее стабильны, нашло теоретическое и практическое подтверждение.
4n+2 |
+ |
|
|
|
диенофил |
переходное |
|
диен |
состояние |
||
|
+
4n
переходное
состояние
Рисунок 11 – Протекание согласованных реакций.
В 1965 г. Вудвардом и Хоффманом была выдвиинута идея оценки протекания согласованных реакций. Когда орбитали реагирующих молекул соответствуют друг другу по симметрии, в заданном электронном состоянии реакции протекают легче, чем когда соответствие нарушается.
41

Главная особенность перициклических реакций – возможность выделения циклической системы в промежутке между реагентами и продуктами реакции. И такое циклическое переходное состояние можно классифицировать как ароматическое или антиароматическое. Идею относительной устойчивости переходных состояний развил Циммерман. Чтобы воспользоваться этой концепцией, нужно рассмотреть (для переходного состояния) циклическую π-электронную систему с перекрученной нечетное число раз полиеновой лентой. Такие системы с топологией ленты Мёбиуса называют антихюккелевскими или мёбиусовскими.
Инверсия
знака
Рисунок 12 – π-система Мёбиуса.
Полиены с нулевым или четным числом инверсий фаз орбиталей (узлов) классифицируются как хюккелевские, с нечетным числом – как мёбиусовские.
Таблица 1 – Прогноз протекания реакций в полиенах.
Число узлов |
Топология |
Число электронов |
|
|
|
|
|
|
|
Термическая реакция |
Фотохимическая |
|
|
|
реакция |
|
|
|
|
Четное |
Хюккелевская |
4n+2 |
4n |
|
|
|
|
Нечетное |
Мёбиусовская |
4n |
4n+2 |
|
|
|
|
Рассмотрим несколько примеров. Циклоприсоединение этилена - простейшее переходное состояние, четыре атома углерода копланарны, причем верхние доли π-системы взаимодейтсвуют с нижними долями другой. Хюккелевское переходное состояние, антиароматично, 4 электрона, следовательно, термическая реакция – запрещена, фотохимическая – разрешена.
42

|
R |
R |
|
1 |
3 |
|
|
Инверсия |
|
|
знака |
циклоприсое- |
|
|
динение этилена циклоприсое-динение |
1,3-миграция заместителей в аллильной |
|
бутадиена и этилена |
||
системе
H |
H |
|
H H |
|
hν |
Инверсия |
|
знака |
|
Конротаторное |
Дисротаторное |
циклизация бутадиена Рисунок 13 – Примеры переходных состояний в согласованных реакциях.
Циклоприсоединение бутадиена и этилена (изменение фазы сводится к минимуму) - верхние доли π-системы этилена взаимодействуют с нижними долями концевых атомов углерода в бутадиене. Переходное состояние хюккелевское, ароматично, включает 6 электронов. Термическая реакция – разрешена, фотохимическая – запрещена.
Миграция в аллильной системе. Группа R мигрирует через верхнюю сторону аллильной системы от С-1 к С-3. Возможны два переходных состояния в зависимости от того, какую орбиталь – s или p использует R для образования мостика. Первое-хюккелевское (4 электрона, термически – запрещена), второе-мёбиусовское (4 электрона, термически – разрешена).
Циклизация бутадиена. Мёбиусовское переходное состояние, концевые CH2-групп диена поворачиваются на 90°.Эти группы могут поворачиваться в одном направлении (конротаторное движение) или в разных (дисротаторное). В данном случае продукты двух типов циклизаций неразличимы, но они могут быть разными в случае замещенных бутадиенов.
Термически активированные конротаторные и фотохимически индуцированные дисротаторные процессы раскрытия кольца циклобутена продемонстрированы на примере
43

его цис- и транс-3,4-диметилпроизводных. Для трансесли конротаторный поворот против часовой стрелки, мог бы образоваться (Z,Z)-продукт, на деле не образуется из-за пространственного отталкивания метильных заместителей.
Me
|
|
Me |
|
|
|
|
H |
|
|
|
hν |
H |
|
|
|
цис- |
|
Me |
|
Me |
|
|
||
дисротаторный |
|
конротаторный |
||
|
|
|
||
H |
|
|
|
H |
H |
|
|
|
Me |
Me |
|
|
hν |
H |
(E,E) |
конротаторный |
Me |
дисротаторный |
(Z,E) |
|
|
|||
|
|
H |
|
|
H
Me
транс-
Рисунок 14 – Реакции производных циклобутена.
При использовании предложенного подхода необходимо учитывать два момента:
1.Сам по себе он задает только вероятность протекания той или иной реакции по согласованному механизму. Будет ли реакция иметь место, во многом зависит от стерических факторов.
2.Запрет по симметрии не означает действительную невозможность протекания реакции. Запрещенные по энергии реакции требуют большой энергии активации или протекают предпочтительно не как согласованные процессы, а включают промежуточное образование радикальных или ионных частиц.
Общие схемы перициклических реакций сохраняются при замене атомов углерода в молекулах непредельных соединений на гетероатомы. Гетероатомы искажают симметрию переходных состояний, полярные интермедиаты могут стабилизироваться, реакции из согласованных становятся ступенчатыми. И все же можно привести несколько примеров для 4n+2-электроциклических реакций.
44

С участием одного гетероатома
|
|
|
|
|
|
Ar |
|
|
hν1 |
|
|
|
hν |
|
|
|
|
Ar |
|
|
O |
Ar |
hν2, |
O |
Ar |
O |
|
|
|
|
||||
Ar |
|
Ar |
|
|
||
|
|
|
|
|
С участием двух гетероатомов
N |
hν1 |
|
N |
N O |
hν2, |
N |
O |
|
|||
CH3 |
|
CH3 |
|
N |
hν |
|
|
O |
|
Реакция аналога пентадиенильного аниона
H |
N |
hν1 |
|
N + |
|
- |
|||
|
|
hν2, |
|
|
|
|
|
E |
|
|
|
E |
|
|
|
E |
|
|
E |
hν
N |
E = COOEt, CN
Рисунок 15 – Примеры электроциклических реакций с участием гетероатомов.
Фотохромные хромены вступают в обратимую реакцию, причем анализ раскрытия пиранового цикла говорит о возможности протекания реакции как фотохимическим так и термическим образом.
Спиронафтоксазины также вступают в обратимую электроциклическую реакцию с образованием окрашенной мероцианиновой формы. Формально азот участвует pz-орбиталью с одним электроном, т.к. гибридная sp2 ортогональна.
Дигидроиндолизины претерпевают фотоиндуцированную реакцию раскрытия с образованием бетаиновых структур. Атом азота участвует в циклическом переходном состоянии неподеленной парой электронов.
Основным признаком, позволяющим отделить супрамолекулы от обычных больших молекул, является возможность выделения в супрамолекулярных системах индивидуальных молекулярных компонентов (структурных единиц супрамолекулы), способных к самостоятельному существованию. Однако, свойства супрамолекул не являются простой суперпозицией свойств активных компонентов. Наличие в супрамолекулах нескольких компонентов приводит к появлению качественно новых свойств.
45

Вживой природе фоточувствительные системы обеспечивают, например, фотосинтез
урастений и зрение у животных: поглощая фотон, молекулы хлорофилла и родопсина претерпевают структурные перестройки. (Поглощение молекулой родопсина кванта света с длиной волны, близкой к 500 нм, приводит к чрезвычайно быстрой (200 фс) изомеризации ковалентно связанного хромофора 11-цис-ретиналя в полностью транс-форму.) В этих системах свет выполняет роль пускового механизма, приводящего в действие целый ряд жизненно важных процессов.
hν
Фотоантенна
Функциональный
блок
Рисунок 16 – Фоточувствительная система.
Таким образом, фоточувствительные супрамолекулярные системы должны обладать антенной для поглощения фотона и превращения энергии этого фотона в изменение структуры молекулы, а также функциональным блоком, способным вследствие этого менять свою реакционную способность. Тогда управлять такими молекулами можно с помощью света определенной длины волны.
|
|
Ar' |
hν1 |
|
|
|
|||
N |
|
N |
|
N |
|
N |
|||
|
|
|
|
Ar |
|
||||
|
|
|
|
|
|||||
Ar |
hν2 |
|
|
Ar' |
|||||
|
O |
ион металла |
O |
O |
O |
O |
O |
 O O
O O

 O
O



 O
O





Ar' |
hν1 |
|
|
краун-соединение |
|
|
Ar |
hν2 |
Ar |
Ar' |
|
|
|
транс-изомер |
|
цис-изомер |
ГОСТЬ |
+ |
ГОСТЬ |
|
Рисунок 17 – Компоненты фоточувствительных систем.
В качестве антенны можно использовать соединения со связью N=N и C=C, в качестве рецепторного блока – например, краун-эфир, претерпевающий структурную перестройку при комплексообразовании.
46
Объединение биоматериалов с фотохромными соединениями в единую супрамолекулярную систему может быть использовано при конструировании сложных оптобиоэлектронных устройств. Один из подходов в этой области – создание иммуносенсорного электрода.
Золотой электрод, покрытый в результате самосборки монослоем (а), содержащим антиген (Atg), дает амперометрический сигнал в присутствии редокс-пробы (R+/R). Присоединение антитела (Ab) к монослою (b) изолирует электрод от находящейся в растворе редокс-пробы, что приводит к отсутствию электрического сигнала. Из-за достаточно прочного взаимодействия «Atg-Ab» такой электрод может быть использован однократно.
A |
Atg |
A |
|
|
(Ab) |
|
|
|
|
|
|
a |
|
b |
комплекс "Atg-Ab" |
антигенсодержащий монослой |
|
дезактивированного |
|
|
электрода |
||
амперометрически активного |
hν1 |
|
|
электрода |
|
|
|
hν2
B
+
c
измененный антиген
Рисунок 18 – Иммуносенсорный электрод.
Однако антиген может быть химически модифицирован фотохромным соединением (А), что будет препятствовать необратимому связыванию антитела и не мешать амперометрическому анализу. В этом случае Фотоизомеризация A в B вызовет изменение структуры монослоя антигена, что приведет в результате к освобождению антитела (с). Активный содержащий антиген Atg монослой (а) регенерируется в результате обратной фотоизомеризации В в А. Таким образом, становится возможным многократное использование электрода.
47

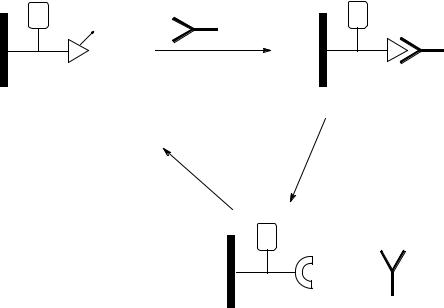
Механические аналогии можно провести, рассматривая нанизанные и взаимозацепляющие системы, такие как ротаксаны и катенаны и устройства на их основе. Рассмотрим пример фотоуправляемой молекулярной машины.
hν |
e- |
|
|
|
|
A1 |
A2 |
P |
|
D |
S |
|
|
||
|
P _ |
фотосенсибилизатор |
D _ донор |
|
A _ акцепторы |
S _ ступор |
|
Рисунок 19 – Фотоуправляемая молекулярная машина.
Для эффективного функционирования молекулярной машины необходимо, чтобы акцептор А1 своей электронодефицитностью превосходил акцептор А2. Кроме того, обязательным является присутствие ступора S и фотосенсибилизатора P, выполняющего также роль второго ступора, что препятствует соскакиванию донора D с челнока. Поглощение света фотосенсибилизатором (антенной) P приводит к внутримолекулярному переносу электрона на акцептор A1, что вызывает потерю его акцепторности. Это индуцирует перемещение донора на акцептор A2, связывание с которым в этих условиях оказывается предпочтительным. После обратного термического переноса электрона с акцептора А1 на фотосенсибилизатор Р донор D вновь возвращается на акцептор А1 и система вновь приходит в исходное состояние.
Можно с уверенностью утверждать, что новые достижения в фотонике и в химии органических фотоактивных материалов будут играть ключевую роль в нанотехнологии. Ранее предполагалось использовать фотохромное поведение различных органических молекул в обратимых системах записи оптической информации, однако теперь открываются и другие возможности их применения.
Среди большого числа свойств, которыми должны обладать фотохромные соединения для записи и хранения информации является отсутствие разрушения при облучении считывающим устройством. Поэтому поиск новых фотохромов является активной областью исследований.
48

СПИСОК ЛИТЕРАТУРЫ
1.Громов, С.П. Фотохромизм молекулярных и супрамолекулярных систем / С.П. Громов - М.: МФТИ, 2002.
2.Органические фотохромы. / под ред. А.В. Ельцова - Л.: Химия, 1982.
3.Kay, E.R. Synthetic Molecular Motors and Mechanical Machines / E.R. Kay, D.A. Leigh, F. Zerbetto // Angew. Chem. Int. Ed. – 2007. – V. 46 –P. 72 – 191.
ГЛ А В А 4. ОРГАНИЧЕСКИЕ ЛЮМИНОФОРЫ
Для понимания взаимосвязи структура – свойство при обсуждении строения люминофоров поговорим немного об электронных эффектах заместителей. Одним из свойств ковалентной связи является возможность смещения электронной плотности связи в сторону одного из партнеров. Электронная связь между двумя тождественными атомами распределяется равномерно и считается неполярной (этан, этилен). Если связаны два атома с разной электроотрицательностью (см. шкалу электроотрицательности элементов по Полингу), то ковалентная связь поляризуется, вследствие чего на более электроотрицательном атоме возникает избыток электронной плотности δ- (частично отрицательный заряд), а на связанном с ним атоме – дефицит электронной плотности δ+ (частично положительный заряд). Влияние диполя ковалентной связи передается по цепи σ- связей по механизму электростатической индукции и затухает через 3-4 связи.
-I – Эффект заместителя |
+I – Эффект заместителя |
|||||
H3C |
CH2 |
CH2 |
NO2 |
H C |
CH |
MgCl |
|
|
|
|
3 |
2 |
|
|
|
|
|
|
CH3 |
|
|
|
|
|
H3C |
|
_ |
H3C |
CH |
|
NH+ |
C |
O |
|
|
2 |
|
3 |
|
|
|
CH3
Рисунок 1 – Примеры заместителей с индуктивным эффектом.
Индуктивный эффект (I-эффект) – это передача электронного влияния заместителей по цепи σ-связей. Электронооттягивающие заместители называют электроноакцепторными,
49

а электроноподающие – электронодонорными. Алкильные группы, связанные с атомами углерода в sp2- или sp-гибридном состоянии в растворе проявляют +I-эффект. Наибольшего значения индуктивные эффекты достигают в том случае, когда на атоме или группе атомов имеется полный заряд. Ионы индуцируют особенно сильное смещение электронной плотности, которое распространяется далеко по цепи.
Влияние заместителей на реакционный центр, передающееся не через связи, а непосредственно через пространство или через молекулы растворителя по механизму диполь-дипольного взаимодействия называется эффектом поля (F-эффект). Эффект поля зависит от геометрии молекулы, экспериментально разделить индуктивный эффект и эффект поля очень трудно (это было сделано для жестких систем, где пространственное положение заместителя закреплено), и обычно учитывают некое суммарное влияние по связям и через пространство.
В сопряженных системах при перераспределении электронной плотности под влиянием заместителей – участников сопряженных систем – основную роль играют π- электроны делокализованных ковалентных связей. Мезомерный эффект, или эффект сопряжения (М-эффект) – это передача электронного влияния заместителей по сопряженной системе. Заместитель может вносить в системусопряжения π-связь (π,π-сопряжение) или p- АО, которая может быть либо вакантной, либо занятой одним электроном или неподеленной парой электронов (p, π-сопряжение).
-M – Эффект заместителя |
+M – Эффект заместителя |
|
C C C |
X |
C C Y |
|
N |
H2C C O C4H9 |
|
|
бутилвиниловый эфир |
бензонитрил Рисунок 2 – Примеры заместителей с мезомерным эффектом.
В отличие от индуктивного, мезомерный эффект передается по сопряженной системе без затухания. Заместители, понижающие электронную плотность в сопряженной системе, проявляют –М мезомерный эффект и являются электроноакцепторными (например заместители, содержащие кратные связи атома углерода с более электроотрицательным гетероатомом). Заместители, повышающие электронную плотность в системе, проявляют положительный мезомерный эффект (+М) и являются электронодонорными. К ним относятся
50
