
Методичка_Громов
.pdf
H |
.. |
|
|
.. |
|
.. |
|
C |
N |
H |
|
O |
3 |
N |
|
H H |
H |
|
.. |
H |
CH3CH3 |
||
H |
H |
|
H |
|
|
H C |
|
метан |
аммиак |
|
вода |
триметиламин |
|||
Рисунок 1 – Примеры соединений с тетраэдрической конфигурацией.
Помимо метана мы предполагаем тетраэдрическую конфигурацию для молекул аммиака и воды. В метане угол HCH составляет 109.5°. По сравнению с этим значением, в
молекуле аммиака угол HNH составляет 107°, а в молекуле воды угол HOH 104.5°. Это говорит о том, что в молекулах аммиака и воды связи немного «поджаты» друг к другу, что обусловлено отталкиванием неподеленных пар.
В молекулах алифатических аминов (триметиламин) атом азота находится в состоянии sp3-гибридизации, угол CNC составляет 108° и близок к значению в молекуле аммиака. Теоретически вторичные и третичные амины с разными углеводородными радикалами могут существовать в виде энантиомеров, однако обычные алифатические и ароматические амины до сих пор не выделены в виде индивидуальных энантиомеров. Это объясняется тем, что молекулы аминов постоянно претерпевают пирамидальную инверсию, которую следует рассматривать как быстрое обращение конфигурации.
R' R'' |
R' |
R'' |
|
|
R'' R' |
. |
|
. |
. |
||
N |
N |
N |
|||
R |
|
R |
|
|
R |
|
|
|
|
|
Рисунок 2 – Пирамидальная инверсия алфатических аминов.
Инверсия осуществляется через тригональное переходное состояние. Частота инверсии молекул аммиака составляет 2,5×1011 обращений в секунду, а энергия активации этого процесса составляет ~25 кДж/моль. Для аминов с небольшими алифатическими радикалами значения примерно такие же.
21

N


 H
H
H
Рисунок 3 – Ароматические амины.
В молекулах ароматических аминов неподеленная пара электронов атома азота находится в сопряжении с π-электронами ароматического кольца, вследствие чего амплитуда, с которой совершается пирамидальная инверсия, значительно уменьшается.
Соединения с трехвалентным атомом азота могут существовать в виде энантиомеров в тех случаях, когда он включен в трехчленный азиридиновый цикл или соединен с гетероатомом, имеющим неподеленную пару электронов. В этих случакях энергия активации пирамидальной инверсии превышает 100 кДж/моль, что позволяет разделить вещества на индивидуальные оптически активные формы при комнатной температуре.
|
|
COOC2H5 |
|
|
CH3 |
|
|
N |
COOC2H5 |
C2H5O |
N |
N |
|
|
|
|
||||
H |
N |
CH2CH2COOCH3 |
N |
|||
|
CH3O |
|||||
|
OMe |
|
||||
|
соединен с гетероатомом, имеющим |
CH3 |
||||
включен в азиридиновый |
||||||
цикл |
|
|
неподеленную пару электронов |
|
||
включен в каркасную систему (основания Трегера)
Рисунок 4 – Энантиомеры с трехвалентным атомом азота.
Также в виде оптически активных форм известны основания Трегера – соединения, в молекулах которых атом азота включен в жесткую каркасную систему, поэтому пирамидальная инверсия здесь в принципе невозможна.
22

|
|
|
CH3 |
_ |
|
CH3 |
_ |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|||||
|
|
|
N+ |
I |
|
N+ |
|
I |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
||||
CH2=CHCH2 |
|
|
CH2CH=CH2 |
||||||
|
|
|
|||||||
|
CH2C6H5 |
|
CH2C6H5 |
|
|||||
|
|
C6H5 |
|
|
|
C6H5 |
|
||
|
|
|
|
|
|
||||
|
|
|
|
|
|
||||
|
|
|
|
|
|
||||
|
|
|
зеркало |
|
|
||||
|
|
|
|
|
|
|
|||
Рисунок |
5 |
– |
Четвертичные |
|
аммониевые |
соли. |
Энантиомеры |
||
аллилбензилфенилметиламмонийиодида. |
|
|
|
|
|
||||
Четвертичные аммониевые соли, имеющие четыре разных радикала, могут быть разделены на индивидуальные энантиомерные формы, обладающие конфигурационной устойчивостью.
В отдельную группу можно выделить соединения с двойной связью при атоме азота – оксимы. Они существуют в виде цис- и транс- изомеров, которые называют обычно син- и анти-, аналогично олефинам.
R |
R' R |
|
|
R' |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
N |
|||
HO |
|
|
|
OH |
||
син |
|
|
|
анти |
||
Рисунок 6 – Оксимы.
В оксимах пара электронов играет роль одного из четырех заместителей аналогичного олефина.
Помимо соединений азота также обладают хиральностью и могут быть разделены на индивидуальные энантиомеры соединения, имеющие в своём составе тетракоординированные атомы фосфора, кремния, серы и некоторых других элементов. Например, были успешно разделены активные формы метилнафтилфенилсилана.
23

Si |
|
Si |
CH3 |
|
H3C |
H |
зеркало |
H |
Рисунок 6 – Энантиомеры метил(1-нафтил)фенилсилана.
Соединения с трехкоординированными атомами серы и фосфора – сульфоксиды и фосфины – обладают довольно высокой конфигурационной устойчивостью, поскольку колебательная инверсия для тяжелых атомов становится менее быстрой.
H3C |
S |
|
P |
|
|
|
O |
|
|
||
H2C |
|
CH CH CH |
|
||
|
|
3 |
|||
|
|
|
2 |
2 |
|
H3C
метилпропилфенилфосфин
бензил-п-толилсульфоксид Рисунок 7 – Соединения серы и фосфора.
Известны также оптически активные соединения германия, олова, а также соли селения и теллурия.
Далее рассмотрим основные понятия и определения координацилнных соединений. Химия координационных (комплексных) соединений изучает соединения, состав которых не обусловлен непосредственно валентностью образующих их атомов. Комплекс – соединение, образовавшееся при координировании одним атомом, называемом «центральным», одного или более ионов или молекул-лигандов.
24

|
|
Внешня |
|
|
Центральный атом - любой |
|
координационная |
||
|
сфера |
|
||
элемент таблицы Менделеева |
Вешнесферная |
|||
|
||||
кроме благородных газов |
|
|
||
|
|
частица |
||
|
|
|
||
Внутренняя |
[ML ]X |
m |
||
координационная |
|
n |
||
сфера |
|
|
Количество |
|
|
|
внешнесферных |
||
молекул или ионов
Внутрисферно Количество координированная лигандов группа, лиганд
Рисунок 8 – Состав комплекса.
Дентатность – количество донорных атомов, с помощью которых лиганд связывается с одним центральным атомом.
O
O O
 O O
O O
Рисунок 9 – Пентадентатный лиганд 15-краун-5 эфир.
Амбидентатность – способность лигандов, содержащих два или более донорных атомов, присоединяться к центральному атому разными способами (конкурентная координация).
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
M |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
M |
||
M N |
|
|
|
C |
|
|
|
S |
N |
|
C |
|
S M |
|
|
N |
|
C |
|
S |
|
|
N |
|
|
|
|
C |
|
|
S |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
M |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
M |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
M |
|
M |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
M N |
|
|
C |
|
|
S M |
|
|
|
N |
|
|
C |
|
|
S M |
|
|
N |
|
C |
|
|
S M |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
M |
|
M |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
M |
|
|
|
M |
|
|
|
|
M |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
M |
|||||
M N |
|
C |
|
S |
|
|
|
|
|
N |
|
C |
|
S |
|
|
|
M N |
|
C |
|
S M |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
M |
|
|
|
M |
|
|
|
|
M |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
M |
|||||
Рисунок 10 – Координация тиоцианатного иона.
25
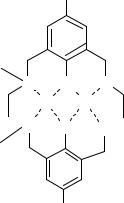
Топичность – количество донорных атомов (групп атомов), не способных координироваться одним центром, но способных координироваться разными центрами. Например, азометиновый макроциклический лиганд имеет 6 донорных атомов и обладает жесткой пространственной структурой, поэтому не способен координироваться одним центром. Этот лиганд является дитопным и образует биядерные координационные соединения.
Br
H3C
N O N
Cu M
 N O N
N O N
H3C
M = Co, Ni, Cu, Zn
Br
Рисунок 11 – Азометиновый макроциклический лиганд.
По заряду комплексные соединения подразделяют на катионные, анионные и нейтральные. Анионные лиганды принято называть следующим образом.
Таблица 2 – Названия анионных лигандов.
Формула |
Анион |
Лиганд |
Формула |
Анион |
Лиганд |
|
|
|
|
|
|
SO42- |
Сульфат |
Сульфато |
O2- |
Оксид |
Оксо |
PO3S3- |
Тиофосфат |
Тиофосфато |
HO- |
Гидроксид |
Гидроксо |
N3- |
Нитрид |
Нитридо |
O22- |
Пероксид |
Пероксо |
N3- |
Азид |
Азидо |
CN- |
Цианид |
Циано |
S2- |
Сульфид |
Тио |
SCN- |
Тиоцианат |
Тиоцианато |
F- |
Фторид |
Фторо |
NO2- |
Нитрит |
Нитрито (-O- |
|
|
(флюоро) |
|
|
) |
|
|
|
|
|
Нитро (-N-) |
|
|
|
|
|
|
Cl- |
Хлорид |
Хлоро |
S22- |
Дисульфид |
Дисульфидо |
Br- |
Бромид |
Бромо |
I- |
Иодид |
Иодо |
26

Взаимное влияние координированных групп проявляется следующим образом: C2H4 ≈
CN ≈ CO >NO2>I- ≈ SCN- > Br- > Cl- > NH3 > H2O.
Примеры некоторых O, N, S-лигандов, их структуры и дентатность приведены ниже. |
|||||||||
Донорный |
|
Структурная формула |
|
Дентатность |
|||||
атом |
|
|
|
|
|
|
|
|
|
O |
H2O |
|
|
O |
|
|
|
OH |
Моно- |
|
H3C |
CH3 |
|
|
|
||||
|
|
|
|
|
|
||||
O |
O |
|
H3C |
|
|
CH3 |
OH |
Бидентатные |
|
|
|
|
|
||||||
HO |
OH |
|
|
O |
|
O |
|
OH |
|
|
|
|
|
|
OH |
|
|
|
Три- |
|
|
|
HOOC |
COOH |
|
|
|||
|
|
|
|
|
|
|
O |
O |
Тетра- |
|
HO |
COOH |
|
|
|
||||
|
HOOC |
|
|
COOH |
|
O |
O |
|
|
|
|
|
|
|
|
|
|
||
N |
|
|
|
|
|
|
NH |
Моно- |
|
|
NH3 |
|
|
|
|
|
|
||
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2N |
|
|
NH2 |
|
|
|
|
Бидентатные |
|
|
|
|
|
|
|
|
||
|
|
|
|
N |
N |
|
|
||
|
|
|
|
|
|
|
|||
|
N |
|
N |
HO |
N |
N |
OH |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
Три- |
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
N |
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
Тетра- |
|
|
|
|
N |
N |
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
H |
N |
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
27 |
|
|
|
|

S |
NH2 |
|
CH3 |
|
Моно- |
S |
|
HS |
|
|
|
|
NH2 |
|
|
|
|
|
|
|
|
|
|
S |
S |
NR2 |
HS |
CN |
Бидентатные |
NR2 |
|
|
|
||
HS |
P |
|
|
|
|
HS |
NR2 |
HS |
CN |
|
|
|
|
|
|||
O, N |
|
OH |
HO |
|
Би-, тетра-, |
N |
|
|
|
|
гексадентатный |
|
|
|
|
|
|
OH |
|
N |
N |
|
|
|
|
COOH |
|
|
|
HOOC |
N |
|
|
|
|
|
N |
COOH |
|
|
|
HOOC |
|
|
|
|
|
S, N |
|
|
|
|
Бидентатные |
|
|
S |
N |
H |
|
|
|
N |
|
||
|
|
NH2 |
H |
S |
|
N |
|
|
|
||
H2N |
N |
N |
N |
|
|
SH |
|
H |
|
|
|
|
|
|
|
|
|
Рисунок 12 – Примеры лигандов.
Координационное число (к.ч.) центрального атома определяет количество донорных атомов, с помощью которых лиганды непосредственно связаны с центральным атомом. Оно может изменяться в зависимости от следующих факторов: природы центрального атома и лигандов, состава внешней сферы, а также условий синтеза соединения (температура, давление, растворитель). К.ч. изменяется от 2 до 12 и от него зависят формы координационных полиэдров. Координационный полиэдр – это геометрическая фигура (многогранник), определяющая пространственное расположение донорных атомов лигандов вокруг центрального атома. Количество вершин полиэдра = к.ч.
К.ч. 2 наиболее характерно для элементов подгруппы меди в степени окисления (I). Для этих соединений возможно две геометрические конфигурации – линейная и угловая. К.ч. 3 встречается редко, за исключением нитратов, сульфатов и карбонатов. Строение – треугольник.
28

[Ag(NH3)2]Cl |
|
|
|
К.ч. = 2, |
|
|
|
Строение |
|
|
|
линейное или |
[Cu(CN3)]-, К.ч. = 3, |
[Pd{C6H5C(O)CHC(O)CH3}2], |
|
треугольник |
|
||
угловое. |
|
К.ч. = 4, квадрат |
|
|
|
||
|
C |
|
S |
|
|
|
|
|
Sb |
C |
Mo |
|
C |
|
|
|
C |
|
|
[Ni(CN)5]3-, |
O |
|
|
|
|
|
|
К.ч. = 5, |
|
|
|
Тетрагональная |
|
|
|
пирамида. |
|
|
|
[SbLPh4], К.ч. = 5, |
[Mo(S2C6H4)3], К.ч. = 6, |
тригональная бипирамида |
тригональная призма |
Рисунок 12 – Примеры координационных полиэдров с к.ч. 2 - 6.
К.ч. 4 (квадрат или тетраэдр) характерно для соединений платины (II), меди(II), никеля (II). К.ч. 5 – две формы координационного полиэдра. Устойчивость комплексов с этим к.ч. в ряду переходных 3d-металлов изменяется в следующей последовательности: Mn(II)<Fe(II)≈Ni(II)<Co(II)<Zn(II)<<Cu(II). Лучше других изучены соединения, в которых центральный атом имеет к.ч. 6. Их образуют большинство металлов периодической системы Менделеева, в частности, кобальт (III), платина(IV), иридий(III), родий(III), хром(III), ванадий(III), никель(II), медь(II), цинк(II), кадмий(II), марганец(II), лантаноиды(III). Это к.ч. чаще всего реализуется в виде тетрагональной бипирамиды.
29

|
|
O |
O |
|
La |
|
Ho |
|
|
Mo |
|
|
|
|
|
|
C |
|
|
N |
[Ho(H2O) (PhCOCHCOPH) ], К.ч. = 7, |
[La(bpyO ) ]3+, |
[Mo(CN) ]3-, К.ч. = 8, |
3 |
2 4 |
|
|
|
8 |
тетрагональная бипирамида |
К.ч. = 8, куб |
додекаэдр |
|
|
Yb
[Yb(H2O)9]3+, К.ч. = 9, |
Сэндвичевый комплекс Pb(II) |
трехшапочная трехгранная призма |
с бензо-15-краун-5, К.ч. = 10 |
Рисунок 13 – Примеры координационных полиэдров с к.ч. 7-10.
К.ч. 7 встречается довольно редко. Ему соответствуют три геометрических полиэдра: тригональная призма (в которой седьмой лиганд расположен над гранью призмы), пентагональная бипирамида и тетрагональная бипирамида, в которой седьмой лиганд расположен над центром одной из граней. К.ч. 8 имеют молибден(I), вольфрам(I), некоторые лантаноиды, уран(IV), цирконий и гафний. Этому к.ч. соответствуют такие полиэдры: куб, додекаэдр, квадратная антипризма и гексагональная бипирамида. К.ч. 8 характерно для комплексов лантаноидов, свойственно цирконию, гафнию, ниобию и танталу во фторидах. Также известны координационные соединения с к.ч. 10, 12. (Например, на слайде свинец расположен между фрагментами краун-эфиров).
Пространственное строение комплекса тория с циклооктатетраеном другой природы – атом тория находится между двумя плоскими лигандами на одинаковом расстоянии от атомов углерода обоих лигандов и образует связи с парами атомов углерода.
30
