
Методичка_Громов
.pdf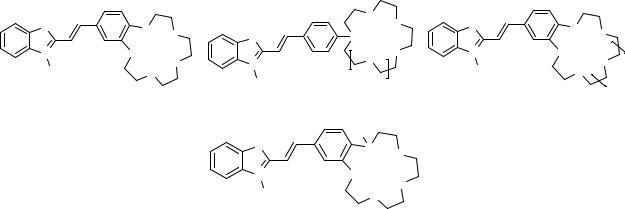
В обоих соединениях в качестве хромофорного фрагмента использован краситель Феноловый синий. В молекуле 1 азакраун-эфирный фрагмент воспроизводит электронодонорную функцию диметиламиногруппы красителя. В молекуле 2 азакраунэфирный фрагмент соединен с красителем так, чтобы катион металла, попадая в полость макроцикла, мог напрямую взаимодействовать с гетероатомом акцепторного фрагмента красителя, т.е. с атомом кислорода карбонильной группы. Ацетонитрильные растворы соединений 1 и 2 характеризуются интенсивной ДПП с максимумом в области 580-590 нм. При добавлении солей щелочных или щелочноземельных металлов ДПП хромоионофора 1 смещается гипсохромно (на 98 нм с Ca2+), а ДПП хромоионофора 2, наоборот, испытывает батохромный сдвиг (на 78 нм с Ca2+).
Широкий ассортимент донорно-акцепторных хромоионофоров – краунсодержащих стириловых, бутадиенильных и бисстириловых красителей – синтезирован группой российских исследователей (Центр фотохимии РАН). В каждой серии красителей варьировались различные структурные параметры, такие как размер макроциклического фрагмента, природа гетероатомов макроцикла, природа гетероциклического фрагмента хромофора. Соединения 3–7 – примеры краунсодержащих стириловых красителей, демонстрирующих отрицательный ионохромизм.
|
|
|
|
|
|
|
|
|
O |
O |
S |
|
|
|
|
S |
|
|
O |
O |
S |
|
|
N |
|
|
|
O |
S |
||
|
|
|
|
|
|
|
|
|
|
|
|
||||
N+ |
|
O |
|
|
|
|
|
|
|
O |
N+ |
|
O |
|
n |
ClO4– |
|
O |
+ |
|
– |
|
O |
ClO4– |
|
O |
|||||
Et |
|
|
O |
|
N |
|
ClO4 |
|
|
n |
Me |
|
|
S |
|
|
|
|
Et |
|
|
|
|
|
|
||||||
|
3 |
|
|
|
4 (n = 1), 5 (n = 2) |
|
|
6 (n = 1), 7 (n = 2) |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
Me |
|
|
|
|
|
|
|
|
|
|
|
|
S |
|
|
|
N |
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
+ |
ClO4– |
O |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Et |
O |
|
4a
В ацетонитриле краситель 3 селективно связывает Mg2+ в ряду катионов щелочных и щелочноземельных металлов; комплексообразование с Mg2+ сопровождается наибольшим гипсохромным сдвигом ДПП (38 нм). Хромоионофор 4 в сравнении с 3 демонстрирует более сильные гипсохромные сдвиги ДПП при комплексообразовании с дикатионами металлов (132 нм с Mg2+) благодаря более сильным электронодонорным свойствам азакраун-эфирного фрагмента. С другой стороны, комплексы с участием 4 имеют сравнительно низкую термодинамическую устойчивость (lgK = 1.3). Основной причиной этого, по-видимому, является плоское строение N-сочленения в азакраун-эфирном фрагменте 4, предполагающее большие конформационные изменения при комплексообразовании. Проблема сравнительно
101

низкой устойчивости комплексов хромоионофоров типа 4 может быть решена путем использования бензоазакраун-эфирного фрагмента вместо N-фенилазакраун-эфирного. Так при комплексообразовании соединения 4а с Mg2+ в ацетонитриле ДПП смещается на 136 нм,
а lgK = 5.3.
Отличительной особенностью хромоионофора 6 является высокая селективность к ионам Hg2+ (lgK = 18.1). Однако величины гипсохромного эффекта для комплекса 6 с Hg2+ (~ 17 нм) существенно меньше, чем для комплексов 3 с катионами щелочноземельных металлов. Это обусловлено предпочтительной координацией Hg2+ с атомами серы дитиакраун-эфирного фрагмента.
В противоположность соединениям 3–7 стириловый краситель 8, в котором макроцикл соединен с электроноакцепторным фрагментом хромофора, демонстрирует положительный ионохромизм (батохромный сдвиг ДПП для комплекса 8 с Mg2+ в ацетонитриле достигает 14 нм).
O |
|
NMe2 |
O |
S |
|
O |
|
|
O |
N+ |
ClO4– |
O |
Et |
|
|
|
|
|
8 |
|
Бутадиенильный краситель 9 по сравнению со своим стириловым аналогом 3 образует термодинамически более устойчивые комплексы с катионами щелочноземельных металлов, так как удлинение полиметиновой цепи в хромофоре приводит к ослаблению электроноакцепторного влияния гетероциклического остатка на бензокраун-эфирный фрагмент.
|
|
O |
X |
S |
|
|
|
|
O |
n |
|
|
ClO4− |
O |
|
N+ |
X |
||
Et |
|
|
|
|
|
|
9 (X = O, n = 1), 10 (X = S, n = 1), 11 (X = S, n = 2)
Величина гипсохромного эффекта для комплексов состава 1:1 при переходе от 3 к 9 практически не изменяется. Отличительным свойством бутадиенильного красителя 9 является высокая склонность к образованию сэндвичевых комплексов состава 2:1 с ионами Sr2+ и Ba2+. Сэндвичевые комплексы стабилизируются за счет стэкинг-взаимодействий между двумя бутадиенильными хромофорами (схема 10).
102
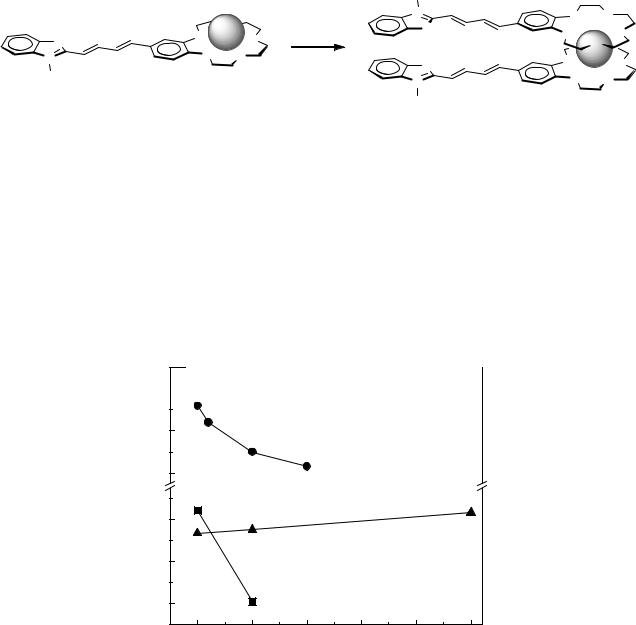
Схема 10
|
|
|
|
|
Et |
|
|
|
|
|
|
|
|
N+ |
O |
|
O |
|
|
O |
|
|
S |
|
||
|
O |
|
9 |
O |
|
O |
||
S |
M2+ |
O |
|
|||||
O |
O |
|
|
|
O |
|||
N+ |
|
|
S |
O |
M |
2+ |
||
|
|
|
|
O |
||||
Et |
|
|
|
|
N+ |
O |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Et |
|
|
|
Для хромоионофоров 9 и 10 изучено влияние содержания воды (PW, об.%) в водноацетонитрильной смеси на величину катион-индуцированного гипсохромного эффекта и селективность комплексообразования. Красители 9, 10 демонстрируют отрицательную сольватохромию (т.е. с ростом полярности среды наблюдается гипсохромный сдвиг ДПП), поэтому величина ионохромного эффекта снижается с ростом PW. На рисунке 10 показаны зависимости логарифма константы устойчивости комплекса от PW для комплексов 10 с Ag+, Hg2+ и Pb2+.
18 |
|
lg K |
|
|
16
Hg2+
14 |
|
|
|
|
|
6 |
|
|
Ag+ |
|
|
|
|
|
|
|
|
4 |
Pb2+ |
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
PW / % |
|
|
|
|
|
|
0 |
10 |
20 |
30 |
40 |
50 |
Рисунок 10 – Зависимости lgK от PW для комплексов дитиакраун-эфира 11 с Ag+, Hg2+ и Pb2+.
Видно, что при переходе от безводного ацетонитрила к смесям с большим содержанием воды происходит инверсия селективности Ag+/Pb2+. Контрастный характер зависимостей lgK от PW для Ag+ и Pb2+, а также для Ag+ и Hg2+, объясняется тем, что ионы Ag+ предпочтительно сольватируются ацетонитрилом, а ионы Pb2+ и Hg2+ предпочтительно гидратируются (т.е. сольватируются молекулами воды).
Бисстириловый краситель 12 спроектирован как ионохромный молекулярный пинцет. Показано, что он может селективно захватывать катионы щелочноземельных металлов
103

большого диаметра (Sr2+ и Ba2+) благодаря кооперативному действию двух 15-краун-5- эфирных фрагментов. Комплексы 12 с ионами Sr2+ и Ba2+ имеют структуру типа внутримолекулярный сэндвич (схема 11). Они характеризуются значительным гипсохромным эффектом.
Схема 11
S |
|
O |
O |
|
|
|
|
|
|
|
|
|
S |
|
|
|
|
N+ |
|
O |
|
|
O |
O |
O |
|
|
O |
|
|
|
||||
(CH2)3 |
|
O |
M2+ |
N+ |
O |
|
O |
|
|
|
|
||||||
|
|
|
|
M2+ |
|
|||
N+ |
|
|
|
|
|
|
|
|
S |
|
O |
|
|
N+ |
O |
|
O |
|
O |
|
|
O |
O |
O |
||
|
|
|
S |
|||||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
O |
O |
|
|
|
|
|
|
|
O |
M = Sr, Ba |
|
|
|
|
|
|
12 |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
Хромогенный бис(18-краун-6)-эфир 13 проявляет высокую селективность к аммонийным дикатионам NH3+(CH2)nNH3+ (n = 2–6) относительно ионов аммония типа EtNH3+. Комплексы 13 с NH3+(CH2)nNH3+ состава 1:1 имеют псевдоциклическое строение
(схема 12) и характеризуются значительным гипсохромным сдвигом ДПП (21−23 нм в ацетонитриле).
Схема 12
|
O |
|
|
|
|
|
|
O |
|
O |
|
|
|
|
|
O |
|
O |
|
O |
|
|
O |
|
|
H |
|
|
|||
|
|
|
|
O |
|||
N+ |
|
N+ |
|
|
|
||
O |
|
|
|
+ |
|||
O |
|
H N |
H |
||||
|
|
|
|
|
|||
|
|
NH3+(CH2)nNH3+ |
|
|
O |
|
O |
|
|
|
|
|
(CH2)n |
||
|
|
|
|
O |
|
O |
|
N+ |
O |
N+ |
|
|
|
|
|
O |
|
H N+ H O |
|||||
O |
|
O |
|
||||
|
|
|
H |
|
|
||
|
|
|
|
O |
|
O |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
O |
|
O |
|
|
|
|
|
13 |
O |
|
|
|
|
|
|
Другими примерами донорно-акцепторных хромоионофоров на основе краун-эфиров являются краунсодержащие производные 1,2-дизамещенных этиленов, полиметиновых красителей, азокрасителей и кумаринов. Дизайн кумариновых красителей 14 и 15 типичен
104
для хромоионофоров с положительным ионохромизмом. Краситель 15 в сравнении с 14 демонстрирует более сильные катион-индуцированные батохромные изменения в спектре поглощения. Полагают, что соединение 15, имеющее более длинный мостик между хромофором и краун-эфиром, может принимать конформацию, обеспечивающую более сильное взаимодействие между катионом, находящимся в полости краун-эфирного фрагмента, и атомом кислорода карбонильной группы хромофора.
CF3 |
|
O |
|
CF3 |
O |
|
|
|
|
||||
|
|
|
|
|
O |
|
|
|
N |
O |
|
|
|
N |
|
N |
O |
O |
||
|
|
|
||||
O |
O |
O |
O |
O |
O |
O |
|
O |
|||||
|
|
|
|
|
||
14 |
|
|
|
|
15 |
|
Донорно-акцепторный хромоионофор 16 имеет в своем составе очень сильный электроноакцептор – 1,3-бис(дицианометилиден)индановый фрагмент. Это соединение интересно тем, что может работать как колориметрический сенсор для катионов металлов в ближней инфракрасной области спектра.
NC |
CN |
O |
COCH3 |
|
|
O |
|
|
|
|
|
|
|
|
O |
|
N |
|
N |
|
|
|
O |
O O
NC CN  COCH3
COCH3
16
Анализ литературных данных по комплексообразованию катионов щелочных и щелочноземельных металлов с донорно-акцепторными хромоионофорами на основе краунэфиров показывает, что величина ионохромного эффекта (Δλ) определяется следующими факторами:
1)зарядом катиона металла – в случае катионов одинакового диаметра значение Δλ возрастает с увеличением заряда;
2)геометрическим соответствием между катионом металла и полостью краун-эфирного фрагмента – для катионов одинакового заряда, чем лучше это соответствие, тем больше Δλ;
3)природой гетероатомов макроцикла, входящих в хромофорную систему;
4)природой растворителя – донорно-акцепторные хромоионофоры проявляют сильную сольватохромию, поэтому величина Δλ зависит от полярности среды.
105

Протонные хромоионофоры
Протонные хромоионофоры преимущественно используются в экстракционной фотометрии. Они демонстрируют положительный ионохромизм, который связан с переходом хромофорного фрагмента в анионную форму вследствие отщепления протона. Для стабилизации анионной формы необходимо, чтобы катион металла, находящийся в полости макроциклического фрагмента, мог взаимодействовать с гетероатомами хромофора. Вероятно, оптимальными являются структуры, которые допускают образование прямой координационной связи между катионом металла и анионной группой хромофора. Специфика протонных хромоионофоров, используемых в экстракционной фотометрии, состоит в том, что заряд катиона, извлекаемого из воды в органическую фазу, должен быть скомпенсирован зарядом анионной формы хромофора. К примеру, для извлечения двухзарядных катионов в органическую фазу хромоионофор должен иметь два протона, способных к отщеплению.
Фактически все известные к настоящему времени протонные хромоионофоры на основе краун-эфиров можно разделить на две категории. Одну из них составляют производные анилина, а другую – производные фенола.
Соединения 17 и 18 – типичные примеры протонных хромоионофоров на основе производных анилина.
|
|
|
|
|
O |
O |
|
|
O2N HN |
O |
O |
|
NO2 |
N |
|
N |
NO2 |
|
|
|
|
|
|
|||
NO2 |
O |
O |
|
NH |
O |
O |
HN |
|
|
|
|
|
|||||
|
O |
|
|
|
|
|
|
|
O2N |
|
O2N |
NO2 |
|
|
O2N |
NO2 |
|
|
|
|
18 |
|||||
17 |
|
|
|
|
|
|
|
Хромоионофор 17 предпочтительно экстрагирует ионы K+ в хлороформ из щелочного водного раствора солей Li, Na и K. Дипротонный хромоионофор 18 способен извлекать из водного раствора солей Mg, Ca, Sr и Ba только ионы Ba2+.
Примерами протонных и дипротонных хромоионофоров на основе производных фенола являются соединения 19 и 20, соответственно.
106

OH |
|
OH |
O |
O |
OH |
|
|
|
|||
|
|
O |
N |
|
N |
|
N |
|
|
||
|
O |
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
O |
O |
|
|
|
NO2 |
|
|
|
NO2 |
|
|
NO2 |
|
|
||
|
19 |
|
|
20 |
|
Системы на основе термических реакций изомеризации и перегруппировки
Известно, что при фотолизе практически бесцветных спиропиранов происходит разрыв связи углерод–кислород пиранового цикла и образуется мероцианиновый краситель. Валентная изомеризация спиропиранов может протекать и термически, однако термическое равновесие спиропиран–мероцианин, как правило, смещено в сторону бесцветной закрытой формы. Разработаны краунсодержащие спиропираны и спиронафтоксазины, которые могут частично переходить в окрашенную мероцианиновую форму при комплексообразовании с катионами щелочных или щелочноземельных металлов. Принцип дизайна таких систем можно проиллюстрировать на примере азакраунсодержащего спиробензопирана 21.
Схема 13
Me |
Me |
|
|
|
|
|
|
NO2 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
Me |
Me |
|
|
|
|
N O |
|
NO2 |
Li+ |
|
|
|
|
|
|
|
|
|
|
|||
|
Me |
|
|
|
N+ |
|
O– |
|
|
|
N |
|
|
|
|
||
|
|
O |
|
Me |
O |
N |
|
|
21 |
O |
O |
|
|
Li+ |
O |
||
|
|
|
O |
|||||
|
|
|
|
|
||||
Термическая изомеризация 21 селективно промотируется ионами Li+ (схема 13), что объясняется стабилизацией мероцианиновой формы вследствие внутримолекулярного взаимодействия между катионом металла, находящимся в полости азакраун-эфирного фрагмента, и фенолят-ионом.
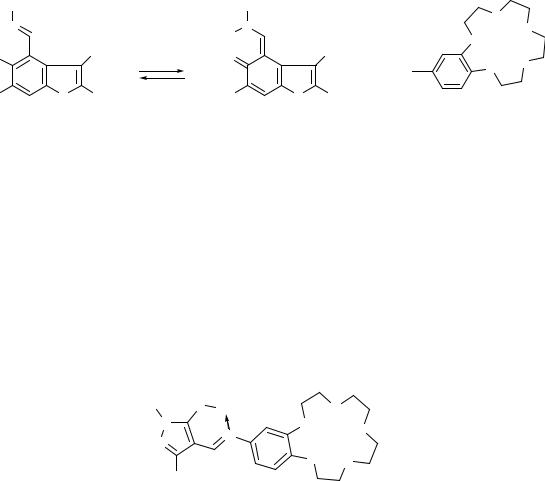
Некоторые из иминов, например, 22 способны действовать как хромоионофоры. Принцип действия основан на смещении таутомерного равновесия при комплексообразовании (схема 14).
Схема 14
107
|
R |
|
R |
|
O |
|
|
N |
|
N |
|
O |
|
|
H |
|
O |
|||
|
|
|
|
|
||
|
Ph |
|
|
Ph |
|
|
HO |
O |
|
|
O |
||
|
|
|
O |
|||
|
|
|
|
R = |
||
|
|
|
|
|
||
|
|
|
|
|
|
|
O2N |
O Ph |
O2N |
|
O Ph |
|
|
|
22 A |
|
|
22 B |
|
|
В полярных растворителях соединение 22 частично находится в таутомерной хиноидной форме B. При образовании комплекса между краун-эфирным фрагментом 22 и катионом щелочноземельного металла таутомерное равновесие смещается в сторону бензоидной формы A, что приводит к значительному уменьшению интенсивности ДПП.
Другие хромоионофорные системы
Недавно описаны хелаты краунсодержащих оснований Шиффа с катионами переходных металлов, в частности хромогенное краун-соединение 23.
Ph |
S Cu/2 |
O |
|
N |
N |
O |
O |
N |
|
||
|
|
||
|
O O |
|
|
|
|
|
Me
23
Обнаружено, что светло-зеленые ацетонитрильные растворы 23 приобретают малиновую окраску при добавлении соли бария. С другими щелочноземельными металлами заметных цветовых изменений не происходит. Предполагают, что селективность 23 к Ba2+ связана с образованием сэндвичевого комплекса с участием двух краун-эфирных фрагментов. Недостатком этой системы являются невысокие коэффициенты молярного поглощения в видимой области спектра.
Люминесцентные сенсоры
Первые публикации по люминогенным краун-соединениям появились практически одновременно с публикациями по хромоионофорам. Однако они не содержали четко определенных концепций относительно дизайна эффективных люминесцентных молекулярных сенсоров (ЛМС). Первые примеры рационального дизайна ЛМС относятся к середине 80-х годов XX века. Наиболее перспективными с практической точки зрения считаются ЛМС, которые могут сильно люминесцировать только в составе комплекса, т.е. после селективного связывания субстрата, а в отсутствии субстрата не люминесцируют, либо показывают очень слабую люминесценцию. Благодаря высокой чувствительности
108
люминесцентного анализа такие системы могут быть использованы для определения очень малых количеств анализируемого вещества.
Общая концепция дизайна ЛМС, «включающихся» при селективном связывании субстрата, основана на явлениях самотушения люминесценции, обусловленных внутримолекулярными процессами, такими как:
∙фотоиндуцированный перенос электрона,
∙фотоиндуцированный перенос протона,
∙образование эксимера или эксиплекса,
эксимер – электронно-возбужденный димер, образующийся путем ассоциации возбужденной и невозбужденной молекул; который диссоциирует после дезактивации электронно-возбужденного состояния, эксиплекс – комплекс, образующийся путем ассоциации возбужденной молекулы
одного вещества и невозбужденной молекулы другого вещества, который, как и эксимер, диссоциирует после дезактивации электронно-возбужденного состояния,
∙переход возбужденной молекулы в скрученное состояние с внутримолекулярным (внутренним) переносом заряда, так называемое TICT-состояние (twisterd
intramolecular (internal) charge transfer).
Макроциклический и люминофорный фрагменты «включающихся» ЛМС должны быть соединены таким образом, чтобы субстрат, находящийся в полости макроцикла, мог подавлять процесс, отвечающий за тушение люминесценции.
ЛМС можно разделить на 2 группы:
1)соединения, имеющие структуру типа люминофор–спейсер–макроцикл;
2)соединения со структурой, аналогичной структуре донорно-акцепторных хромоионофоров (люминофорный фрагмент ЛМС этой группы представляет собой электронно-сопряженную систему донор–акцептор).
ЛМС, содержащие спейсер между макроциклом и люминогенным фрагментом
Рассмотрим несколько примеров ЛМС из первой группы.
Показательными примерами «включающихся» ЛМС, т.е. молекул, люминесценция которых разгорается при селективном связывании субстрата, являются азакраунсодержащие антрацены 24, 25. Они относятся к так называемым PET-сенсорам (PET – photoinduced electron transfer, фотоиндуцированный перенос электрона).
109
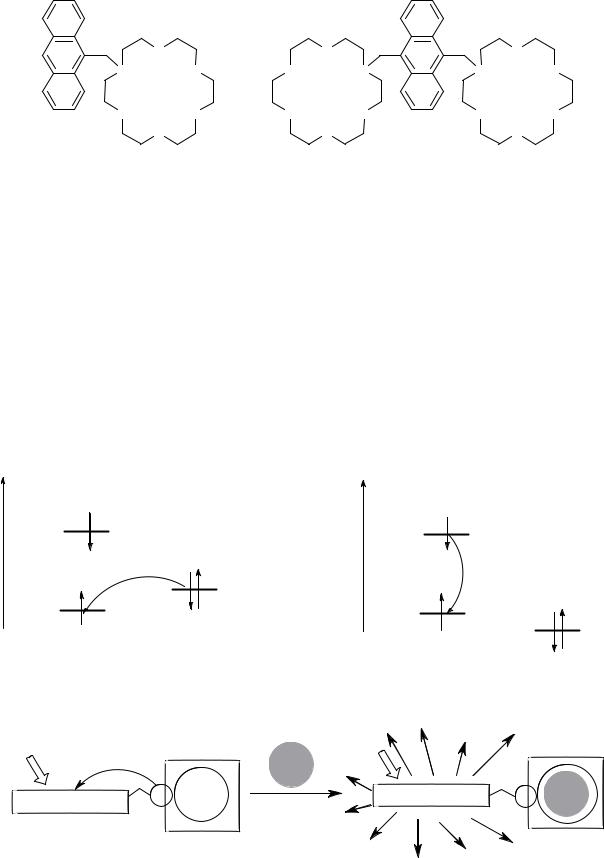
|
O |
|
O |
|
O |
|
N |
O |
O |
N |
|
N |
O |
O |
O |
O |
O |
|
O |
O |
24 |
O |
|
O |
25 |
O |
|
|
|
|
|
|
||
Незамещенный |
антрацен |
характеризуется |
высоким квантовым |
выходом |
||
флуоресценции ϕ 0.3 (ϕ = Nизл/Nпогл, где Nизл – число излучённых квантов, Nпогл – число поглощенных квантов). В то же время соединения 24, 25 показывают сравнительно слабую флуоресценцию, что является следствием внутримолекулярной реакции переноса электрона с атома азота макроциклического фрагмента на локально-возбужденное антраценовое ядро. При комплексообразовании азакраун-эфира 24 с K+ квантовый выход флуоресценции возрастает в 47 раз. Причина разгорания флуоресценции состоит в том, что катион металла, попадая в полость азакраун-эфирного фрагмента, блокирует неподеленную пару электронов на атоме азота и препятствует переносу электрона на возбужденное антраценовое ядро. Схематично данный процесс представлен на рис. 11 (ВЗМО – высшая занятая молекулярная орбиталь, НСМО – низшая свободная молекулярная орбиталь):
E |
|
|
E |
|
|
|
|
|
|
|
|
НСМО |
|
|
НСМО |
|
|
|
|
НСМО |
|
|
|
ВЗМО |
|
|
ВЗМО |
|
|
|
|
|
|
|
НСМО |
возбужденный |
свободный |
возбужденный |
связанный |
||
|
флуорофор |
рецептор |
|
флуорофор |
рецептор |
hν |
e– |
|
hν |
hν1 |
|
|
|
Д |
|
|
Д |
слабая флуоресценция
сильная флуоресценция
Рисунок 11 – Разгорание флюоресценции для PET-сенсора при комплексообразовании.
110
