
2.Электроды в потенциометрии
2.1 Металлические электроды
Металлические электроды подразделяются на активные и инертные.
Инертные электроды различают первого и второго рода.
Электроды первого рода – металл, погруженный в раствор соли этого же металла, образующий окислительно – восстановительную систему, в которой этот потенциал определяется только относительно концентрации катионов в растворе. Потенциал таких электродов зависит от активности иона металла Меn+. К электродам первого рода относятся ртутные, серебряные, амальгамные, водородные и другие.
Амальгамный электрод – металл, растворенный в ртути, обладает дополнительными преимуществами по сравнению с металлическим:
1) не реагирует с кислотами, так как водород на амальгаме выделяется с большим перенапряжением по сравнению с чистым металлом;
2) с ним быстрее устанавливается равновесие, чем с металлическим.
Электроды второго рода – металл, погруженный в раствор малорастворимой соли этого металла, содержащий избыток другой соли с одинаковым анионом, потенциал которого определяется концентрацией соответствующего аниона (например, Cl– для хлоридсеребряного электрода).К электродам второго рода относятся хлорсеребряный, каломельный и сурьмяный.
К инертным электродам относится хингидронный, Pt, Au, C.Они играют роль переносителей ионов, потенциал зависит от отношения активности окислительной и восстановительной формы .[2]
2.2Мембранные электроды
ИСЭ - это электрохимические датчики, позволяющие потенциометрически определять некоторые ионы в присутствии других. Такой электрод представляет собой гальванический полуэлемент, состоящий из ионоселективной мембраны, внутреннего контактирующего раствора и внутреннего электрода сравнения. Для практического удобства все они располагаются в одном корпусе.
ИСЭ могут иметь мембраны в любом агрегатном состоянии - твердом, жидком, газовом.[3]
В основе возникновения потенциала ИСЭ лежит ионный обмен, аналогичный обмену ионами Н+ между раствором и гелем стекла.
Eинд
= К +
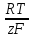 +lg
aM
(2)
+lg
aM
(2)
Активность определяемого иона может быть рассчитана по уравнению:
lg aM=
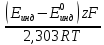
где: EИНД - экспериментально найденный потенциал ИСЭ.
Его находят по ЭДС исследуемого элемента:
EИНД = ЕСР – Е - ЕД,
где: Е - э.д.с. элемента;
ЕСР - потенциал электрода сравнения;
ЕД - диффузионный потенциал.
Отсюда
paM=
- lgaM
=
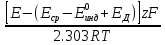 (4)
(4)
Так как ам = См γм
pCM=
- lgCM=
=
 – lg
– lg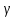 M
(5)
M
(5)
Аналитическое использование ИСЭ опирается на эти закономерности.[2]
2.3Стеклянный электрод
занимает промежуточное состояние между твердой и жидкой мембраной.
Стеклянный электрод – стеклянный шарик диаметром 15 - 20 мм с толщиной стенок 0,06 - 0,1 мм, изготовленный из стекла, содержащего большое количество щелочных металлов – лития или натрия, и расположенный на конце стеклянной трубки. Если этот шарик заполнить раствором с определенным значением pH и опустить его в анализируемый раствор с другим значением pH, то на поверхности шарика возникает потенциал, величина которого изменяется соответственно разности pH между внутренним и внешним растворами. На поверхности стеклянного электрода устанавливается сложное равновесие, связанное со взаимной диффузией ионов водорода из раствора в стекло и ионов натрия или лития из стекла в раствор.
Для измерения рН стеклянный электрод погружают в исследуемый раствор в паре с электродом сравнения (например, ХСЭ), собирая цепь вида
Pt / Ag / AgCl / KCl нас// H+ / стекло / HCl / AgCl / Ag
ЭДС цепи выражается уравнением
Е = Е0 + 0,591рН , (9)
где рН отвечает раствору, в который опущены электроды; Е0 – определяется сортом стекла ионообменной мембраны и потенциалом электрода, помещенного внутрь стеклянного чехла.
Достоинства стеклянного электрода:
простота работы
быстрое установление равновесия
на точность определения pH не влияет присутствие окислителей или восстановителей;
на электрод не действуют яды, коллоиды и другие вещества, искажающие точность определений pH;
позволяет работать с кислыми и щелочными растворами в широком диапазоне pH (от 0 до 12 – 13).
работает от 0º до 95ºС
Недостатки стеклянного электрода:
хрупкость
нельзя использовать обычную потенциометрическую установку вследствие большого сопротивления электрода;
для усиления тока электродной пары со стеклянным электродом необходимо использовать струнные или зеркальные гальванометры или ламповые усилители;
возможна погрешность в определении стандартного значения
при работе обнаруживается явление – «потенциал асимметрии стеклянного электрода»( Когда обе поверхности стеклянного электрода соприкасаются с растворами, концентрации водородных ионов в которых одинаковы, на внутренней и внешней поверхностях электрода возникают разные потенциалы. Это свидетельствует о различии в свойстве внутренней и внешней поверхностей стеклянного электрода из легкоплавкого стекла с большой электропроводностью, очень тонкими стенками и периодическим выдерживанием в воде, в слабощелочном буфере и в буфере с pH, равным pH внутреннего раствора стеклянного шарика. Чем больше потенциал асимметрии, тем менее устойчивы показания pH.[2]
