
- •2. Элементы термодинамики
- •2.1. Теплота и работа
- •2.2. Первое начало термодинамики
- •2.3. Теплоемкость идеального газа
- •2.4. Применение первого начала термодинамики
- •Для этого процесса первое начало термодинамики запишется в виде
- •2.5. Применение первого начала термодинамики
- •2.6. Уравнение Майера
- •2.7. Применение первого начала термодинамики
- •Работа изотермического процесса можно определить по формуле
- •2.8. Применение первого начала термодинамики
- •После интегрирования (2.26) с учетом (2.27), получим
- •2.9. Адиабатическое сжатие и расширение звуковых волн
- •2.10. Политропный процесс
- •Из формулы (13.43) найдем давление
- •2.11. Обратимые и необратимые процессы
- •2.12. Круговые процессы
- •2.13. Обратимый цикл Карно
- •Поскольку состояния 2 и 3 лежат на одной адиабате, то
- •Состояния 1 и 4 лежат также на одной адиабате сжатия, тогда
- •2.14. Неравенство Клаузиуса
- •2.15. Энтропия
- •2.16. Второе начало термодинамики
- •2.17. Информация, энтропия, вероятность
- •2.17.1. Современные представления об информации
- •2.18. Термодинамические потенциалы
- •2.19. Термодинамический смысл химического потенциала
- •2.20. Фазы и условия равновесия фаз
- •2.21. Уравнение Клапейрона – Клаузиуса
- •2.22. Критическая точка
2.14. Неравенство Клаузиуса
Всякое механическое движение материальных тел согласно законам классической механики имеет свойство обратимости.
Всегда возможно обратное движение, т. е. движение, при котором тело проходит все те же точки пространства с теми же скоростями, что и в прямом движении.
Обратимость механического движения вытекает из их симметрии по отношению к замене будущего прошедшим.
Относительно тепловых процессов этого сказать нельзя.
Все тепловые процессы необратимы, так как физическая система, предоставленная самой себе, всегда стремится перейти в состояние термодинамического равновесия.
Известно, что все тепловые явления сводятся к механическому движению атомов и молекул тел.
Поэтому необратимость тепловых процессов как бы находится в противоречии с обратимостью механического движения.
Установлено, что необратимость тепловых процессов имеет вероятностный характер.
Самопроизвольный переход физической системы из равновесного состояния в неравновесное, невозможен или, как говорят, менее вероятен, чем переход из неравновесного состояния в равновесное состояние.
При этом надо помнить, что всегда возможны флуктуации.
В 1850 г. Клаузиус, используя теорему Карно о максимальном КПД идеального цикла, получил неравенство (неравенство Клаузиуса), которое выражает важную теорему термодинамики, т. е. для кругового процесса
![]() ,
(2.54)
,
(2.54)
где dQ – количество теплоты, сообщенное физической системе (или отводимое от нее) на бесконечно малом отрезке кругового цикла;
Т – абсолютная температура соответствующего элемента cреды;
![]() – элементарная
приведенная теплота.
– элементарная
приведенная теплота.
Если процесс квазистатический, то неравенство Клаузиуса переходит в равенство Клаузиуса
![]() .
(2.55)
.
(2.55)
2.15. Энтропия
Для описания термодинамических процессов широко используется понятие энтропии.
Отношение
![]() (приведенное количество теплоты) в
обратимом процессе является полным
дифференциалом и есть функция состояния
системы, называемаяэнтропией
S. Это непосредственно следует из
равенства Клаузиуса, т. е.
(приведенное количество теплоты) в
обратимом процессе является полным
дифференциалом и есть функция состояния
системы, называемаяэнтропией
S. Это непосредственно следует из
равенства Клаузиуса, т. е.
![]() .
(2.56)
.
(2.56)
Докажем, что в любом обратимом круговом процессе
![]() .
(2.57)
.
(2.57)
Для доказательства рассмотрим идеальный газ. Согласно первому началу термодинамики
![]() .
(2.58)
.
(2.58)
Используя уравнение Менделеева – Клапейрона перепишем (13.58) в виде
![]() .
(2.58*)
.
(2.58*)
В
обратимом процессе при переходе
идеального газа из состояния 1 в 2 интеграл
![]() не зависит от вида процесса перехода
из 1 в 2, т. е.
не зависит от вида процесса перехода
из 1 в 2, т. е.
 (2.59)
(2.59)
или
 .
(2.60)
.
(2.60)
В случае кругового процесса V2 = V1, T2 = T1, то для идеального газа
 .
.
Что же произойдет с энтропией системы?
Из анализа формул (13.58) и (13.58*) следует, что
![]() (2.61)
(2.61)
или
![]() .
(2.62)
.
(2.62)
При неизменном числе молей идеального газа
![]() .
.
После логарифмирования
![]() (2.63)
(2.63)
или
![]()
С учетом последнего равенства формула (13.62) принимает вид
![]() (2.64)
(2.64)
или
![]() .
(2.65)
.
(2.65)
При нагревании тела (dQ 0) его энтропия возрастает (dS 0); при охлаждении (dQ 0) энтропия тела убывает (dS 0). В процессе завершения обратимого цикла dS = 0, т. е. S = сonst.Энтропия изолированной системы в любом обратимом процессе остается постоянной.
Таким образом, энтропия физической системы есть функция ее состояния, и определяется с точностью до произвольной постоянной.
Разность энтропии в двух равновесных состояниях 1 и 2 равна приведенному количеству тепла, которое необходимо сообщить системе, чтобы перевести ее из состояния 1 в 2 по любому квазистатическому пути.
Рассмотрим физическую систему, которая необратимо переходит из равновесного состояния 1 в равновесное состояние 2 (рис. 2.11).При необратимом процессе перехода системы (на рис. 13.11 он изображен пунктирной линией 1– а – 2) из состояния 2, она переходит квазистатически по какому-либо пути, например, 2 – б – 1.
На основании неравенства Клаузиуса (10.54), имеем
![]() .
(2.66)
.
(2.66)
Учитывая, что процесс (2–б –1) – квазистатический
![]() ,
(2.67)
,
(2.67)
тогда неравенство Клаузиуса принимает вид
![]() ,
(2.68)
,
(2.68)
где Т – абсолютная температура окружающей среды, которая отдает физической системе тепло dQ.
Рис. 2.11
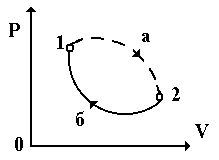
S2 S1. (2.69)
Неравенство (13.69) выражает закон возрастания энтропии.
Следовательно,
энтропия адиабатически изолированной
системы не может убывать; она либо
возрастает (необратимый процесс), либо
остается постоянной (обратимый процесс).
Понятие энтропии носит двойственный
характер – макроскопический и
микроскопический. Соотношение
![]() = dS является макроскопическим определением
энтропии.
= dS является макроскопическим определением
энтропии.
Свойства энтропии.
1. Энтропия системы равна сумме энтропии каждого тела, т. е.
![]() .
.
2. Энтропия – функция состояния системы.
3. В равновесных процессах без передачи тепла энтропия физической системы не меняется.
4. Энтропия является монотонно возрастающей функцией внутренней энергии тела (при постоянном объеме).
5. При постоянном объеме (изохорический процесс)
dQ = dU,
т. е.
![]()
Так как Т 0, то dS и dU имеют один и тот же знак.
Задание внутренней энергии тела как функции объема и энтропии полностью определяет свойства однородного тела,
т. е.
U = U(V, S).
6. Энтропия определяется с точностью до произвольной постоянной.
