
- •Биохимия. Краткий курс
- •Часть I
- •Оглавление
- •Список сокращений
- •Введение
- •1. Ферменты
- •1.1.Строение ферментов
- •1.2.Номенклатура и классификация ферментов
- •1.3.Изоферменты и их медицинское значение
- •1.4. Регуляция активности ферментов
- •1.5. Ферменты в медицине и фармации
- •2. Витамины
- •2.1. Водорастворимые витамины Витамин в1, (тиамин, антиневритный витамин)
- •Витамин в2(рибофлавин)
- •Витамин рр,(ниацин, антипеллагрический витамин)
- •Витамин в6 (пиридоксин, пиридоксаль, пиридоксамин)
- •Витамин н (биотин)
- •Фолиевая кислота
- •Витамин в12 (кобаламин)
- •Витамин с (аскорбиновая кислота, антицинготный витамин)
- •Пантотеновая кислота
- •2.2.Жирорастворимые витамины Витамин а (антиксерофтальмический)
- •Витамин к, нафтохиноны (антигеморрагический)
- •Витамин е, токоферол
- •Витамин д (кальциферол, кальциол, антирахитический)
- •3.Биоокисление и биоэнергетика
- •3.1. Цикл кребса
- •3.2. Дыхательная цепь
- •3.3.Свободное окисление: функции, оксидативная модификация
- •4. Обмен углеводов
- •4.1.Переваривание и всасывание
- •4.2. Обмен гликогена
- •4.3.Распад глюкозы в аэробных и анаэробных условиях
- •4.4. Глюконеогенез
- •4.5. Пентозофосфатный путь превращения глюкозы
- •5 Глюкозо-6-фосфат 6 рибозо-5-фосфат
- •4.6.Гомеостаз глюкозы крови
- •5. Обмен липидов
- •5.1.Переваривание и всасывание
- •5.2. Обмен жира
- •5.3.Обмен жирных кислот
- •5.4. Обмен и роль кетоновых тел
- •5.5. Обмен, роль и транспорт холестерина
- •5.6. Патология обмена холестерина
- •6. Обмен белков
- •6.1. Переваривание и всасывание
- •6.2. Декарбоксилирование аминокислот
- •6.3. Обмен по аминогруппе
- •6.4. Источники аммиака и его обезвреживание.
- •6.5. Судьба безазотистого остатка аминокислот
- •6.6. Обмен отдельных аминокислот
- •7. Тестовые задания
- •8. Эталоны ответов к тестовым заданиям
- •9. Рекомендуемая литература
- •Биохимия. Краткий курс
- •Часть 1
6.4. Источники аммиака и его обезвреживание.
Аммиак образуется в результате дезаминирования глутамата, биогенных аминов, нуклеотидов (рис.16). Часть аммиака образуется в кишечнике в результате действия бактерий (гниение белков в кишечнике). Образование аммиака происходит во всех клетках, а процессы его окончательного обезвреживания – в печени и почках. Аммиак – токсичное соединение (в первую очередь для ЦНС). Низкая концентрация аммиака в крови свидетельствует о том, что в клетках происходит связывание аммиака (первичное обезвреживание) с образованием нетоксичных соединений (транспортных форм) в виде которых аммиак доставляется в печень и почки для окончательного обезвреживания.

Рис. 16. Поток азота при катаболизме аминокислот
Основным путем первичного обезвреживания аммиака является образование амидов – глутамина и аспарагина. Глутамин образуется под действием глутаминсинтетазы, при этом затрачивается молекула АТФ. Аспарагин образуется под действием аспарагинсинтетазы, при этом также затрачивается молекула АТФ, но она расщепляется до АМФ.
В мозге и некоторых других тканях аммиак связывается в результате восстановительного аминирования под действием глутаматдегидрогеназы.
В печени и почках происходит гидролиз глутамина под действием глутаминазы с образованием аммиака. Аммиак, соединяясь с кислотами, выводится в виде солей аммония с мочой (0,5 г в сутки). Этот процесс является одним из механизмов регуляции кислотно-щелочного равновесия в организме и сохранения важнейших катионов для поддержания осмотического давления. Синтез глутаминазы повышается при ацидозе, образующийся при этом аммиак нейтрализует кислые продукты обмена. Эта реакция защищает организм от излишней потери ионов Nа+ и К+, которые также могут использоваться для выведения анионов кислот и утрачиваться.
В печени аммиак обезвреживается путем синтеза мочевины. Мочевина – нетоксичный, водорастворимый конечный продукт азотистого обмена, выводимый почками. За сутки с мочой выделяется около 25 г мочевины. При повышении количества потребляемого с пищей белка выделение мочевины увеличивается. Синтез мочевины (орнитиновый цикл) происходит только в печени (рис.17).
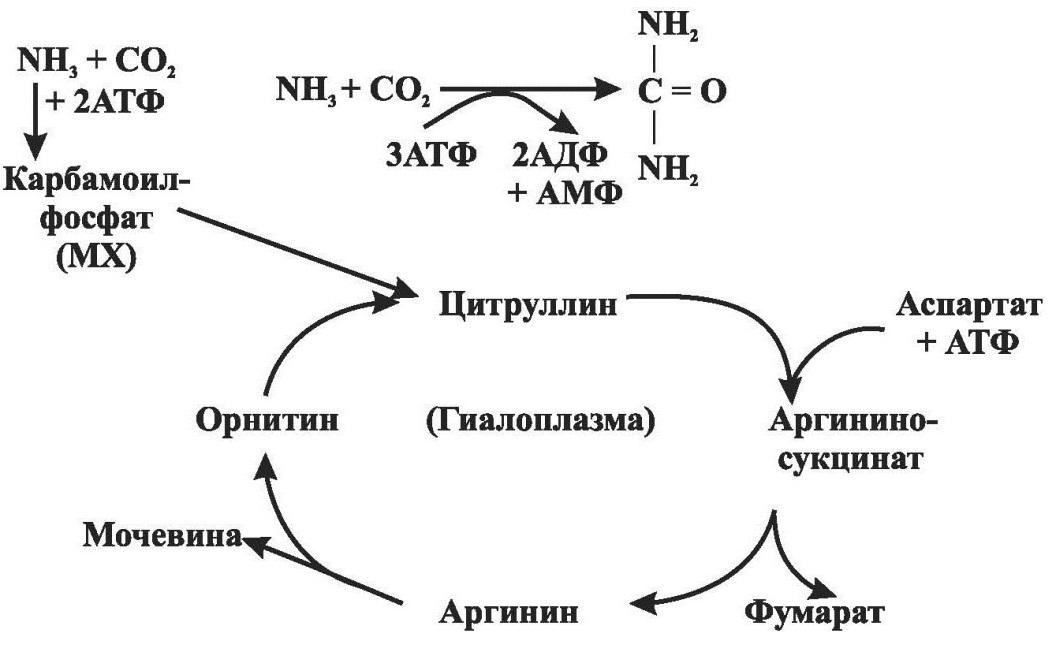
Рис. 17. Синтез мочевины
Мочевина – полный амид угольной кислоты (карбамид) – содержит 2 атома азота. Источником одного из них является аммиак, который связывается с СО2 с образованием карбамоилфосфата под действием карбамоилфосфатсинтетазы. Далее карбамоильная группа карбамоилфосфата переносится на орнитин с образованием цитруллина. В следующей реакции аргининосукцинатсинтетаза связывает цитруллин с аспартатом и образует аргининосукцинат. Аспартат является источником второго атома азота мочевины. Далее аргининосукцинат расщепляется на аргинин и фумарат, при этом аминогруппа аспартата оказывается в молекуле аргинина. Аргинин подвергается гидролизу под действием аргиназы, в результате чего образуется орнитин и мочевина.
Нарушение реакций обезвреживания аммиака может вызвать повышение концентрации аммиака в крови – гипераммониемию, что оказывает токсическое действие на организм. Причинами гипераммониемии могут выступать как генетические дефекты ферментов орнитинового цикла в печени, так и вторичное поражение печени в результате цирроза, гепатита. К симптомам гипераммониемии относят тремор, тошноту, рвоту, нечленораздельную речь, головокружение, судороги, потерю сознания. В тяжелых случаях может развиться кома с летальным исходом.
