- •Тесты по общей и неорганической химии
- •Для самоконтроля и подготовки к экзаменам
- •(Предназначены для студентов 1 курса
- •Факультетов очного и заочного обучения)
- •Строение атома. Периодический закон. Химическая связь.
- •Основные закономерности протекания химических реакций. Энергетика и направление реакций. Скорость и химическое равновесие.
- •Растворы и их свойства. Концентрация растворов. Электролиты. Химические равновесия в растворах электролитов.
- •Окислительно-восстановительные реакции. Комплексные соединения
- •Классы неорганических соединений. Химия s-, p- и d-элементов.
Классы неорганических соединений. Химия s-, p- и d-элементов.
300. Укажите группу основных оксидов:
а) CrO, Na2O; б) AI2O3, WO3; в) Na2O, WO3; г) CrO, CO.
301. Укажите формулы оксидов, не реагирующих со щелочами:
а) AI2O3; б) P2O5; в) ZnO; г) BaO.
302. При взаимодействии как с кислотами, так и со щелочами, если образуют:
а) оксид фосфора (V); б) оксид цинка;
в) оксид бария; г) оксид кремния.
303. Отметьте символ элемента, образующего как кислотный, так и основной оксиды:
а) P; б) Sr; в) Mn; г) CI.
304. В каком ряду указаны формулы оксидов, все из которых реагируют с разбавленным раствором NaOH c образованием солей?
а) CO2, SO2, AI2O3; б) P2O5, AI2O3, FeO;
в) Mn2O7, CaO, SiO2; г) K2O, SO3, ZnO.
305. Все оксиды какого ряда реагируют с серной кислотой?
а) оксид алюминия, оксид железа (Ш), оксид углерода (IV);
б) оксид бария, оксид азота (V), оксид кремния;
в) оксид алюминия, оксид железа (Ш), оксид меди (П);
г) оксид цинка, оксид калия, оксид хлора (VII).
306. Ангидрид азотистой кислот ы, это:
а) NO; б) NO2; в) N2O3; г) N2O5.
307. Чем надо подействовать на гидрофосфат калия, чтобы получить фосфат калия:
а) KOH; б) H2SO4; в) HCI; г) КCI.
308. Укажите группу амфотерных оксидов:
а) MnO и SiO2; б) AI2O3 и CrO3; в) MnO2 и MgO; г) SnO и AI2O3.
309. Оксид натрия реагирует:
а) только со щелочами; б) с кислотами, кислотными оксидами и водой;
в) только с основными и кислотными оксидами; г) только с кислотами.
310. Какое соединение можно использовать для нейтрализации серной кислоты:
а) HNO3; б) CH3OH; в) Mg(OH)2; г) NaHSO4.
311. Укажите кислоту, способную образовывать кислые соли:
а) HMnO4; б) H3PO4; в)HClO4; г) HNO3.
312. При написании какой формулы допущена ошибка:
а) Na3SbO4; б) (NH4)2HPO4; в) KH2PO4; г) (FeOH)2NO3.
313. Схема превращений: Э → ЭО → Э(ОН)2 соответствует генетическому ряду:
а) сера → оксид серы (IV) → гидроксид серы (IV);
б) натрий → оксид натрия → гидроксид натрия;
- 30 -
в) цинк → оксид цинка → гидроксид натрия;
г) алюминий → оксид алюминия → гидроксид алюминия.
314. Укажите ряд, содержащий только кислотные оксиды:
а) CO2; SiO2; SO3; CO; б) P2O5; CrO3; SeO3; Mn2O7;
в) P2O3; Al2O3; N2O5; SO2; г) Cr2O3; FeO3; Fe2O3; FeO.
315. Оксид кальция реагирует с:
а) Li2O; б) Cu; в) HNO3; г) MgO.
316. Какие свойства проявляют основания:
а) взаимодействуют с основными оксидами;
б) подвергаются гидролизу;
в) реагируют с металлами;
г) взаимодействуют с кислотными оксидами.
317. Все вещества какого ряда реагируют со щелочами?
а) сульфат железа (III), сульфат аммония, сернистая кислота;
б) хлорид меди (II) гидроксид аммония, карбонат натрия;
в) оксид фосфора (V), ортофосфорная кислота, сульфат натрия;
г) оксид серы (IV). гидроксид алюминия, хлорид бария.
318. Непосредственным растворением соответствующих оксидов в воде можно получить кислоты:
а) фосфорную; б) азотную; в) кремниевую; г) сернистую.
319. В каких рядах приведены формулы веществ, все из которых реагируют с соляной кислотой?
а) NH4OH, K2SO4, Ba(OH)2; б) Al, Al2O3, Al(OH)3;
в) NH4NO3, (NH4)2CO3; Cu(OH)2; г) CuO, Fe(OH)2, Ba(NO3)2.
320. Заряд каких кислотных остатков равен 2-?
а) гидрокарбонат-ион; б) гидрофосфат-ион;
в) дигидрофосфат-ион; г) нитрит-ион.
321. Какая кислота более слабая, чем фосфорная?
а) сернистая; б) серная; в) сероводородная; г) хлорная.
322. Какая соль образуется при взаимодействии водных растворов, содержащих:
а) 1 моль NaOH и 1 моль CO2; б) 1 моль H2SO4 и 1 моль Ba(OH)2;
в) 1 моль Cu(OH)2 и 3 моль HCl; г) моль P2O5 и 6 моль KOH.
323. Между какими веществами реакция в водных растворах не протекает?
а) нитрат меди + соляная кислота;
б) карбонат кальция + водный раствор углекислого газа;
в) гидроксид натрия + гидрокарбонат натрия;
г) хлорид железа (III) + нитрат серебра.
324. какой схеме реакции продуктом является средняя соль?
а) 1 моль H3PO4 и 2 моль KOH; б) 1 моль Al(OH)3 и 2 моль HNO3;
в) 3 моль Ca(OH)2 и 2 моль H3PO4; г) 1 моль NaOH и 1 моль H2S.
- 31 -
325. Качественный состав серной кислоты можно установить, используя:
а) BaCl2(р-р) и лакмус; б) AgNO3(р-р) и Zn;
в) BaCl2(р-р) и фенолфталеин; г) NaOH(р-р) и Zn.
326. Формула дигидроксосульфата железа (III):
а) (FeOH)2SO4; б) [Fe(OH)2]2SO4; в) FeOHSO4; г) Fe(HSO4)3.
327. Вещество «Х» в схеме превращений P → P2O5 → X это:
а) H3PO2; б) H3PO4; в) H3PO3; г) H2PO3.
328. Какая пара оксидов может реагировать между собой:
а) Na2O и MgO; б) P2O5 и SiO2; в) Na2O и Al2O3; г) FeO и CaO.
329. Какое вещество при растворении в воде образует кислоту:
а) CO; б) CaO; в) NH3; г) SO3.
330. В каком ряду оснований содержатся только щелочи:
а) KOH, Mg(OH)2, Be(OH)2; б) Ca(OH)2, KOH, RbOH;
в) Ba(OH)2, Cu(OH)2, NaOH; г) NH4OH, CsOH, NaOH.
331. Какой соли соответствует название «силикат свинца (II)»:
а) (PbOH)2SiO3; б) Pb(HSiO3)2; в) Pb(SiO3)2; г) PbSiO3.
332. Схема превращений Э → ЭО3 → H2ЭО4 соответствует генетическому ряду:
а) углерод → оксид углерода (IV) → угольная кислота;
б) углерод → оксид углерода (II) → угольная кислота;
в) сера → оксид серы (VI) → серная кислота;
г) сера → оксид серы (IV) → сернистая кислота.
333. Укажите группу оксидов, взаимодействующих с водой:
а) P2O5, SiO2; б) P2O5, CaO; в) NO, CO2; г) Na2O, CO.
334. Оксид серы (VI) не реагирует с:
а) NaOH; б) CaO; в) H2O; г) CO2.
335. Укажите кислоту, образующую кислые соли:
а) CH3COOH; б) HClO3; в) H3AsO3; г) HPO3.
336.При написании какой формулы допущена ошибка:
а) Ca(H2PO4)2; б) (Cr3+OH)2CO3; в) Cr3+(HSO4)3; г) Bi3+OHSO4.
337. Укажите группу оксидов, взаимодействующих с раствором NaOH:
а) Al2O3, CrO; б) CO, P2O5; в) FeO, SO2; г) Al2O3, P2O5.
338. Оксид углерода (IV) не реагирует с:
а) H2O; б) H2SO4; в) Ca(OH)2; г) CaO.
339. Какой гидроксид растворим в воде:
а) Be(OH)2; б) Mg(OH)2; в) Ba(OH)2; г) Cu(OH)2.
340. Какая из перечисленных солей относится к двойным:
а) KHSO4; б) MgOHCl; в) K2NaPO4; г) CaOCl2.
341. Элемент «Э» в схеме превращений Э → Э2О5 → Н3ЭО4 это:
а) сера; б) кальций; в) хлор; г) фосфор.
342. Какая пара оксидов не будет реагировать между собой:
а) BaO и MnO; б) SO3 и ZnO; в) MgO и CO2; г) Na2O и CrO3.
32 -
343. С каким из оксидов реагирует соляная кислота:
а) SiO2; б) SO2; в) CuO; г) CO2.
344. Какой гидроксид можно получить растворением в воде соответствующего оксида:
а) NH4OH; б) Zn(OH)2; в) Ca(OH)2; г) Fe(OH)2.
345. При написании какой формулы допущена ощибка:
а) (AlOH)3(PO4)2; б) Al(HSO4)3; в) Al(OH)2SO4; г) AlOHCO3.
346. Гидроксид цинка образуется при взаимодействии:
а) ZnO и H2O; б) ZnO и NaOH; в) ZnCl2 и Cu(OH)2; г) ZnCl2 и NaOH.
347. Раствор хлора в воде называется:
а) хлороводородной кислотой; б) хлорной кислотой;
в) хлористой кислотой; г) хлорной водой.
348. Свободные галогены из галогенид-ионов можно получить:
а) восстанавливая галогенид-ионы;
б) окисляя галогенид-ионы;
в) с помощью реакции диспропорционирования;
г) связывая галогенид-ионы.
349. В результате какой реакции может получиться свободный йод?
а) KIтв. + H2SO4 конц.; б) HIO3 р-р + F2;
в) HIO3 р-р + Cl2; г) HIO3 р-р + Br2.
350. Какие молекулы галогенов (простые вещества) способны проявлять окислительно-восстановительную двойственность?
а) ни один, все они только окислители; б) все, кроме фтора;
в) все, кроме йода; г) все галогены.
351. Кислородсодержащие кислоты и соли способны образовывать следующие галогены:
а) все, кроме йода; б) только фтор и хлор;
в) фтор, хлор и бром; г) все, кроме фтора.
352. Какой из галогенид-ионов обладает наибольшей восстановительной активностью:
а) фторид-ион; б) хлорид-ион; в) иодид-ион;
г) галогениды восстановительной способностью не обладают.
353. Бромоводород можно получить по реакции:
а) NaBrтв. + H2SO4 конц.; б) FeCl3 р-р + KBr р-р;
в) PBr3 + H2O; г) NaCl р-р + Br2 + H2O.
354. Какая из приведенных ниже реакций взаимного вытеснения галогенов возможна:
а) KI + Br2 → … б) KCl + I2 → …
в) KBr + I2 → … г) RCl + Br2 → …
355. В двух пробирках находятся растворы KBr и KI. В обе пробирки прибавлен раствор FeCl3. В каком случае галогенид-ион окислится до свободного галогена, если: Eo Fe3+/Fe2+ = 0,77 B; Eo Br2/2Br- = 1,06 B;
Eo I2/2I- = 0,54 B?
- 33 -
а) KBr и KI; б) KI; в) KBr; г) ни в одном случае.
356. Выберите реагент для окисления бромидов, если
Eo Br2/2Br- = 1,08 в.
а) FeCl3 Eo Fe3+/Fe2+ = 0,77 в.
б) KMnO4 Eo MnO4- + 8H+/Mn2+ + 4H2O = 1,52 в.
в) I2 Eo I2/2I- = 0,54 в.
г) NaBO2 Eo NO2- + 2H+/NO + H2O = 0,99 в.
357. Пробирка (I) содержит раствор KBr, а пробирка (II) – KI. В пробирки прибавили хлорную воду и органический растворитель (бензол). Как окрасится слой органического растворителя?
а) произойдет галогенирование бензола, и слои будут бесцветными;
б) I – желтый, II – розовый;
в) II – желтый, I – розовый;
г) I – желтый, II – коричневый.
358. Раствор какой галогеноводородной кислоты имеет наименьшую электропроводность (все растворы имеют одинаковую концентрацию):
а) электропроводность одинакова; б) HF;
в) HBr; г) HI.
359. Хлорид серебра растворяется в водном аммиаке потому, что:
а) в результате реакции образуется газ;
б) аммиак с хлорид-ионом образует хлорид аммония;
в) благодаря образованию щелочной среды раствора;
г) вследствие образования прочного комплекса иона серебра с аммиаком.
360. В присутствии какого йодсодержащего вещества крахмал окрашивается в синий цвет?
а) свободного йода; б) иодида калия;
в) любого йодсодержащего вещества; г) иодата калия.
361. Какие продукты образуются в реакции: Cl2 + KOH → …
а) KCl + KClO3 + H2O; б) KCl + H2O;
в) KClO3 + H2O; г) KClO + H2O.
362. Какие продукты образуются в реакции Cl2 + Ca(OH)2 → …
а) CaCl2 + H2O; б) Ca(ClO)2 + H2);
в) CaCl2 + Ca(ClO)2 + H2O; г) Ca(ClO)2 + Ca(ClO2)2 + H2O.
363. Какие вещества могут образоваться в результате взаимодействия
HNO3 + I2 → …
а) HI + NO2 + H2O; б) HI + NO + H2O;
в) HIO3 + NO + H2O; г) HI + NH4NO3 + H2O.
364. Какие вещества образуются в реакции Cl2 + I2 + H2O → …
а) HIO3 + HClO3; б) HIO3 + HCl;
в) HClO3 + HI; г) HIO + HClO.
365. Какие вещества вступили в реакцию, если в результате образовались
Cl2 и H2O.
- 34 -
а) HCl + HClO4 → б) HCl +HClO3 →
в) HClO4 + HClO3 → г) HClO + HClO3 →
366. Чему равен фактор эквивалентности (fэкв.) иодата калия в реакции:
KIO3 + 5KI + 3H2SO4 → 3I2 + 3K2SO4 + 3H2O.
а) 1; б) 1/2; в) 1/4; г) 1/5.
367. Какие вещества вступили в реакцию, если в результате образовались: I2 + K2SO4 + H2O?
а) KI + H2SO4 → б) KI + KIO3 + H2SO4 →
в) KIO3 + H2SO4 → г) KIO3 + KIO + H2SO4 →
368. Какая из нижеприведенных реакций будет протекать как окислительно-восстановительная?
а) HCIO4 + P2O5 → … б) NH3 + HI → …
в) HCI + NH4OH → … г) HCIO3 + HCI → …
369. Укажите, где одновременно находятся хлорид-, хлорат- и гипохлорит-ионы:
а) CIO4-, CIO3-, CI-; б) CIO- CIO3- CIO4-;
в) CI- CIO- CIO3-; г) CIO2- CI- CIO4-.
370. В трех пробирках имеются растворы KCI, KCIO, KCIO4. В какой из них раствор фенолфталеина изменит свою окраску?
а) во всех пробирках; б) в пробирке с KCIO4;
в) в пробирке с KCI; г) в пробирке с KCIO.
371. В каком случае процесс не является окислительно-восстановитель-ным?
а) CI2 → 2CI-; б) CIO- → CI- + CIO3-;
в) 2IO3- → I2; г) 2IO3- → I2O5.
372. Имеются растворы Na2SO4, KCI, KCIO4, KCIO и раствор индикатора лакмуса. Какую соль можно идентифицировать?
а) все CI-содержащие соли; б) только Na2SO4;
в) все соли; г) только KCIO.
373. Вычислите концентрацию (моль/л) Н+ -ионов в растворе хлороводородной кислоты, если рН раствора равняется 5.
а) 1.10-5; б) 5; в) 1.10-9; г) 0,5.
374. Наименее растворимым в воде соединением является
а) AgCI (ПРAgCI = 1,8.10-10); б) AgI (ПРAgI = 1,5.10-16);
в) AgBr (ПРAgBr = 4,4.10-13); г) AgCNS (ПРAgCNS = 1,16.10-12);
375. В реакции KMnO4 + SnCI2 + HCI → коэффициент при кислоте
а) 4; б) 6; в) 10; г) 16.
376. В цепочке превращений
H2SO4 KCIO3 Cu NaOH F2 KOH,t
BaCI2 → X1 → X2 → X3 → X4 → X5 → X6, X7
Конечными продуктами Х6, Х7 являются:
а) KCI,KCIO; б) KCIO, KCIO3; в) KCI, KCIO4; г) KCIO3, KCI.
- 35 -
377. Какое вещество необходимо включить в схему ионообменной реакции Na2S + … → … чтобы она могла считаться практически необратимой?
а) K2SO4; б) KOH; в) HCI; г) H2O.
378. Определите, какая из приведенных ниже схем реакций с участием сероводорода не является окислительно-восстановительной?
а) H2S + Br2; б) H2S + HNO3; в) H2S + H2O2; г) H2S + NH3.
379. Какие вещества вступили в реакцию, если в результате образовались сера и вода?
а) H2S + SO2 → … б) H2SO4 + SO2 → …
в) H2SO3 + SO3 → … г)SO3 + H2SO4 → …
380. В результате гидролиза сульфида натрия образуется:
а) сера и вода; б) гидросульфид натрия и щелочь;
в) сероводород и щелочь; г) сернистый газ и вода.
381.Каким способом можно подавить гидролиз сульфида натрия?
а) нагреванием раствора; б) подщелачиванием раствора;
в) подкислением раствора; г) разбавлением раствора.
382. Продуктами реакции SO2 + CI2 + H2O → … являются
а) H2SO3 + HCI; б) H2S+ HCIO4;
в) H2SO4 + HCI; г) S + HCIO3.
383. В какой реакции оксид серы (IV) проявляет восстановительные свойства?
а) SO2 + H2O → …; б) SO2 + KOH →…;
в) SO2 + H2S → …; г) SO2 + CI2 + H2O →….
384. Какая соль обесцвечивает подкисленный раствор перманганата калия, но не образует черного осадка с ионами свинца?
а) Na2SO3; б) Na2S; в) NaHSO4; г) Na2SO4.
385. Какая из солей гидролизуется с образованием основной соли (гидроксосоли)?
а) Na2S; б) K2SO3; в) здесь таких солей нет; г) Na2SO4.
386. К содержимому пробирки прибавили раствор соляной кислоты. При этом раствор помутнел и приобрел резкий запах. Какое соединение серы находилось в пробирке?
а) Na2SO4; б) Na2SO3; в) Na2S; г) Na2S2O3.
387. В каком случае идет процесс окисления
а) SO2 → SO32-; б) S → S2- + SO32-; в) SO32- → SO42- г) SO32-→ S.
388. Качественный состав H2SO4 можно установить, используя:
а) NaOH(р-р) и Zn; б) AgNO3(р-р) и Zn;
в) BaCI2 (p-p) и фенолфталеин; г) BaCI2 (p-p) и лакмус.
389. Какой реактив применяется для обнаружения сульфат-иона?
а) BaCI2 ; б) лакмус; в) известковая вода; г) AgNO3.
390. В каком случае реакция невозможна?
а) H2SO4 (конц.) + Cu; б) H2SO4 (разб..) + Mg;
в) H2SO4 (конц.) + Zn; г) H2SO4 (разб..) + Ag.
- 36 -
391. Какие вещества участвовали в реакции, если образовались соль и газообразный водород?
а) Cu + H2SO4 (конц.) → … б) Mg + H2SO4 (разб..) → …
в) Zn + H2SO4 (конц.) → … г) Cu + H2SO4 (разб.) →…
392. В какой схеме реакции реагирует разбавленная серная кислота?
а) Zn + H2SO4 → H2 + … б) Mg + H2SO4 → H2S+ …
в) Cu + H2SO4 → SO2 + … г) S + H2SO4 → SO2 + …
393. Какие вещества участвовали в реакции:
… + … → соль + SO2 + H2O?
а) Cu + H2SO4 (конц.); б) Zn + H2SO4 (разб.);
в) Cu + H2SO4 (разб.) г) S + H2SO4 (конц.)
394. Определите исходные вещества по продуктам реакции:
… + … → соль + Н2S+ H2O ?
а) S + H2SO4 (конц.) → … б) Zn + H2SO4 (разб.) → …
в) Cu + H2SO4 (разб.) → … г) Zn + H2SO4 (конц.) → …
395. Какие соединения серы (Na2S, Na2SO4, Na2SO3) не будут обесцвечивать подкисленный раствор перманганата калия?
а) только Na2SO4; б) обесцвечивать будут все;
в) Na2SO3 и Na2SO4; г) Na2S и Na2SO3.
396. С учетом гидролизуемости солей Na2S, Na2SO4, Na2SO3, расположите их в ряд в порядке возрастания величины рН растворов:
а) Na2S - Na2SO4 - Na2SO3; б) Na2SО4 - Na2SO3 - Na2S;
в) Na2S - Na2SO3 - Na2SO4; г) Na2SО3 - Na2SO4 - Na2S.
397. Какие вещества вступили в реакцию, если в реакции образовались NaCI + S + SO2 + H2O?
а) Na2SO4 + HCI; б) Na2SO3 + HCI;
в) Na2S + HCI; г) Na2S2O3 + HCI.
398. Какие продукты реакции образуются при взаимодействии тиосульфата натрия с иодом?
а) Na2S4O6 + NaI; б) Na2SO4 + NaI;
в) Na2SO4 + NaI; г) Na2S2O8 + NaI.
399. В какой схеме одним из продуктов будет тетратионат натрия?
а) Na2S2O3 + H2SO4; б) Na2S2O3 + AgCI;
в) Na2S2O3 + I2; г) Na2S2O3 + CI2.
400. В какой из реакций с участием перекиси водорода одним из продуктов реакции будет газообразный кислород?
а) H2O2 + KI + H2SO4 → … б) H2O2 + H2S → …
в) H2O2 + KMnO4 + H2SO4 → … г) H2O2 + HI → …
401. В реакции KIтв. + H2SO4 конц. → коэффициент при окислителе:
а) 1; б) 3; в) 4; г) 5.
- 37 -
402. В цепочке
I2 Fe O2 Br2+H2O S NaOHизб.
H2S → X1 → X2 → X3 → X4 → X5 → X6 неизвестное вещество Х6 – это
а) Na2SO3; б) Na2S; в) NaHSO3; г) Na2SO4.
403. Стандартные теплоты образования (∆Нfo, кДж/моль) водородных соединений р-элементов V группы имеют ниже приведенные значения. Какое из этих соединений самое термически неустойчивое?
а) NH3 б) SbH3 в) AsH3 г) PH3
-46,2 +142,1 +66,0 +5,1
404. Составьте уравнение взаимодействия аммиака с водой в протолитической форме и предложите способ увеличения в равновесной смеси ионов аммония:
а) подщелочить раствор сильным основанием;
б) подщелочить раствор слабым основанием;
в) подкислить раствор;
г) охладить раствор.
405. Укажите свойство, не характерное для аммиака:
а) хорошая растворимость в воде;
б) обладает окислительно-восстановительной двойственностью;
в) взаимодействует с кислотами;
г) легче воздуха.
406. Какое свойство характерно для аммиака:
а) газ тяжелее воздуха; б) незначетельно растворим в воде;
в) водный раствор имеет рН>7; г) не взаимодействует с кислотами.
407. С какой частицей молекула аммиака может образовать донорно-акцепторную связь?
а) СH4; б) H2; в) H+; г) H-.
408. Какая из солей аммония, гидролизуясь, дает тем не менее нейтральную среду раствора?
а) (NH4)2SO4; б) NH4CH3COO; в) NH4NO3; г) NH4CI.
409. Какое вещество необходимо включить в схему ионообменной реакции NH4CI + … → , чтобы она могла считаться практически необратимой?
а) H2SO4; б) NaOH; в) KNO3; г) Ba(NO3)2.
410. К содержимому пробирки прибавили щелочь и нагрели. Влажная лакмусовая бумажка, помещенная над отверстием пробирки, изменила окраску. Какое вещество находилось в пробирке?
а) Fe(NO3)3; б) NaNO2; в) Ba(NO3)2; г) (NH4)2SO4.
411. Какой из нитратов не образует при термическом разложении ни одного твердого продукта?
а) Zn(NO3)2; б) Cu(NO3)2; в) NH4NO3; г) NaNO3.
- 38 -
412. В какой из реакций NH3 проявляет восстановительные свойства?
а) NH3 + H3PO4 → … б) NH3 + CuO → Cu + …
в) Na + NH3 → NaNH2 + H2; г) NH3 + H2O → …
413. Известно, что все оксиды делятся на четыре группы. Среди оксидов азота присутствуют:
а) только кислотные; б) кислотные и амфотерные;
в) кислотные, амфотерные и безразличные; г) кислотные и безразличные.
414. С каким утверждением относительно свойств оксида азота (I) Вы не согласны:
а) его называют «веселящий газ»; б) бесцветный;
в) является ангидридом азотистой кислоты; г) тяжелее воздуха.
415. Какое свойство не характерно для оксида азота (П):
а) кислотный оксид; б) практически не растворим в воде;
в) продукт взаимодействия Cu + HNO3 (p); г) бесцветный газ.
416. Какой оксид азота реагировал со щелочью:
… + KOH → KNO2 + H2O?
а) N2O3; б) N2O; в) NO2; г) N2O5.
417. Какое соединение азота находилось в пробирке, если при его подкислении прошла реакция:
… + HCI → хлорид металла + NO + NO2 + H2O?
а) NaNO3; б) KNO3; в) Ca(NO3)2; г) NaNO2.
418. Укажите свойство не характерное для оксида азота (IV):
а) хорошо растворим в воде; б) бесцветный газ;
в) тяжелее воздуха; г) ангидрид азотной и азотистой кислот.
419. Какие вещества образуются в реакции: NO2 (газ) + KOH → …
а) NH4NO2 + KNO2 + H2O; б KNO3 + H2O;
в) KNO3 + KNO2 + H2O; г) KNO2 + H2O.
420. С помощью какой реакции обычно получают в лаборатории оксид азота (IV)?
а) NH3 + O2 → … б) Cu + HNO3(конц.) → …
в) HNO3 + (to) → … г) Cu + HNO3 (разб.) → …
421. Какие вещества образуются в реакции N2O5 + NaOH → …?
а) NaNO3 + H2O; б) NaNO2 + H2O;
в) NaNO3 + NaNO2 + H2O; г) Na3N + H2O.
422. Какое азотсодержащее соединение образуется в результате реакции: NaNO2 + KI + H2SO4 → … + I2 + K2SO4 + Na2SO4 + H2O ?
а) NaNO3: б) KNO3; в) NO; г) HNO2.
423. Какие вещества образуются при взаимодействии HNO3 и KI?
а) I2,NO; б) I2, NO2; в) I2, HNO3; г) I2, N2O3.
424. Какое азотсодержащее соединение образуется в результате реакции: KMnO4 + KNO2 + H2SO4 → MnSO4 + K2SO4 + … + H2O?
а) KNO3; б) HNO2; в) NO; г) NH4NO3.
- 39 -
425. Чему равна молярная масса эквивалента нитрита натрия, если участвуя в ОВР, он восстанавливается до оксида азота (II).
а) М б) М в) М г) М
3 2 1 5
426. С каким утверждением Вы не согласны: «Азотная кислота, как и все сильные кислоты:
а) взаимодействует с активными металлами с образованием водорода;
б) хорошо диссоциирует на ионы H+ и NO3-;
в) при взаимодействии с металлами образует нитраты;
г) является очень сильным окислителем.
427. Какие пары вещества не могут совместно присутствовать в растворе, т.к. реагируют друг с другом?
а) HNO3 и H3PO4; б) HNO3 и K2SO4;
в) HNO3 и H2S; г) NH3 и KOH.
428. Какое вещество реагировало с азотной кислотой, если в результате реакции образовались: оксид + NO + H2O?
а) Cu + HNO3 (конц.); б) Fe + HNO3 (разб.);
в) С + HNO3 (конц.); г) Al + HNO3 (разб.).
429. В какой из реакций можно ожидать восстановление азотной кислоты до соли аммония?
а) Cu + HNO3 (конц.) → … б) Zn + HNO3 (разб.) → …
в) Cu + HNO3 (разб.) → … г) Zn + HNO3 (конц.) → …
430. Какое вещество образовалось в реакции:
As + HNO3 (к) → … + NO + H2O?
а) As(NO3)3; б) As(NO3)5; в) H3AsO4; г) AsH3.
431. Какое вещество образовалось в реакции:
Bi + HNO3 (р) → … + NO + H2O?
а) Bi2O5; б) HBiO3; в) Bi2O3; г) Bi(NO3)3.
432. Какой из нитратов разлагается при нагревании на нитрит и кислород?
а) AgNO3; б) Cu(NO3)2; в) Fe(NO3)3; г) NaNO3.
433. В реакции KMnO4 + KNO2 + H2SO4 → коэффициент при восстановителе:
а) 2; б) 3; в) 4; г) 5.
434. В цепочке превращений
+O2 +O2 +H2O NH3 toC
NH3 - - - - - - - X1 - - - - - - X2 - - - - - - - - X3 - - - - - - - X4 - - - - - - X5
Cat, toC +O2
Конечным продуктом Х5 является:
а) N2; б) N2O; в) NO2; г) N2O5.
435. Фосфор является окислителем, реагируя с …
а) хлором; б) магнием;
в) бертолетовой соль (KClO3); г) азотной кислотой.
- 40 -
436. Фосфин можно получить при взаимодействии:
а) фосфата кальция с серной кислотой;
б) оксида фосфора (V) с водой;
в) фосфида кальция с соляной кислотой;
г) кальция с фосфорной кислотой.
437. Какая пара оксидов может реагировать между собой?
а) P2O5 и SiO2; б) P2O5 и Al2O3; в) P2O5 и SO3; г) P2O5 и N2O5.
438. Какая из кислот фосфора способна проявлять восстановительные свойства?
а) ни одна из кислот фосфора их не проявляет;
б) ортофосфорная кислота;
в) метафосфорная;
г) фосфорноватистая.
439. Какую структурную формулу можно придать фосфористой кислоте, учитывая ее двухосновность?
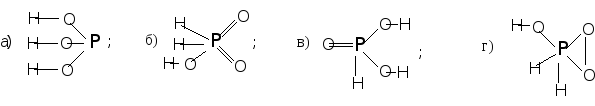
440. Укажите, где одновременно присутствуют фосфид-, фосфит-,
дигидрофосфат кальция.
а) Ca(H2PO4)2, CaHPO3, Ca3P2;
б) Ca(H2PO4)2, Ca3(PO4)2, CaHPO4;
в) Ca3P2, Ca(PO4)2, CaHPO4;
г) CaHPO4, Ca(H2PO4)2, Ca3P2.
441.Какая формула может быть применена для вычисления константы гидролиза дигидрофосфата натрия NaH2PO4:
а) Kв б) Kв в) Kв г) Kв
[OH-] K1(H3PO4) K3(H3PO4) K2(H3PO4)
442. Какая формула может быть применена для вычисления константы гидролиза фосфата натрия Na3PO4:
а) Kв б) Kв в) Kв г) Kв
[OH-] K3(H3PO4) K1(H3PO4) K2(H3PO4)
443. Какая формула может быть применена для вычисления константы гидролиза гидрофосфата натрия Na2HPO4:
а) Kв б) Kв в) Kв г) Kв
[OH-] K3(H3PO4) K1(H3PO4) K2(H3PO4)
444. Равновесие HPO42- + H2O ↔ PO43- + H3O+ смещается влево при добавлении:
а) K3PO4; б) K2SO4; в) H2O; г) KCl.
- 41 -
445. В реакции NH3 + H2PO4- ↔ NH4+ + HPO42- дигидрофосфат-ион ведет себя как:
а) донор протонов; б) восстановитель;
в) акцептор протонов; г) окислитель.
446. Чему равна молярная масса эквивалента фосфорной кислоты, если ее нейтрализация идет по реакции:
H3PO4 + 2NaOH → Na2HPO4 + 2H2O?
а) М б) М в) М г) М
1 4 3 2
447. Сокращенное ионное уравнение 3Ca2+ + 2PO43- → Ca3(PO4)2↓ cоответ-
ствует взаимодействию:
а) CaO + H3PO4; б) CaCO3↓ + H3PO4;
в) Ca + Na3PO4; г) CaCl2 + Na3PO4.
448. В каком ряду происходит уменьшение рН растворов равных концентраций?
а) Na3PO4–NaH2PO4–Na2HPO4-H3PO4; б) H3PO4–NaH2PO4–Na2HPO4-Na3PO4;
в) Na3PO4–Na2HPO4–NaH2PO4-H3PO4 г) H3PO4–Na2HPO4–NaH2PO4-Na3PO4.
449. В реакции KMnO4 + PH3 + H2SO4 → коэффициент при восстановителе
а) 5; б) 4; в) 3; г) 8.
450. В цепочке Ca3(PO4)2 → A → Mg3P2 → B → P2O5 → C → NaH2PO4
формула вещества, которое не является одним из обозначенных на схеме буквами А, В, С.
а) H3PO4; б) P; в) PH3; г) PCl3.
451. При растворении хлорида сурьмы (III) в воде часто образуется осадок оксосоли из-за гидролиза. Как предотвратить его образование?
а) добавить больше воды; б) подогреть раствор;
в) подкислить раствор; г) подщелочить раствор.
452. Раствор, содержащий смесь солей SbCl3 и BiCl3 обработали избытком щелочи, а затем профильтровали. Где будут находиться соединения сурьмы и висмута?
а) висмут – на фильтре, сурьма – в фильтрате; б) оба – на фильтре;
в) сурьма – на фильтре, висмут – в фильтрате; г) оба – в фильтрате.
453. Вставьте в уравнение реакции недостающий продукт:
As2O3 + Zn + H2SO4 → … + ZnSO4 + H2O.
а) H3AsO4; б) H3AsO3; в) AsH3; г) HAsO3.
454. Какое вещество образовалось в реакции:
K2HAsO3 + KMnO4 + H2SO4 → … + MnSO4 + K2SO4 + H2O?
а) H3AsO3; б) K2HAsO4; в) As2O3; г) AsH3.
455. Допишите недостающий продукт реакции:
SbCl3 + KMnO4 + HCl → … + MnCl2 + KCl + H2O.
а) SbCl5; б) Sb(OH)3; в) Sb2O3; г) SbH3.
- 42 -
456. Допишите недостающий продукт реакции:
Bi(NO3)3 + Br2 + NaOH → … + NaBr + H2O.
а) Bi(OH)2NO3; б) NaBiO3; в) Bi2O3; г) Bi(OH)3.
457. Допишите недостающий продукт реакции:
Na2[Sn(OH)4] + Bi(NO3)3 + NaOH → Na2[Sn(OH)6] + … + NaNO3.
а) Bi; б) Bi2O3; в) NaBiO3; г) Bi(OH)3.
458. Какая ионная полуреакция отвечает переходу оксида висмута (III) в висмутат-ион (среда щелочная)?
а) Bi2O3 + 6OH- → 2BiO3- + 3H2O + 4e; б) Bi2O3 → BiO3- + 2e;
в) Bi2O3 + 3H2O → 2BiO3- + 6H+ + 4e; г) 2Bi+3 → 2Bi+5- + 4e.
459. Чему равна молярная масса эквивалента гидроарсената натрия Na2HAsO4, если, участвуя в ОВР, он восстанавливается до арсина?
а) М б) М в) М г) М
2 4 6 8
460. Допишите недостающий продукт реакции:
KBiO3 + MnSO4 + HNO3 → HMnO4 + … KNO3 + K2SO4 + H2O.
а) HBiO3; б) Bi(NO3)3; в) Bi(OH)3; г) Bi2O3.
461. В реакции MnSO4 + KBiO3 → коэффициент при окислителе:
а) 2; б) 5; в) 14; г) 16.
462. Качественную реакцию на углекислый газ проводят с использованием:
а) сероводородной воды; б) хлорной воды;
в) бромной воды; г) известковой воды.
463. В какой схеме одним из продуктов реакции будет CO2?
а) Al2(SO4)3 + Na2CO3 + H2O; б) Ca(HCO3)2 + Ca(OH)2;
H2SO4
в) K2CO3 + H2O; г) HCOOH - - - - - - >
464. В какой схеме одним из продуктов реакции будет CO2?
а) Na2CO3 + H2O; б) NaHCO3 + NaOH;
в) CaC2 + H2O; г) NaHCO3 - - t- ->.
465. 0,53 г карбоната натрия содержатся в 100 мл этого раствора. Вычислить молярную концентрацию эквивалента этого раствора.
M(Na2CO3) = 106 г/моль.
а) 0,05; б) 0,01; в) 5.10-5; г) 0,1.
466. Какая формула может быть применена для вычисления константы гидролиза гидрокарбоната натрия NaHCO3?
а) Кв б) Кв в) Кв г) Кв
K2(H2CO3) K1(H2CO3) [OH-] [H+]
467. В каком из нижеприведенных растворов индикатор метилоранж приобретет розовую окраску?
а) (NH4)2CO3; б) Na2CO3; в) NaHCO3; г) SnCl2.
- 43 -
468. Качественную реакцию на силикат-ион проводят, … раствор. При этом образуется студневидный осадок. (Вставьте пропущенное слово.)
а) подкисляя; б) нагревая; в) охлаждая; г) подщелачивая.
469. Сравните реакцию среды в растворах силиката и карбоната натрия при одинаковых концентрациях и температуре:
а) оба раствора одинаково щелочные;
б) карбонат более щелочной, чем силикат;
в) силикат более щелочной, чем карбонат;
г) оба раствора одинаково кислые.
470. Какое вещество образовалось в реакции
Sn + HNO3 р → … + NO + H2O
а) H2SnO3; б) Sn(NO3)2; в) Sn(NO3)4; г) H4SnO4.
471. Какое соединение олова участвовало в реакции:
… + Bi(NO3)3 + NaOH → Bi + Na2[Sn(OH)6 + NaNO3?
а) Sn(OH)2; б) Sn(OH)4; в) SnO2: г) Sn(NO3)4.
472. Какое соединение олова проявляет восстановительные свойства:
а) Na2[Sn(OH)6]; б) SnCl2; в) SnCl4; г) SnO2.
473. В каком случае идет процесс восстановления?
а) [Sn(OH)4]2- → SnO22-; б) SnO22- → SnO32-;
в) [Sn(OH)6]2- → SnO32-; г) SnO32- → SnO22-.
474. Какая ионная полуреакция отвечает окислению Pb2+ до PbO2 в щелочной среде?
а) Pb2+ → Pb4+ + 2е; б) Pb2+ + 2H2O → PbO2 + 4H+ + 2е;
в) Pb2+ + 4OH- → PbO2 +2H2O + 2е; г) Pb2+ → Pb+4O2 + 2е.
475. Какое соединение свинца участвовало в реакции:
… + MnSO4 + H2SO4 → PbSO4 + HMnO4 + H2O?
а) PbO2; б) PbO; в) Pb(OH)2; г) Pb.
476. Какая ионная полуреакция отвечает восстановлению PbO2 в кислой среде?
а) PbO2 + 2H2O + 2е → Pb2+ + 4OH-; б) Pb+4O2 + 2е → Pb2+;
в) PbO2 + 4H+ + 2е → Pb2+ + 2H2O; г) Pb4+ + 2е → Pb2+/
477. Наиболее слабый восстановитель:
а) S2- Eo (S2-/H2S) = 0,14 в; б) S2O32- Eo (S4O62-/2S2O32-) = 0,096 в;
в) Sn2+ Eo (Sn4+/Sn2+) = 0,15 в; г) Pb2+ Eo (PbO2 + 4H+/Pb2+ + 2H2O) = 1,46 в.
478. Установите исходные вещества в схеме реакции
… → PbCl2 + Cl2 + H2O
а) PbCl4 + H2O; б) PbCl2 + H2O; в) PbO2 + HCl; г) PbO + HCl.
479. В реакции PbO2 + MnSO4 + HNO3 → коэффициент при окислителе
а) 2; б) 3; в) 1; г) 5.
480. В цепочке превращений
HNO3(к) NaOH NaOHизб. HCl
Pb - - - - - - - > Х1 - - - - - - - > Х2 - - - - - - - > Х3 - - - - - -> Х4
- 44 -
Конечным продуктом Х4 является
а) Na2PbO3; б) Pb(OH)2; в) Na2[PbCl4]; г) Na2PbO2.
481. Могут ли соединения трехвалентного бора (BF3, BCl3) образовывать донорно-акцепторные связи с другими соединениями?
а) не могут, т.к. это валентно-насыщенные соединения;
б) могут, являясь донорами электронных пар;
в) могут, являясь акцепторами электронных пар;
г) не могут, т.к. у них отсутствуют неподеленные пары и вакантные орбита
ли.
482. Соединения бора окрашивают пламя в … цвет.
а) желтый; б) фиолетовый; в) зеленый; г) кирпично-красный.
483. Допишите пропущенный продукт реакции:
Na2B4O7 + H2SO4 + H2O → … + Na2SO4.
а) B2H6; б) H2B4O7; в) HBO2; г) H3BO3.
484. При взаимодействии тетрабората натрия с водным раствором сильных кислот образуется:
а) H2B4O7; б) H3BO3; в) HBO2; г) B2O3.
485. В каком объеме воды (пл. 1 г/мл) необходимо растворить 0,5 г AlCl3, чтобы получить раствор с массовой долей 10%?
а) 5 мл; б) 4,5 мл; в) 45 мл; г) 50 мл.
486. Раствор, содержащий смесь солей сульфатов алюминия и хрома (III), обработали избытком щелочи, а затем профильтровали. Где будут находиться соединения алюминия и хрома?
а) оба – на фильтре; б) алюминий – на фильтре, хром – в фильтрате;
в) оба – в фильтрате; г) хром – на фильтре, алюминий – в фильтрате.
487. Раствор, содержащий смесь солей MgCl2 и AlCl3 обработали избытком щелочи, а затем профильтровали. Где находятся соединения магния и алюминия?
а) оба – на фильтре; б) магний – на фильтре, алюминий – в фильтрате;
в) оба – в фильтрате; г) алюминий – на фильтре, магний – в фильтрате.
488. К раствору сульфата алюминия добавили по каплям раствор некоторого вещества до избытка. При этом в пробирке сначала образовался амфотерный осадок, который затем растворился. Какое вещество прибавили к соли алюминия?
а) NaOH; б) Na3PO4; в) NH4OH; г) HNO3.
489. Какие вещества образуются в реакции:
Al2(SO4)3 + Na2CO3 + H2O →
а) AlOHSO4 + NaHCO3; б) Al(OH)3 + CO2 + Na2SO4;
в) [Al(OH)2]2SO4 + H2CO3; г) Al2(CO3)3 + Na2SO4.
490. d- и p-элементы одной группы различаются между собой:
а) числом валентных электронов;
б) числом наружных электронов;
- 45 -
в) высшей положительной степенью окисления;
г) формулой высшего оксида.
491. В чем сходство d- и p-элементов одной группы?
а) одинаковое число валентных электронов;
б) одинаковое число наружных электронов;
в) те и другие имеют отрицательные степени окисления;
г) свойства простых веществ похожи.
492. Какое свойство характерно для элементов подгруппы марганца:
а) в подгруппе имеются как металлы, так и неметаллы;
б) высшая положительная степень окисления +7;
в) как и галогены, имеют отрицательную степень окисления -1;
г) простые вещества являются окислителями.
493. В чем различие элементов подгруппы марганца и галогенов?
а) в свойствах простых веществ;
б) в числе валентных электронов;
в) в высшей положительной степени окисления;
г) в формулах высших оксидов.
494. Какое свойство не характерно для элементов подгруппы хрома:
а) высшая степень окисления +6;
б) валентные электроны (n-1)d5ns1;
в) оксиды обладают основными свойствами;
г) водородных соединений не образуют.
495. С каким утверждением относительно элементов подгруппы меди Вы
не согласны:
а) это металлы;
б) отрицательных степеней окисления не имеют;
в) летучих соединений с водородом не образуют;
г) в ряду напряжения стоят до водорода.
496. С каким утверждением относительно элементов подгруппы цинка Вы не согласны?
а) оксиды этих элементов обладают основными свойствами;
б) высшая степень окисления +2;
в) отрицательных степеней не образуют;
г) простые вещества являются восстановителями.
497. Атому элемента марганца отвечает сокращенная электронная формула:
а) [Ar] 3d54s2; б) [Ne] 3s23p5;
в) [Ar3d10] 4s24p5; г) [Kr] 4d55s2.
Найдите соответствие:
498. 3d104so а) Cuo
499. 3d104s1 б) Zn2+
500. 5d86so в) Hg2+
501. 5d106so г) Au3+
- 46 -
502. Катион какой соли имеет заряд +3?
а) [Cr(OH)2]2SO4: б) Fe(HCO3)3; в) ZnOHBr; г) FeOH(CH3COO)2.
503. В каком из приведенных соединений степень окисления хрома самая высокая?
а) Fe(CrO2)2; б) CrO(OH); в) Na3[Cr(OH)6]; г) Na2Cr3O10.
504. В каком ряду оксидов и ионов железа наблюдается возрастание (усиление) кислотных свойств?
а) FeO – FeO42- - FeO33- - FeO2-; б) FeO42- - FeO33- - FeO2- - FeO;
в) FeO – FeO2- - FeO33- - FeO42;- г) FeO42- - FeO – FeO2- - FeO33-.
505. Какая реакция не приводит к растворению осадка?
а) Cu(OH)2 + HNO3 (конц.); б) Ag2O + NH3.H2O(конц.);
в) Ag2O + NaOH(конц.); г) Cu(OH)2 + NaOH (конц.).
506. Раствор, содержащий смесь солей ZnCI2 и CdCI2 обработали избытком щелочи, а затем профильтровали. Где будут находиться соединения цинка и кадмия?
а) кадмий – на фильтре, цинк – в фильтрате;
б) оба – в фильтрате;
в) цинк – на фильтре, кадмий – в фильтрате;
г) оба – на фильтре.
507. В пробирке находится раствор соли хрома (Ш), рН раствора 12. Какая соль в растворе?
а) Cr2(SO4)3; б) Cr(NO3)3; в) CrCI3; г) KCrO2.
508. Какую соль необходимо прибавить к раствору сульфата хрома (Ш), чтобы прошел полный (совместный) гидролиз?
а) NH4CI; б) Na2CO3; в) Na2SO4; г) ZnCI2.
509. Какой раствор FeCI3 или FeCI2 при одинаковых условиях (концентрация, температура) более кислый?
а) оба раствора имеют нейтральную реакцию среды;
б) FeCI3 более кислый;
в) оба раствора имеют равную кислотность;
г) FeCI2 более кислый.
510. Различаются ли между собой рН растворов ZnCI2 и CdCI2 равных концентраций?
а) рН одинаковы, т.к. концентрации равны;
б) рН одинаковы, т.к. обе соли одной и той же кислоты;
в) рН (ZnCI2) < рН (CdCI2);
г) рН ((CdCI2) < рН (ZnCI2).
Установить соответствие между названием кислоты и формулой ее соли:
511. Марганцовистая а) K4MnO4
512. Марганцеватистая (мета) б) KMnO4
513. Марганцовая в) K2MnO3
514. Марганцеватистая (орто) г) K2MnO4
- 47 -
515. Как известно, соединения марганца имеют разнообразную окраску. В какой цвет окрашены манганаты?
а) красно-фиолетовый; б) зеленый;
в) бесцветный; г) бурый (черный).
516. Какая ионная полуреакция отвечает восстановлению в нейтральной среде MnO4- - иона в MnO2?
а) MnO4- + 4H+ + 3e → MnO2 + 2H2O; б) Mn+7 + 3e → Mn+4;
в) MnO4- + 2H2O + 3e → MnO2 + 4OH-; г) MnO4- + 3e → MnO2.
517. Какая ионная полуреакция соответствует окислению в щелочной среде оксида марганца (IV) в манганат-ион:
а) MnO2 + 2H2O → MnO42- + 4H+ + 2e; б) Mn+4 → Mn+6 + 2e;
в) Mn+4O2 → Mn+6O4 + 2e; г) MnO2 + 4OH- → MnO42- + 2H2O + 2e.
518. В какой из нижеприведенных реакций окраска раствора изменилась с розовой на зеленую?
а) KMnO4 + Na2SO3 + H2SO4 → … б) KMnO4 + Na2SO3 + H2O → …
в) KMnO4 + H2O2 → … г) KMnO4 + Na2SO3 + KOH → …
519. Допишите недостающий продукт реакции:
MnO2 + PbO2 + HNO3 → … + Pb(NO3)2 + H2O.
а) Mn(NO3)2; б) HMnO4; в) Mn(NO3)4; г) Mn2O3.
520. Допишите недостающий продукт реакции:
KMnO4 + H2C2O4 + H2SO4 → … + CO2 + K2SO4 + H2O.
а) MnSO4; б) MnO2; в) K2MnO4; г) Mn(OH)2.
521. Чему равна молярная масса эквивалента перманганата калия, который, участвуя в реакции, восстанавливается до манганата калия?
а) М б) М в) М г) М
2 1 5 3
522. Допишите недостающий продукт реакции:
KMnO4 + NaNO2 + H2O → … + NaNO3 + KOH.
а) Mn(NO3)2; б) MnO2; в) K2MnO4; г) Mn(OH)2.
523. Допишите недостающий продукт реакции:
KMnO4 + FeSO4 + H2SO4 → … + MnSO4 + K2SO4 + H2O.
а) FeO; б) Fe2(S)4)3; в) Fe(OH)2; г) Fe2O3.
524. В какой схеме одним из продуктов реакции будет MnO2?
а) K2MnO4 + Na2SO3 + H2O; б) MnSO4 + PbO2 + HNO3;
в) KMnO4 + NaNO2 + KOH; г) Mn + H2SO4(p).
525. В какой схеме одним из продуктов реакции будет MnO2?
а) KMnO4 + Na2SO3 + KOH; б) KMnO4 + NaNO2 + H2O;
в) KMnO4 + KI + H2SO4; г) MnSO4 + NaBiO3 + HNO3.
526. В какой схеме одним из продуктов реакции будет манганат калия?
а) KMnO4 + KI + H2O; б) Mn(NO3)2 + KOH;
в) MnO2 + KCIO3 + KOH; г) MnO2 + KBr + H2SO4.
527. Какие галогенид-ионы можно окислить перманганатом калия в нейтральной среде (Ео MnO4-/MnO2 = 0,60 B) до свободных галогенов, если потенциалы соответствующих пар равны:
CI2 /2CI- Br2/2Br- I2/2I-
Ео, В 1,36 1,06 0,54
а) все, кроме хлорид-иона; б) только иодид-ион;
в) все, кроме иодид-иона; г) ни один из галогенов.
528. Напишите уравнение реакции KMnO4 + Н2O2 + H2SO4 →
сумма коэффициентов при окислителе и восстановителе (разб.)
а) 2; б) 7; в) 5; г) 10.
529. Напишите уравнение реакции KMnO4 + СаС2O4 + H2SO4 →
Сумма коэффициентов при окислителе и восстановителе
а) 5; б) 6; в) 7; г) 8.
530. Напишите уравнение реакции KMnO4 + Na2SO3 + H2SO4 (разб.)
Фактор эквивалентности окислителя
а) 1; б) 1/3; в) 1/5; г) ½.
531. Конечным продуктом в цепочке превращений
КOH Br2 KCIO3, KOH CI2
MnSO4 → Х1 → MnO2 → X2 → X3
является:
а) MnCI2; б) KMnO4; в) K2MnO4; г) MnO2.
Установите соответствие между названием кислоты и ее формулой:
532. Хромовая а) HCrO2
533. Дихромовая б) H2CrO4
534. Ортохромистая в) H3CrO3
535. Мета хромистая г) H2Cr2O7
536. В каком случае происходит процесс восстановления хрома:
а) хромат-ион → дихромат-ион;
б) дихромат-ион → хромат-ион;
в) хромат-ион → гидроксид хрома (Ш);
г) хром (Ш)-ион → дихромат-ион.
337. Какое соединение хрома образовалось в результате реакции
К2Cr2O7 + KOH → …, если окраска изменилась с оранжевой на желтую?
а) K2CrO4; б) Cr2O3; в) KCrO2; г) K3[Cr(OH)6].
538. Какое соединение хрома участвовало в реакции:
… + CI2 + KOH → K2CrO4 + KCI + H2O?
а) K3[Cr(OH)6]; б) CrO3; в) K2Cr2O7; г) CrO2CI2.
539. Допишите недостающий продукт реакции:
Cr(OH)3 + KCIO3 + KOH → … + KCI + H2O.
а) K3[Cr(OH)6]; б) K[Cr(OH)4]; в) K2CrO4; г) Cr2O3.
540. Какие газы H2S, CO2, CI2, SO2 будут поглощаться (взаимодействовать) при пропускании их через подкисленный раствор дихромата калия?
а) все указанные газы; б) H2S, SO2;
в) только H2S; г) все, кроме CI2.
- 49 -
541. Допишите недостающий продукт реакции:
K2Сr2O7 + Na2SO3 + H2SO4 → … + K2SO4 + Na2SO4 + H2O
а) Cr2(SO4)3; б) K2CrO4; в) CrO3; г) Cr2O3.
542. Чему равен фактор эквивалентности К2CrO4, который, участвуя в реакции, восстанавливается до Cr2(SO4)3?
а) 1 б) 1 в) 1 г) 1
3 2 6 9
543. Допишите недостающий продукт реакции
K2Сr2O7 + H2O2 + H2SO4 → … + K2SO4 + O2 + H2O
а) CrO3; б) Cr2(SO4)3; в) K2CrO4; г) H2CrO4.
n Ep
544. Величина «n» в формуле Кр= 100,059 для уравнения
2CrO2- + CIO3- + 2OH- → 2CrO42- + CI- + H2O равна
а) 3; б) 4; в) 6; г) 9.
545.Напишите уравнение реакции NaCrO2 + H2O2 + NaOHразб.→
Сумма коэффициентов при восстановителе и окислителе
а) 5; б) 2; в) 3; г) 7.
546. Напишите уравнение реакции K2Сr2O7 + FeSO4 + H2SO4 →
Коэффициент при восстановителе
а) 6; б) 7; в) 3; г) 2.
547. Напишите уравнение реакции K2Сr2O7 + KI + H2SO4 →
Cумма коэффициентов при окислителе и восстановителе
а) 2; б) 5; в) 4; г)7.
548. Конечным продуктом в цепочке превращений
KOHизб. H2O2 H2SO4 KNO2, H2SO4 (p)
Cr2(SO4)3 → X1 → K2CrO4 → X2 → X3
является:
а) Cr(NO2)3; б) Cr2(SO4)3; в) Cr(NO2)2; г) K2CrO4.
549. Какие галогенид-ионы можно окислить с помощью хлорида железа (Ш) (Ео Fe3+/Fe2+= 0,77 в), если потенциалы соответствующих пар равны:
CI2 /2CI- Br2/2Br- I2/2I-
Ео, В 1,36 1,06 0,54
а) все, кроме йода; б) только йод;
в) только хлор; г) все, кроме хлора.
550. Какое соединение железа образуется в реакции:
Fe2O3 + CI2 + KOH → … + KCI + H2O?
а) FeCI3; б) KFeO2; в) FeCI2; г) K2FeO4.
551. Какой из гидроксидов: Fe(OH)2; Co(OH)2; Ni(OH)2 можно окислить
кислородом?
Ео, в: O2 +2H2O/4OH-; Fe(OH)3/Fe(OH)2; Co(OH)3/Co(OH)2; Ni(OH)3/Ni(OH)2
0,401 -0,53 0,17 0,49
а) все гидроксиды; б) только Fe(OH)2;
в) Со(ОН)2, Ni(OH)2; г) Fe(ОН)2, Co(OH)2.
- 50 -
552. Установите левую часть уравнения
….. → Na2FeO4 + H2O.
а) Fe2O3 + O2 + NaOHтв.; б) Fe2O3 + NaOHтв.;
в) Fe2O3 + NaOHразб.; г) Fe2O3 + Na2CO3 тв.
553. Какая ионная полуреакция отвечает восстановлению в кислой среде
FeO42- - иона в …?
а) FeO42- + 4H+ + 3e → FeO2- + 2H2O;
б) FeO42- + 8H+ + 3e → Fe3+ + 4H2O;
в) FeO42- + 4H2O + 3e → Fe3+ + 8OH-;
г) FeO42- + 3e → Fe3+ + 4O2-.
554. В цепочке превращений
HCIразб. CI2 Na2SO3 NH3.H2O
Fe --------- A ---------- Б --------- В ----------- Г
хлорид железа (П) это вещества:
а) А,Б б) А,В; в) Б, В; г) В,Г.
555. Какой реактив применяется для проведения качественной реакции на ион Fe2+?
а) Na2S; б) K3[Fe(CN)6]; в) K4[Fe(CN)6]; г) KCNS.
556. Какой реактив применяется для проведения качественной реакции на соединения Fe3+?
а) NaOH; б) K3[Fe(CN)6]; в) K4[Fe(CN)6]; г) Na2S.
557. Какой реактив применяется для проведения качественной реакции на соединения Fe3+?
а) K3[Fe(CN)6]; б) KCNS; в) NaOH; г) (NH)2S.
558. Продуктами взаимодействия CuSO4 + KI являются:
а) CuI2 + K2SO4; б) CuI + K2SO4;
в) Cu2I2 + K2SO4; г) CuI + I2 + K2SO4.
559. При действии разбавленной HNO3 на избыток ртути образуются:
а) Hg(NO3)2 + NO; б) Hg2(NO3)2 + H2;
в) Hg(NO3)2 + H2; г) Hg2(NO3)2 + NO.
560. К какому типу комплексных соединений относится продукт реакции, протекающей в водном растворе:
хлорид титрааквацинка (П) + КОН (изб.)→
а) гидроксокомплекс; б) амминокомплекс;
в) ацидокомплекс; г) аквакомплекс.
561. Константа нестойкости комплексного иона [Ag(S2O3)3]3- - это
а) [Ag+].2[S2O32-] б) а) [Ag+] +2[S2O32-]
[Ag(S2O3)2]3- [Ag(S2O3)2]3-
в) [Ag+].[S2O32-]2 г) [Ag+].[S2O32-]2
[Ag(S2O3)2]3-
562. Сколько мл 0,1 М раствора Na2S2O3 пойдет на титрование свободного йода, выделившегося при взаимодействии 0,1 г CuSO4.5H2O c иодидом калия.
а) 6,2; б) 8; в) 12,4; г) 4.
- 51 -
563. Напишите уравнение реакции Hg изб. + HNO3 недост.разб.→
коэффициент при восстановителе
а) 3; б) 1; в) 8; г) 6.
564. В цепочке превращений
HNO3 конц. NH3.H2O KCNS Na2S
Cu → X1 → X2 → X3 → X4
конечным продуктом является:
а) Cu(CN)2; б) Сu(OH)2; в) СuSO4; г) CuS.