
- •Тесты по общей и неорганической химии
- •Для самоконтроля и подготовки к экзаменам
- •(Предназначены для студентов 1 курса
- •Факультетов очного и заочного обучения)
- •Строение атома. Периодический закон. Химическая связь.
- •Основные закономерности протекания химических реакций. Энергетика и направление реакций. Скорость и химическое равновесие.
- •Растворы и их свойства. Концентрация растворов. Электролиты. Химические равновесия в растворах электролитов.
- •Окислительно-восстановительные реакции. Комплексные соединения
- •Классы неорганических соединений. Химия s-, p- и d-элементов.
Основные закономерности протекания химических реакций. Энергетика и направление реакций. Скорость и химическое равновесие.
154. Химическая реакция обязательно сопровождается выделением или поглощением энергии, поскольку:
а) для ее протекания необходима энергия, равная энергии активации;
б) ее протекание требует столкновения реагирующих частиц;
в) ее протекание заключается в разрыве одних и образовании других химичеc-
ких связей;
г) при ее протекании количество атомов до и после реакции остается постоян-
ным.
- 16 -
155. Первый закон термодинамики формулируется так:
а) скорость реакции пропорциональна концентрации реагирующих веществ;
б) тепловой эффект реакции равен сумме изменения запаса внутренней энергии
и совершенной работе;
в) при одинаковых условиях в равных объемах газов содержится одинаковое
число молекул;
г) при абсолютном нуле К энтропии веществ равны 0.
156. Внутренней энергией системы называется …
а) кинетическая энергия движения молекул;
б) суммарный запас всех видов энергии системы;
в) потенциальная энергия системы;
г) энергия притяжения электронов к ядру.
157. Стандартная теплота образования сложного вещества – это:
а) количество теплоты, выделяющееся при образовании 1 моля вещества;
б) тепловой эффект образования 1 моля вещества из простых веществ при стан-
дартных условиях;
в) количество теплоты, выделяющееся при образовании 1 моля вещества из про-
стых веществ при стандартных условиях;
г) количество теплоты, выделяющееся при образовании 1 моля вещества из про-
стых газообразных веществ при стандартных условиях.
158. «Тепловой эффект химической реакции равен сумме теплот образования
продуктов реакции минус сумма теплот образования исходных веществ».
Это формулировка: а) правила Вант-Гоффа; б) закона Гесса;
в) закона Генри; г) правила Гиббса.
159. В эндотермической реакции …
а) скорость химической реакции мала;
б) тепловой эффект химический реакции положителен (Qp 0);
в) энтальпия реакционной системы увеличивается (Н 0);
г) энтальпия реакционной системы уменьшается (Н 0).
160. Нfo(H S) = -21 кДж/моль. Сколько выделится или поглотится теплоты при взаимодействии 16 г серы и 11,2 л водорода?
а) выделится 10,5 кДж; б) выделится 21 кДж;
в) поглотится 21 кДж; г) поглотится 10,5 кДж.
161. Ho(SO ) = -143 кДж/моль. Сколько выделится или поглотится теплоты при разложении на простые вещества 44,8 л SO2?
а) выделится 143 кДж; б) выделится 21 кДж;
в) поглотится 286 кДж; г) поглотится 10,5 кДж.
162. Какой из отрезков на энергетической диаграмме реакции A+B=C+D
соответствует изменению энтальпии реакции?
- 17 -
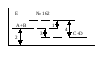
а) отрезок 1;
б) отрезок 2;
в) отрезок 3;
г) отрезок 4.
163. Какой из отрезков на энергетической диаграмме реакции A+B=C+D
с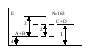 оответствует
изменению энтальпии реакции?
оответствует
изменению энтальпии реакции?
а) отрезок 1;
б) отрезок 2;
в) отрезок 3;
г) отрезок 4.
164. Какая из приведенных реакций отвечает теплоте образования NO в стандартных условиях (Hof)?
а) N(г) + O(г) = NO(г); б) 2NH3(г) + 5/2O2(г) = 2NO(г) + 3H2O(ж);
в) 1/2N2(г) +1/2O2(г) = NO(г); г) N(г) + 1/2O2(г) = NO(г).
165. Какая из нижеприведенных реакций отвечает стандартной энтальпии образования SO2(г)?
а) S(к) + O2(г) = SO2(г); б) H2SO3(р) = SO2(г) + H2O(ж);
в) S(к) + 2/3 O3(г) = SO2(г); г) SO3(г) = SO2(г) + O(г).
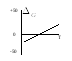 166. На рис.
представлена зависимость G
реакции
166. На рис.
представлена зависимость G
реакции
от абсолютной температуры. Эта реакция возможна:
а) невозможна ни при каких температурах;
б) только при высоких температурах;
в) только при низких температурах;
г) при любых температурах.
 167. На рис.
представлена зависимость G
реакции
167. На рис.
представлена зависимость G
реакции
от абсолютной температуры. Эта реакция возможна:
а) только при высоких температурах;
б) только при низких температурах;
в) при любых температурах;
г) ни при каких температурах.
168. «При увеличении температуры на 10 градусов скорость большинства химических реакций увеличивается в 2-4 раза». Это формулировка:
а) закона действующих масс; б) правила Вант-Гоффа;
в) закона Генри; г) закона Гесса.
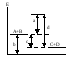 169. На рис. обозначены
различные энергетические
169. На рис. обозначены
различные энергетические
параметры обратимой реакции A + В C + D.
Каким отрезком обозначена на рис. энергия активации
прямой реакции?
а) а; б) б; в) с; г) d.
- 18 -
170. Начальная концентрация одного из реагирующих веществ была равна 1,2 моль/л, а через 10 мин. стала равной 0,3 моль/л. Чему равна средняя скорость химической реакции (моль/л.мин.)?
а) 0,09; б) -0,09; в) 0,9; г) -0,9.
171. Среднее значение скорости гомогенной реакции
2KBr(р) + Cl2(р) = Br2(р) + 2KCl(р) равно 0,2 моль/л.мин. при концентрациях реагирующих веществ: C(KI) = 0,4 моль/л, C(Br2) = 0,5 моль/л. Вычислить константу скорости химической реакции.
а) 10; б) 1; в) 2; г) 2,5.
172. Измерили скорость реакции 2SO2 + O2 = 2SO3 при начальных концентрациях: C(SO2) = 0,2 моль/л, С(O2) = 0,1 моль/л. Повторно измерили скорость с новыми значениями концентраций: C(SO2) = 0,4 моль/л, C(O2) = …моль/л. Первоначальная и повторно измеренные скорости оказались равными. Чему равна C(O2)?
а) 0,2; б) 0,05; в) 0,025; г) 0,4.
173. При повышении температуры от 18 до 28оС скорость реакции увеличилась в 2 раза. Во сколько раз она возрастет при увеличении температуры от 18 до 68оС?
а) в 16 раз; б) в 32 раза; в) в 5 раз; г) в 10 раз.
174. При 20оС срок хранения раствора составляет 8 дней. Определите срок хранения растворов при температуре 40оС, если температурный коэффициент равен 2.
а) 1 день; б) 5 дней; в) 2 дня; г) 10 дней.
175. На сколько градусов необходимо понизить температуру хранения лекарства с 20оС, при которой оно хранится не более 5 дней, чтобы довести срок его хранения до 45 дней. Температурный коэффициент равен 3.
а) на 9о; б) на 20о; в) на 15о; г) на 45о.
176. Две химические реакции при температуре 20оС протекают с одинаковой скоростью. При повышении температуры на каждые 10о скорость первой реакции увеличивается в 2 раза, а второй – 3 раза. При какой температуре скорость второй реакции в два раза превысит скорость первой?
а) 40; б) 37; в) 57; г) 47.
177. Во сколько раз нужно увеличить концентрацию азота в реакции
N2 (г) + 3Н2 (г) = 3NH3 (г), чтобы при уменьшении концентрации водорода в 3 раза скорость реакции не изменилась?
а) в 9 раз; б) в 27 раз; в) в 3 раза; г) в 6 раз.
178. «В момент химического равновесия отношение произведения молярных концентраций продуктов реакции к молярным концентрациям исходных веществ есть величина постоянная, называемая …»
а) константой химического равновесия; б) свободной энергией Гиббса;
в) степенью диссоциации; г) константой скорости реакции.
- 19 -
179. Константа скорости химической реакции не зависит:
а) от природы реагирующих веществ; б) от температуры;
в) от катализатора; г) от концентрации реагирующих веществ.
180. Для реакции определены константы равновесия при различных температурах. При какой температуре выход продуктов реакции минимальный.
а) 1200оС, К = 108; б) 900оС, К = 102;
в) 600оС, К = 10-2; г) 300оС, К = 10-4.
181. В реагирующей системе, схема которой А + 2В С + 3D, исходные концентрации вещества А – 3 моль/л, вещества В – 4 моль/л, а равновесная концентрация вещества С – 1,5 моль/л. Константа равновесия в системе равна:
а) 45,3; б) 48,7; в) 50,5; г) 91,1.
182. Как следует одновременно изменить температуру и давление в обратимой реакции N2O4(г)↔ 2NO2 (г) (Н прямой реакции +57,4 кДж), чтобы газовая
бесцветная бурая
смесь окрасилась?
а) температуру и давление увеличить;
б) температуру и давление уменьшить;
в) температуру увеличить, давление уменьшить;
г) температуру уменьшить, давление увеличить.
183. Как следует изменить концентрации, чтобы в гомогенной обратимой реакции FeCI3 + 3KCNS ↔ Fe(CNS)3 + 3KCI окраска ослабла?
бесцветная бесцветная красная бесцветная
а) концентрации FeCI3 и 3KCNS увеличить, КСI – уменьшить;
б) концентрация FeCI3 и 3KCNS уменьшить, КСI – увеличить;
в) концентрации всех веществ в системе увеличить;
г) концентрации всех веществ в системе уменьшить.
184. Смещение равновесия влево в равновесной реакции
CO(г) + 2Н2(г) ↔ СН3OH(г) – Q, произойдет при
а) увеличении давления; б) увеличении температуры;
в) уменьшении концентрации СН3ОН; г) уменьшении концентрации Н2.
185. Смещение равновесия вправо в равновесной реакции
CO(г) + 2Н2(г) ↔ СO2 (г) + СН4 (г) + Q произойдет при:
а) уменьшении температуры; б) увеличении концентрации СН4;
в) увеличении температуры; г) введении катализатора.
186. Реакция, в которой понижение давления и повышение температуры вызовут смещение равновесия в одну сторону, - это:
а) 2SO2 (г) + O2 (г) ↔ 2SO3 (г) + Q;
б) СO2 (г) + 2Н2 (г) ↔ СН3ОН (г) – Q;
в) FeO (к) + СO (г) ↔ Fe (к) + СО2 (г) – Q;
г) СO2 (г) + Н2 (г) ↔ СO (г) + Н2О (г) + Q;
- 20 -
В заданиях 187-192 следует охарактеризовать нижеприведенную реакцию:
2SO3 (г) ↔ 2SO2 (г) + О2 (г); Н = + 196 кДж.
а) б) в) г)
187. Станд. теп-
лота образова- SO2 и SO3 O2 SO2 SO3
вания равна 0
для:
188. Энтропия уменьша- увеличи- не изме- нельзя от-
в прямой реакции ется вается няется ветить без
таблиц
189. Кинети- V=k.C2(SO2)+ C(O2); V=k.2C(SO2) С(О2); V=k.C2(SO3); V=k.C.2(SO3).C(O2).
ческое уравнение
скорости прямой
реакции:
190. При увел.
давл.в 2 раза увеличив. увеличив. не изменя- увеличив.
конс-та скор.: в 6 раз в 8 раз ется в 4 раза
191. Константа [SO2]2[O2] [SO3]2 2[SO3] 2[SO3]
равн.имеет вид: [SO3]2 [SO2]2[O2 ] 2[SO2][O2] [SO2]2[O2]
192. Равновесие уменьше- увеличении увеличении уменьшении
смещ вправо при: нии т-ры т-ры давления конц. SO3
