
Борная кислота
.doc-
Общие сведения.
Формула:
Н3ВО3
Бо́рная
кислота́ (ортоборная
кислота) ![]() — слабая кислота.
— слабая кислота.
Бесцветное
кристаллическое вещество в виде чешуек
без запаха, имеет слоистую триклинную
решетку, в которой молекулы ![]() соединены водородными
связями в
плоские слои, слои соединены между собой
межмолекулярными связями (d= 0,318 нм).
соединены водородными
связями в
плоские слои, слои соединены между собой
межмолекулярными связями (d= 0,318 нм).
Метаборная
кислота ![]() также
предствляет собой бесцветные кристаллы.
Она существует в трех модификациях -
наиболее устойчивой γ-НВО2 с
кубической решеткой, β-НВО2 с
моноклинной решеткой и α-НВО2 с
ромбической решеткой.
также
предствляет собой бесцветные кристаллы.
Она существует в трех модификациях -
наиболее устойчивой γ-НВО2 с
кубической решеткой, β-НВО2 с
моноклинной решеткой и α-НВО2 с
ромбической решеткой.
При
нагревании ортоборная кислота теряет
воду и сначала переходит в метаборную
кислоту ![]() ,
затем в тетраборную
,
затем в тетраборную ![]() .
При дальнейшем нагревании обезвоживается
доборного
ангидрида.
.
При дальнейшем нагревании обезвоживается
доборного
ангидрида.
Водные растворы борной кислоты являются смесью полиборных кислот общей формулы Н3m-2nВmО3m-n.
Общие
Систематическое наименование: Ортоборная кислота
Молярная масса: 61,83 г/моль
Плотность: 1,435 (15 °С) г/см3
Температура плавления: 170.9 °C, 444 K, 340 °F
Температура кипения: 300 °C, 573 K, 572 °F
Растворимость в воде (г/100мл):
2.52 (0 °C)
4.72 (20 °C) 5,74 (25 °C) 19.10 (80 °C)
27.53 (100 °C)
-
Получение.
Для получения химически чистой борной кислоты к раствору 1 ч. буры в 4 ч. горячей воды прибавляют столько соляной кислоты, чтобы жидкость сильно окрашивала лакмус в красный цвет; по охлаждении почти вся борная кислота выделяется в виде тонких чешуек, которые отделяют от маточного раствора отжиманием и окончательно очищают перекристаллизацией.
Na2B4O7 + 2НСl+5Н2O=4В (ОН) 3+2NаСl.
Борная кислота кристаллизуется из воды в перламутровых просвечивающих листочках, жирных на ощупь, уд. веса 1, 434 (при 15? Ц.) ; 1 ч. кислоты растворяется в 25, 6 ч. воды при 15 и в 2, 9 ч. кипящей воды; вещество растворимо также в летучих эфирных маслах и в алкоголе, с парами которого летит при нагревании, образуя сложные эфиры; алкогольный раствор свободной кислоты (или солей ее в присутствии серной кислоты) горит зеленым пламенем, что служит для открытия борных соединений (при этом опыте следует избегать медных солей и солей хлористоводородной кислоты, также окрашивающих пламя спирта в зеленый цвет).
-
Качественный анализ.
-
Аналитические реакции на борат-ион.
-
1. С групповым реагентом BaCl2 + CaCl2
2. С куркумовой бумагой (ГФ).
Куркумовая бумага, смоченная раствором тетрабората натрия (или ортоборной кислоты) и несколькими каплями разбавленной хлороводородной кислоты, окрашивается при высушивании в розовый цвет, переходящий в зеленовато-чёрный при дальнейшем смачивании бумаги раствором аммиака. Мешают анионы-окислители, обесцвечивающие куркумовую бумагу.
3. Реакция этерификации с этиловым спиртом в присутствии концентрированной серной кислоты.
Na2B4O7
+ H2SO4
+ 5 H2O
![]() Na2SO4
+ 4
H3BO3
Na2SO4
+ 4
H3BO3
H3BO3
+ 3 C2H5OH
![]() B(OC2H5)3
+ 3 H2O
B(OC2H5)3
+ 3 H2O
Методика: 0,2 г борной кислоты (или тетрабората натрия) помещают в фарфоровую чашку. Для дробного открытия выпаривают досуха 1 см3 испытуемого раствора в фарфоровой чашке, прибавляют 1 см3 концентрированной серной кислоты, 3 см3 этанола и перемешивают. При зажигании смесь горит пламенем, окаймленным зелёным цветом. Выполнению реакции мешают хлорид-, бромид-, иодид-ионы. Их удаляют выпариванием с серной кислотой до появления "белого дыма".
-
Инструментальный анализ.
-
Электро-химические методы анализа.
ПОТЕНЦИОМЕТРИЧЕСКОЕ ОПРЕДЕЛЕНИЕ ХЛОРОВОДОРОДНОЙ И БОРНОЙ КИСЛОТ ПРИ СОВМЕСТНОМ ПРИСУТСТВИИ
Определение компонентов смеси в растворе основано на дифференцированном титровании их раствором гидроксида натрия с фиксированием двух точек эквивалентности по резкому скачку потенциала. В качестве индикаторного используют стеклянный электрод, электрода сравнения –хлорсеребряный.
Борная кислота является очень слабой кислотой (Кд = 6,4 ´ 10-10 ), поэтому её переводят в более сильную глицероборную кислоту (Кд » 10-7).
Первый скачок титрования соответствует нейтрализации сильной хлороводородной кислоты:
HCl + NaOH = NaCl + Н2О
М HCl = 36,45 г/моль
Затем добавляют глицерин, образуется глицероборная кислота.
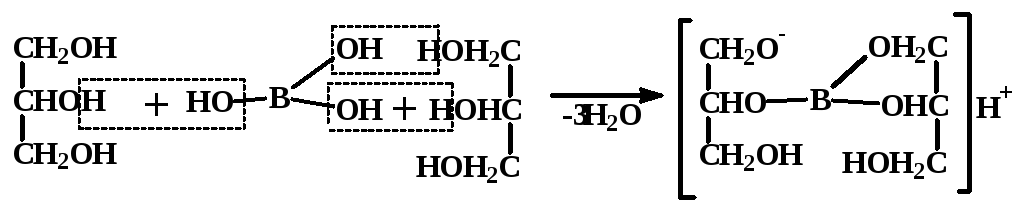
Второй скачок титрования соответствует нейтрализации глицероборной кислоты:
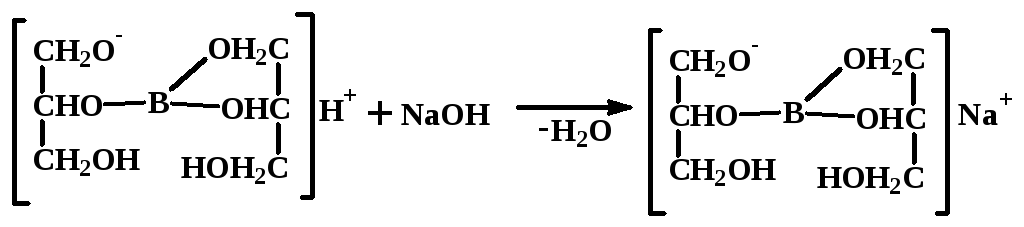
М Н3ВО3 = 61,81 г/моль
МЕТОДИКА
2-4 см3 анализируемого раствора (индивидуальное задание) помещают в стакан вместимостью 50 см3 с магнитным стержнем, добавляют дистиллированную воду до объёма, обеспечивающего условия работы.
Бюретку заполняют 0,1 моль/дм3 раствором гидроксида натрия, закрепляют штатив. Стакан с анализируемым раствором устанавливают на столик электромагнитной мешалки, погружают в раствор электроды и приступают к титрованию. Проводят ориентировочное и точное титрования согласно общих указаний. В процессе титрования фиксируют первый скачок титрования, затем к раствору прибавляют 10 см3 глицерина, нейтрализованного по фенолфталеину и продолжают титровать, фиксируя второй скачок титрования по резкому изменению потенциала. Результаты измерений заносят в таблицы.
Расчёт результатов
По интегральному или дифференциальным графикам (по указанию прелодавателя) находят:
-
объём титранта, соответствующий первому скачку титрования, прореагировавший с хлороводородной кислотой (V1).
-
объём титранта, соответствующий второму скачку титрования (Voбщ). Тогда: V2 NaOH = (Vобщ – V1) израсходован на титрование Н3ВО3.
-
Применение.
Борное удобрение
В лабораториях применяют для приготовления буферных растворов
В медицине — как самостоятельное дезинфицирующее средство(Инструкция по приминению). Также на основе борной кислоты производятся различные комбинированные препараты (группа АТХ D08AD), например, паста Теймурова.
В фотографии — в составе мелкозернистых проявителей и кислых фиксажей для создания слабой кислотной среды.
В быту раньше использовалась для борьбы с тараканами.
В пищевой промышленности — зарегистрирована как пищевая добавка E284 (на территории России эта добавка не входит в список разрешённых к применению[1]).
В игре Новус борной кислотой натирают игровой стол для лучшего скольжения фишек.
На АЭС в качестве поглотителя нейтронов, растворенного в теплоносителе.
-
Список литературы.
-
Лурье Ю.Ю. Справочник по аналитической химии. Москва, 1972;
-
Методическое указание «Инструментальные методы анализа», Пермь, 2004;
-
Методическое указание «Качественный химический анализ», Пермь, 2003;
-
Методическое указание «Количественный химический анализ», Пермь, 2004;
-
Прозоровский. В. КОВАРНАЯ БОРНАЯ КИСЛОТА. Журнал "Наука и жизнь" №11, 2003 год http://www.nkj.ru/archive/articles/3604/;
-
Рабинович В.А., Хавин З.Я. Краткий химический справочник, Ленинград, 1991;
-
«Большая советская энциклопедия».
