
Шпоры Химия (2 семестр )
.docx
|
|
2б
nэк(в)= Мэк(Сл)= Если
А(Т) ,а В(Г)- Если оба
газ.- |
|
2а
Форм.един.-реально
существ. частицы ,такие как
атомы,молекулы,ионы,радикалы.
Моль-количество
вещества системы, содержащей столько
же структурных элементов, сколько
содержится атомов в126 С массой
0,012 кг.Постоян.Авогадр.
=6,02*1023
nB= |
|
3б
Массовая
доля растворен.в-ва(%)- w xв= Титр(г\см3)-
концентрация стандартного р-ра,равная
массе раствор. в-ва,содержащейся в 1
см3р-ра.
ТВ= |
|
3а Раствор-однородная система переменного состава.Жидк,тверд,газообр. Концентр.-отношение кол-ва или массы в-ва,содержащегося в р-ре,к объему или массе того же р-ра. Молярная
концентр.в-ва(молярность)-Св,моль\л.
Св= Моляльность
в-ва в р-ре (моль\кг)
Сm(в)= |



















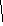




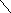





























|
4а 1ое начало термодин.-Теплота, подведенная к системе,расход. на увелич. ее внутр. энергии и на совершен.работы. Q= U+p V.Осн.з.термохим.(Гесса)-теплов. эффект хим.р-ции не зависит от пути ее протекания,а зависит от природы и физ. состояния исходных в-в и продуктов р-ции. Экзотерм.-выдел.теплоты,эндотерм.- поглощен. Qp=- H. Q=mc t. P=101325Па, Т=298К. 1 след-е –изменение энтальпии хим.р-ции=сумме стандартных энтальпий образования продуктов р-ции за вычетом суммы стандартн.энтальпий образования исходных в-в с учетом стехиометрич. коэффиц.этих в-в в у-ях р-ций. |
|
4б 2ое следств.-Изменение энтальпии хим.р-ции=сумме стандартных энтальпий сгорания исходных в-в за вычетом суммы стандартн. энтальпий сгорания продуктов р-ции с учетом стехиометрич. коэф.(ni,nj)в у-нии р-ции.Энтропия-мера беспорядка в системе. Энергия Гиббса-ф-ция состояния, одновременно отражающей влияние изменений энтр.и энтальп. на направление протекания хим.процессов. rGo(298K)<0-процесс возможен, rGo(298K)>0-самопроизвольно не может протекать. rGo(298K)= rHo(298K)-T rSo(298K) |
|
5б У-е
Аррениуса:k=Ae^(- lg mA(г)+nB(г)↔рС(г)+qD(г);
Кс= 2А(г)+В(г)↔2С(г);Кр= -2,3RTlgKp=∆rG0(298K)=∆rH0(298K)-Т∆rS0(298K) Kp=10^ Влияние темп.-повыш-в сторону поглощения теплоты. |
|
5aCкорость хим.р-ции измеряется кол-вом в-ва,вступающего в р-цию или оразующ.в результате р-ции за единицу времени в единицу объема с-мы(гомогенной)или на единице площади пов-сти раздела фаз (гетерогенной):V=∆C\∆Ʈ,моль\л*с. mA(г)+nB(г)=pC(г):V=k*CAm*CBn. Порядок простых р-ций-сумма показателей степеней при концентр. реаг.в-в в у-и скорости р-ции. АВ→А+В;
k= Вант-Гоффа:при повышении темпер. на каждые 10 градусов скорость хим.р-ции увеличивается в 2-4 раза: |
π=СвRT= Электролиты-в-ва,
проводящие в расплавах или водных
р-рах электрический ток (соли
,основания,кислоты).
αк= ∆p=p0*xB=p0 p=p0*xр-ля=р0 ∆tзам.=iKTCm(B);∆tкип=iЭтCm(B); π=iCBRT. |
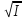 ,если
I<0,01моль*л-1; ,если
I<0,01моль*л-1;
lgf=-0.5Z2 Сa3(PO4)2↔3Ca2+(p)+2PO43-(p) Kc=[Ca2+]3[PO43-]2=ПР(Ca3(PO4)2). pH=-lgCH+; pOH=-lgCOH-; pH+pOH=14. |
cил.осн.
щел.
и сл. кисл. (Na2CO3) сл.осн. и
сил.кисл.кисл. (AlCl3) сл.осн. и
сл.кисл.
слщел
h= |
Ме+Н2SO4=H2S(Li-Al),S(Mn-Pb),SO2(после Н) неМе+HNO3=NO2+к-та высш.ст. неМе+Н2SO4=SO2+к-та высш.ст. +Н2О
Li Cs K Ba Ca Na Mg Al Mn Zn Cr Fe Cd Ta Co Ni Mo Sn Pb H Cu Hg Ag Au |
Хим.-представляет
собой разрушение Ме при взаимодействии
с сухими агресс.газами (О2,СО2-газовая
кароз)или с компонентами в
жидк.неэлектрол.(нефтепродукты).
Электрохим-контакт Ме с водой,р-ми
электролит.,влажными газами.анодные:Ме0-n катодные:2Н++2 О2+4Н-+4 Вес.показатель(Km= Объем.п-ль(Kv= Глубин.п-ль(П= |
mB= BT= |
НNO3 Me Разбавленная Концентрированн Li..Zn NH3 (NH4NO3),N2 N2O Cr..Pb N2,N2O NO Sb..Hg NO NO2
|
HClO4 Хлорная Перхлораты HClO3 Хлорноватая Хлораты HCIO2 Хлористая Хлориты HCIO Хлорноватистая Гипохлориты HCI Хлороводородная Хлориды HF Фтороводородная Фториды H2S Сероводородная Сульфиды HCN Циановодородная Цианиды HCNS Родановодородная Роданиды |
|
1абВ-ва .Св-ва 2аб Эквивалент 3абР-р.Способы выражения 4абЭнергетика 5абСкорость хим.р-ции.Хим.равновесие 6абФизико-хим св-ва р-ров 7абР-ры сильных и слабых электролитов 8абИонно-молек у-я.Гидролиз солей 9абОкисл-восст р-ции 10абГальванич элемент.Каррозия Ме 11абЭлектролиз 12абХим.св-ва Ме
|

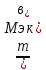 ;
Мэк(В)=
;
Мэк(В)=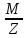 ;
Мэк(Э)=
;
Мэк(Э)=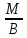 ;
Мэк(Окс.)=Мэк(Э)+Мэк(О);
Мэк(Окс.)=
;
Мэк(Окс.)=Мэк(Э)+Мэк(О);
Мэк(Окс.)=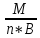 ;
Молярн.массы эквив. кисл.(осн.)=мол.массе
кисл.(осн.),деленной для кислоты на
число Н+,замещен.на
Ме,а для осн.-ОН-на
кисл.ост.
;
Молярн.массы эквив. кисл.(осн.)=мол.массе
кисл.(осн.),деленной для кислоты на
число Н+,замещен.на
Ме,а для осн.-ОН-на
кисл.ост.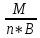 ;
nэк(А)=nэк(B);
;
nэк(А)=nэк(B);
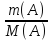 =
=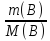 ;
Если в-ва ТВЕРД-
;
Если в-ва ТВЕРД-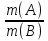 =
=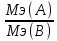 ;
VМэк(о)=5,6л\моль
;
VМэк(о)=5,6л\моль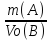 =
=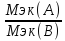 ;
VМэк(Н)=11,2л\моль
;
VМэк(Н)=11,2л\моль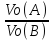 =
=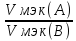 ;
VМэк(Cl)=11,2л\моль
;
VМэк(Cl)=11,2л\моль ;
Эквивалент-реальн.
или условн. частицы ве-ва, в zB
раз меньшие,чем соотвецт. им ФЕ,или
условн. частицы ,которые в кислотно-основных
р-циях равны одному атому или одному
иону Н+,а
в окислительно-восст. р-циях-одному
отданному или принятому электрону.
;
Эквивалент-реальн.
или условн. частицы ве-ва, в zB
раз меньшие,чем соотвецт. им ФЕ,или
условн. частицы ,которые в кислотно-основных
р-циях равны одному атому или одному
иону Н+,а
в окислительно-восст. р-циях-одному
отданному или принятому электрону.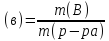 *100.
mp-pa=Vp-pa*ρ;
Мол.доля раствор.в-ва- отношение
числа моль раствор. в-ва к сумме числа
моль раствор. в-ва и числа моль
растворителя.
*100.
mp-pa=Vp-pa*ρ;
Мол.доля раствор.в-ва- отношение
числа моль раствор. в-ва к сумме числа
моль раствор. в-ва и числа моль
растворителя. =
=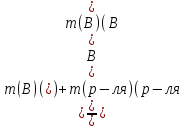 ;
;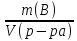 ;
;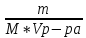 ;
Моляр.конц.экв.в-ва(нормальность
)-Сэк(в)=
;
Моляр.конц.экв.в-ва(нормальность
)-Сэк(в)= ;Мэк(В)=
;Мэк(В)=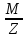 ;для
солей : Zв=n*B;
;для
солей : Zв=n*B;
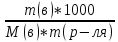 ;
;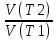 =
= =γ^
=γ^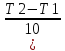 ).
).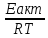 );
Скорость хим.р-ции lg
);
Скорость хим.р-ции lg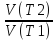 =lg
=lg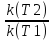 =
=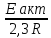 (
(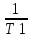 -
- );
возрастает с катализатором.
);
возрастает с катализатором.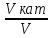 =lg
=lg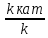 =
= ;Оратимая-р-ция
,протекающаю в 2 направлениях.Прямая-слева
направо.Обратная-справа налево.
;Оратимая-р-ция
,протекающаю в 2 направлениях.Прямая-слева
направо.Обратная-справа налево.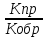 =
=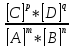 ;
;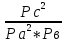 ;
Т=
;
Т=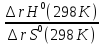 ;
;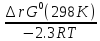 =10^
=10^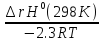 +
+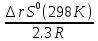 ;
; lg
lg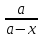 ,c-1.
V=kCSуд.
,c-1.
V=kCSуд. ;nв=
;nв=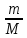 ;
nр-ля=
;
nр-ля=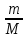 ;
;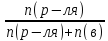 ;
;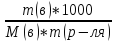 ;
;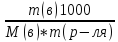 ;
;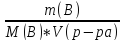 RT.
RT.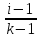 ;
; ;
; ;
;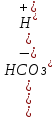 =4.5*10-7;
для слаб.-
К=
=4.5*10-7;
для слаб.-
К=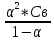
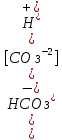 =4,5*10-11;
α=
=4,5*10-11;
α=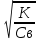
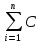 ионаiZi2;моль*л-1.
ионаiZi2;моль*л-1.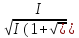 ,если
I>0.01
моль*л-1;
,если
I>0.01
моль*л-1;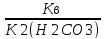
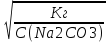 14-(-
14-(-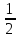 lg Кг
-
lg Кг
-
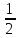 lg C(Na2CO3)
lg C(Na2CO3)
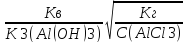 -
-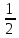 lg
Кг-
lg
Кг-
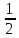 lgC(AlCl3)
lgC(AlCl3)
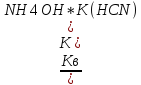 14-(-
14-(-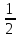 Кг-
Кг-
 (NH4CN)
lgC(NH4CN)
)
(NH4CN)
lgC(NH4CN)
)
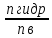 ;
h=
;
h=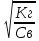 ;
Кг=
;
Кг=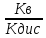 ;
Кг=
;
Кг=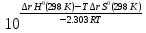 ;
Кг=
;
Кг=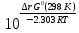
 ;
K=
;
K=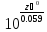 ;
; =Me1n+;
=Me1n+;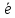 =Me20;
=Me20;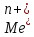 /Me
=
ϕ0
/Me
=
ϕ0 /Me
+
/Me
+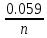 lgCMen+;
lgCMen+; ;
;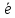 =Men+;
=Men+;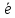 =Н2;О2+2Н2О+4
=Н2;О2+2Н2О+4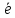 =4ОН-;
=4ОН-; =2Н2О
=2Н2О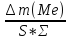 ,г/м2*ч);
,г/м2*ч);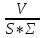 ,см3/м2*ч;Kv=
,см3/м2*ч;Kv= *VMэк(газа));
*VMэк(газа)); ,мм\год;
П=
,мм\год;
П= ,мм\год)
,мм\год)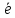 =Н2+2ОН-
Меn++n
=Н2+2ОН-
Меn++n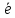 =Me
Меn++n
=Me
Меn++n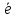 =Me
=Me
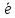 =Н2+2ОН-
=Н2+2ОН-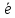 =O2+4H+
Cl,Br,J,S и
др.
OH-
=O2+4H+
Cl,Br,J,S и
др.
OH-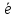 =A
4OH--4
=A
4OH--4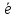 =O2+2H2O
=O2+2H2O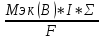
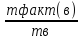 *100,%
*100,% =Me.
Хим.восст.заключается во взаимодействии
соединений Ме с углем,водородом или
Ме-восст.
=Me.
Хим.восст.заключается во взаимодействии
соединений Ме с углем,водородом или
Ме-восст.