
2013.Термодинамика / Thermo-II / термо2008_1
.docФормализм Льюиса. Фугитивность и активность компонентов раствора
Рассмотрим теперь строгое феноменологическое описание, которое применимо к любым растворам.
Химический потенциал идеального раствора газов может быть вычислен по формулам μi=Ψ(t)+RTln(Pi), μi=φºi+RTln(ci), φºi= Ψ(t)+ RTln(P),
Феноменологическое описание раствора
можно выполнить при помощи мольных
парциальных функций (зная которые всегда
можно определить термодинамические
функции и во многих случаях и функции
смешения). Однако в некоторых отношениях
эти функции весьма неудобны. Основной
недостаток их заключается в том, что
функции смешения
![]() ,μi
стремятся ±∞ при ci→0.
Это наглядно видно на примере идеальных
растворов. Стремление к -∞ при ci→0
функций
,μi
стремятся ±∞ при ci→0.
Это наглядно видно на примере идеальных
растворов. Стремление к -∞ при ci→0
функций
![]() ,
μi обусловлено
тем, что уже при добавлении одного
атома i в систему в
ней возникает конфигурационный
беспорядок.
,
μi обусловлено
тем, что уже при добавлении одного
атома i в систему в
ней возникает конфигурационный
беспорядок.
Фугитивность компонентов раствора
Существует иной способ описания растворов, предложенный Льюисом и основанный на замене мольных парциальных функций новыми функциями – фугитивностями и активностями компонентов растворов.
Фугитивность компонента раствора
вводиться следующим образом:
![]() .
.
В согласии с этим химический потенциал компонента любого реального раствора может быть выражен через фугитивность этого компонента μi=Ψ(t)+RTln(fi). (1)
Эта формула схожа с формулой для химического потенциала компонента раствора идеальных газов, но вместо парциального давления компонента здесь фигурирует его фугитивность.
Формально можно определить раствор идеальных газов как таковой, в котором fi=Pi.
Отсюда вытекает смысл фугитивности
компонента раствора как обобщенного
парциального давления (что применимо
только к газовым растворам). Сопоставляя
записи химического потенциал для
идеального и реального растворов
![]() (2)
, где μi=
химический потенциал того же вещества
в состоянии идеального газа. Из формулы
видно, что реальные растворы приближаются
по своему поведению к растворам идеальных
газов при неограниченном возрастании
температуры T. (Хотя при
этом потенциальная функция взаимодействия
может не обращаться в нуль.)
(2)
, где μi=
химический потенциал того же вещества
в состоянии идеального газа. Из формулы
видно, что реальные растворы приближаются
по своему поведению к растворам идеальных
газов при неограниченном возрастании
температуры T. (Хотя при
этом потенциальная функция взаимодействия
может не обращаться в нуль.)
Дифференцируя (1) по P
при постоянной температуре, получим
![]() .
.
Откуда
![]() . (3)
. (3)
Таким образом, фугитивность может быть
определена, если известна зависимость
![]() .
.
Активность компонента раствора
Активность любого реального раствора вводим следующим образом ai=exp[μi,смеш./(RT)]. (4)
Легко видеть, что активность лишена
основного недостатка, присущего величине
μi,смеш..
Действительно, в то время как
![]() .
.
Другое предельное значение активности
![]() так как
так как
![]()
Химический потенциал выразится через активность так μi=φºi+RTln(ai), (5)
Откуда
![]() (6)
(6)
Уравнение Гиббса – Дюгема может быть
представлено в виде
![]() (7)
(7)
Активность компонента раствора связана с его фугитивностью простым образом. Подставляя в выражение (1) φºi=ψ(T)+RT lnfºi получим μi= φºi +RT ln(fi/fºi).
Сравнивая с (5) запишем ai =ln(fi/fºi), (8) то есть активность компонента раствора равна отношению его фугитивности в растворе к фугитивности чистого компонента.
Коэффициент активности
В ряде случаев полезна еще одна величина – коэффициент активности компонента раствора γi. γi=ai/Ci (9)
Легко видеть, что ![]() ,
но
,
но
![]() приводит к неопределенности 0/0, которую
мы рассмотрим позже. Отметим, что этот
lim равен конечной
величине. Химический потенциал компонента
раствора можно выразить через его
активность.
приводит к неопределенности 0/0, которую
мы рассмотрим позже. Отметим, что этот
lim равен конечной
величине. Химический потенциал компонента
раствора можно выразить через его
активность.
μi= φºi +RTlnγi+ RTlnCi.
Термодинамический потенциал Гиббса
через коэффициенты активности запишется
виде
![]()
Уравнение Гиббса – Дюгема приводиться
к виду
![]() .
.
Если подставить в (7) выражение ai=γiCi
получим
![]()
Вторая сумма равна
![]()
Для идеальных растворов химический потенциал μi=φºi+RTln(ci), что в терминах введенных обозначений приводит ai=Ci или i=1 или fi=Cifi
Идеальные растворы можно определить как растворы для, которых выполняется одна из этих записей.
В терминах активности необходимое
условие диффузионной устойчивости
твердого раствора
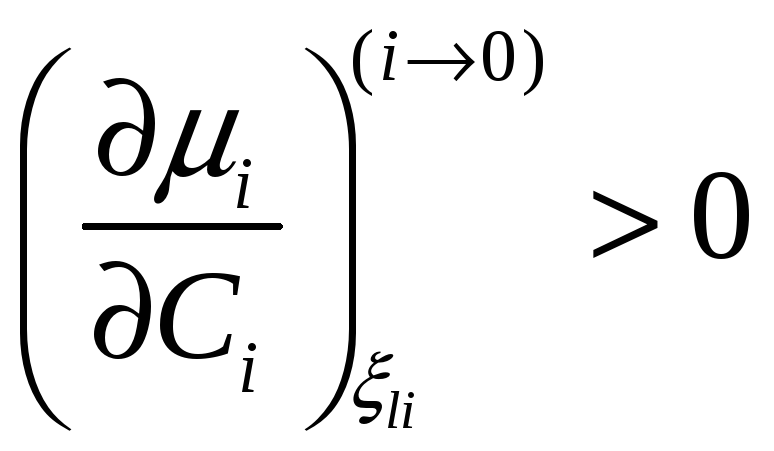 принимает вид
принимает вид
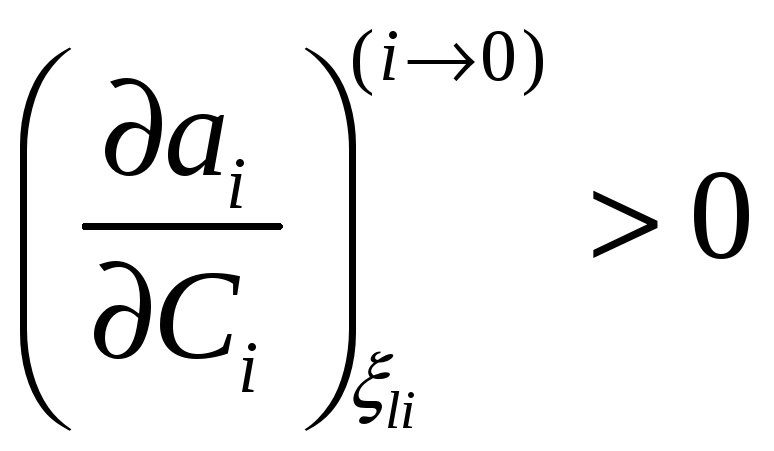 ,
то есть в концентрационном интервале
устойчивости раствора растет с
повышением концентрации.
,
то есть в концентрационном интервале
устойчивости раствора растет с
повышением концентрации.
Для коэффициента активности это условие
принимает вид
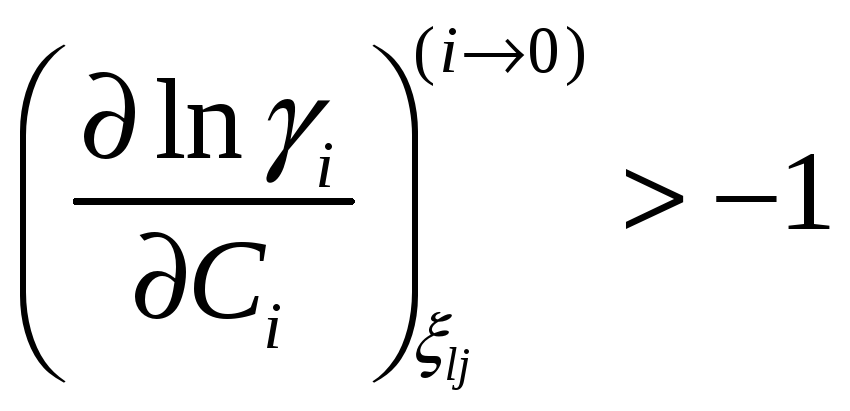
Соотношение между мольными парциальными функциями
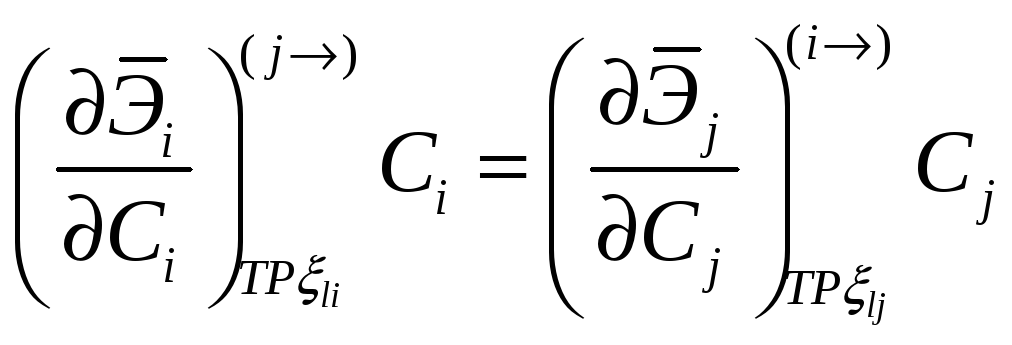
Можно переформулировать в виде соотношений между активностями или коэффициентами активности
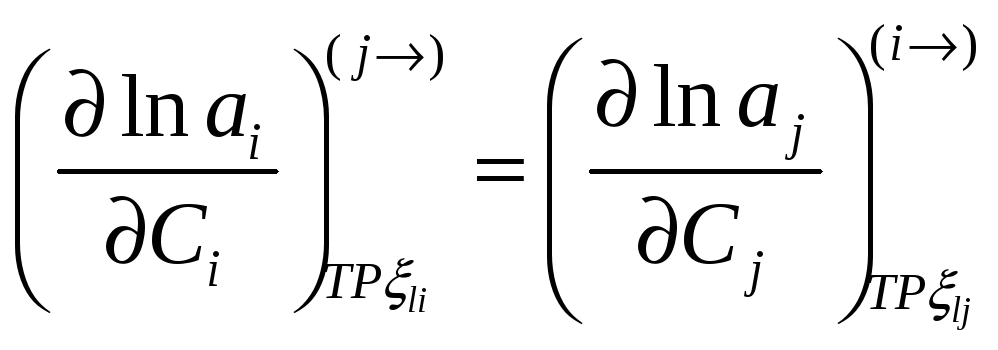
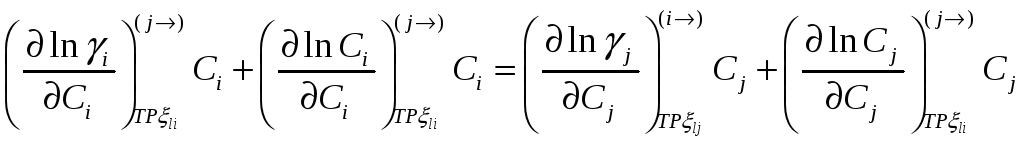 но
но
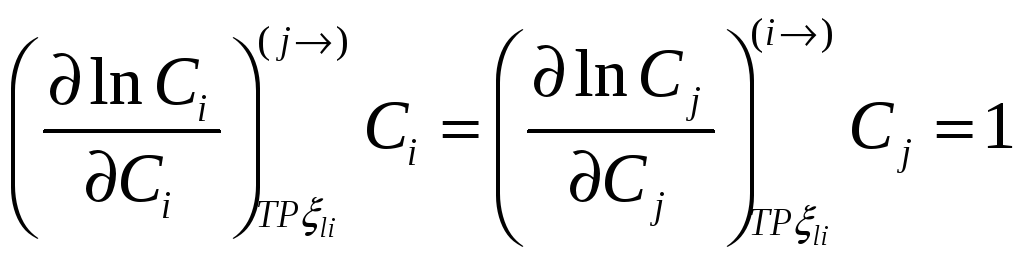
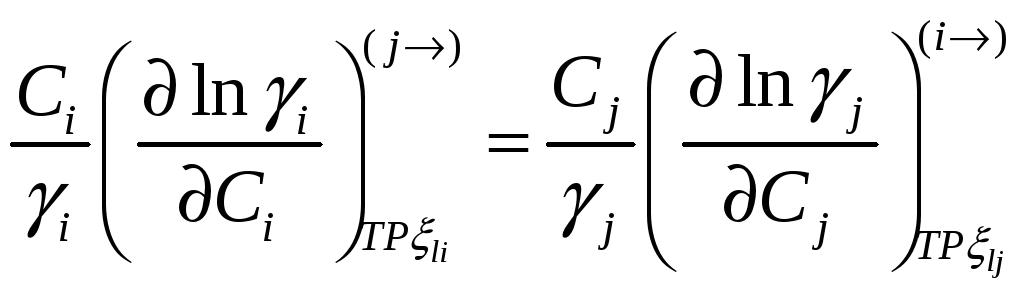 .
.
При помощи этих соотношений можно получить активность j-го компонента, если известна активность i-го компонента раствора. Если раствор идеален в отношении i-го компонента раствора, то он идеален и в отношении j-го компонента раствора.
Коэффициент активности и мольные парциальные функции
Коэффициент активности i может служить мерой отклонения раствора от идеальности.
Из определения активности и коэффициента получим
![]() Из этого выражения видно, что реальные
растворы по своему поведению приближаются
к идеальным при T→∞
(Если даже μi
-
Из этого выражения видно, что реальные
растворы по своему поведению приближаются
к идеальным при T→∞
(Если даже μi
-
![]() →
0).
→
0).
![]() получим
получим
![]() или
или
![]() для растворов с идеальной энтропией
коэффициент активности просто связан
с мольной парциальной энтальпией
смешения.
для растворов с идеальной энтропией
коэффициент активности просто связан
с мольной парциальной энтальпией
смешения.
![]() или
или
![]()
Положительные и отрицательные растворы
Положительными называют растворы для
которых ai>Ci,
γi>1,
fi>Cifio.
Отрицательными называют растворы
ai<Ci,
γi<1,
fi<Cifio.
Из выражения для γi
видно, что для положительных растворов
![]() ,
а для отрицательных
,
а для отрицательных
![]() ,
но обычно
,
но обычно
![]() ,
и понятие положительного твердого
раствора и эндотермического совпадают.
Отрицательные растворы и экзотермические
обычно также совпадают.
,
и понятие положительного твердого
раствора и эндотермического совпадают.
Отрицательные растворы и экзотермические
обычно также совпадают.
Вывод закона Рауля
С помощью формализма Льюиса и общих формул термодинамики выведем закон Рауля.
Рассмотрим равновесие двух растворов,
из которых один конденсированный
раствор, а другой газовый (Г). Условием
равновесия двух фаз является равенство
химических потенциалов компонентов
растров.
![]()
Подставляя выражения химического
потенциала для газа и кристалла через
фугитивности получим
![]() (i=1,2,…,K),
где P – равновесное
давление конденсированного и газового
растворов при заданной температуре.
Подставим в это выражение
(i=1,2,…,K),
где P – равновесное
давление конденсированного и газового
растворов при заданной температуре.
Подставим в это выражение
![]() ,
тогда
,
тогда
![]() (1),
(1),
![]() - фугитивность чистого компонента в
кристаллическом состоянии в структуре
раствора.
- фугитивность чистого компонента в
кристаллическом состоянии в структуре
раствора.
При данной фиксированной температуре
и некотором давлении, вообще говоря,
отличном от P, в
равновесии находятся конденсированная
и газовая фаза чистого i
– го компонента. Условием равновесия
двух фаз является
![]() .
Фугитивности конденсированной фазы
при разном давлении связаны соотношением
.
Фугитивности конденсированной фазы
при разном давлении связаны соотношением
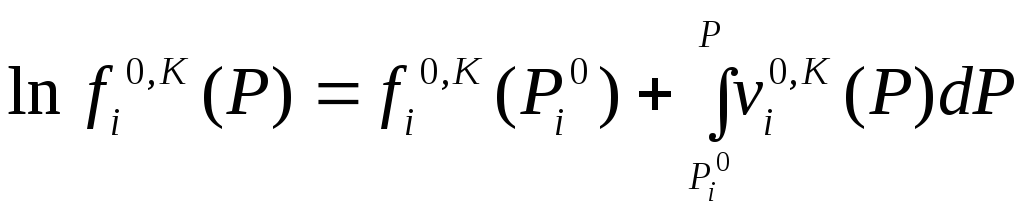 .
.
Такое же выражение имеет место и для газовой фазы
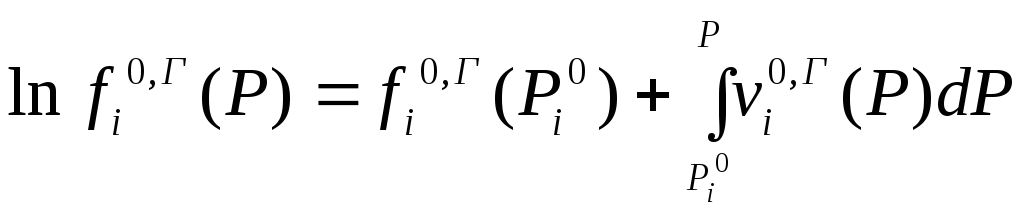
Вычитая, получим
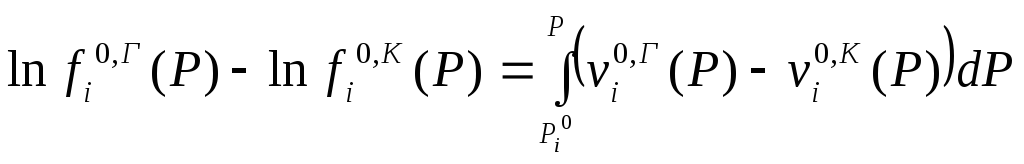 .
.
Если конденсированная фаза кристалл
или жидкость (вдали от критической
точки), то
![]() >>
>>![]() и
и
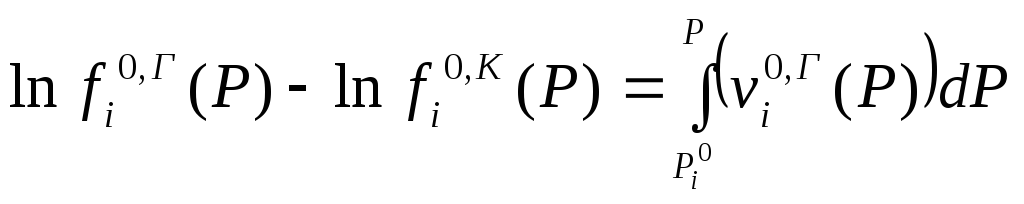 .
.
Подставляя в последнее выражение
значение для
![]() ,
получим, что при
,
получим, что при![]() >>
>>![]()
![]() или
или
![]() (2)
P – давление газа
над конденсированным раствором.
(2)
P – давление газа
над конденсированным раствором.
![]() - давление газа чистого i
–го компонента над чистым конденсированным
компонентом. Заметим, что фугитивность
- давление газа чистого i
–го компонента над чистым конденсированным
компонентом. Заметим, что фугитивность
![]() взята при давлении P
- равновесия конденсированного и
газового растворов данного состава, а
взята при давлении P
- равновесия конденсированного и
газового растворов данного состава, а
![]() - при давлении равновесия конденсированной
и газовой фаз чистого i-
го компонента. Подставив (2) в один получим
- при давлении равновесия конденсированной
и газовой фаз чистого i-
го компонента. Подставив (2) в один получим
![]() (3)
(3)
Если конденсированный раствор идеален,
то
![]() и
и
![]() (4)
(4)
Фугитивность пара i –го
компонента в газовом растворе, находящемся
в равновесии с конденсированным
раствором, пропорциональна концентрации
этого компонента в конденсированном
растворе. Коэффициентом пропорциональности
служит фугитивность пара чистого i
–го компонента. Если газовая фаза
идеальна (раствор идеальных газов)
![]()
![]()
Подставляя в (4) получим
![]() ,
где
,
где
![]() - упругость пара i –го
компонента раствора (Равновесное
парциальное давление i
–го компонента).
- упругость пара i –го
компонента раствора (Равновесное
парциальное давление i
–го компонента).
![]() - упругость пара i –го
компонента (давление
равновесия конденсированной и газовой
фаз чистого компонента). Это соотношение
известно как закон Рауля.
- упругость пара i –го
компонента (давление
равновесия конденсированной и газовой
фаз чистого компонента). Это соотношение
известно как закон Рауля.
