
echma_2011 (1)
.pdf
Титрование ионов Ca2+ раствором ЭДТА в аммиачном буферном растворе при рН 9.
Ca2+ + H2Y2- = CaY2- + 2H+.
До точки эквивалентности вытесняемые ионами Ca2+ ионы водорода связываются буферной смесью, поэтому электропроводность остается практически неизменной. После точки эквивалентности избыток титранта приводит к повышению электропроводности раствора (рис. 2.12).
W |
|
|
1 |
Vк.т.т. |
V(H2Y2-), мл |
Рис. 2.12. Кривая титрования ионов Ca2+ раствором ЭДТА в аммиачном |
|
буферном растворе рН 9 |
|
Если константы устойчивости металлов различаются значимо, то возможно дифференцированное титрование смеси ионов металлов комплексоном III. Например, титрование смеси ионов Fe3+ и Fe2+ можно проводить следующим образом: при рН 3 титруют раствором трилона Б ионы трехвалентного железа; после первой точки эквивалентности, когда электропроводность начинает уменьшаться за счет связывания выделившихся протонов, в раствор добавляют буферную смесь, доводят рН до 9 и продолжают добавлять титрант. После достижения второй точки эквивалентности электропроводность начинает увеличиваться (рис. 2.13).
51
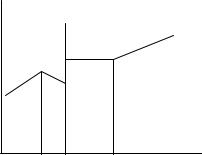
W |
|
|
|
1 |
|
Vк.т.т.1 |
Vк.т.т.2 |
V(H2Y2-), мл |
Рис. 2.13. Кривая титрования ионов Fe3+ и Fe2+ раствором ЭДТА |
||
2.4.Особенности кондуктометрических методов анализа
1.Метод позволяет проводить определение не только в прозрачных, но и в окрашенных и мутных растворах, а также в присутствии окислителей, восстановителей органических веществ.
2.Возможность определения различных неорганических и органических индивидуальных соединений.
3.Высокая чувствительность метода позволяет работать с разбавленными растворами.
4.Анализ водных и органических растворов.
5.Возможность автоматизации процесса (хронокондуктометрия).
6.Использование разнообразных типов реакций.
7.Во многих случаях нет необходимости проводить предварительную пробоподготовку.
8.Простота определения конечной точки титрования по пересечению двух прямых.
9.Возможность проведения дифференцированного титрования смесей электролитов, что невозможно при титровании с визуальной индикацией конечной точки титрования.
52
2.5.Лабораторные работы
2.5.1.Аппаратура и техника кондуктометрических измерений
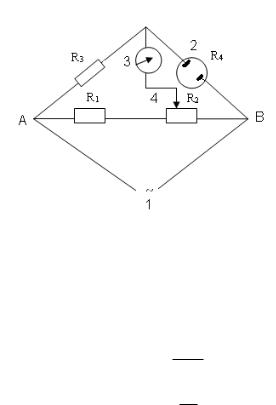
Электропроводность растворов как таковую обычно не измеряют. Обычно проводят измерение обратной ﭏ величины – сопротивления R. Наиболее распространенным прибором для измерения сопротивления является мостик Кольрауша (рис. 2.14).
Рис. 2.14. Схема моста Кольрауша: 1 – источник переменного тока, 2 – электролитическая ячейка, 3 – гальванометр, 4 – подвижной контакт, АВ – реохорд
При измерении Rx скользящий контакт (4) перемещают до тех пор, пока стрелка гальванометра не остановится на нуле. При балансе моста (i=0) напряжение на обоих плечах моста уравнивается, т. е.
Rx R1R3 , R2
Wx 1 .
Rx
В настоящее время разработаны кондуктометрические датчики, выдающие результат в См. Например приборы отечественных производителей серии «Анион», «Мультитест» и др.
53

Ячейка для кондуктометрических измерений
Ячейка состоит из стеклянного сосуда, в который опущены два электрода (как правило, платиновых), расстояние между которыми постоянно. Для увеличения поверхности и уменьшения поляризационных явлений платиновые электроды предварительно покрывают платиновой чернью (путем электролиза из раствора
H2PtCl6+PtAc).
При прямых кондуктометрических измерениях определяют постоянную кондуктометрической ячейки. Для этого ячейку заполняют 0,01 М раствором KCl, термостатируют при температуре 25˚С и измеряют сопротивление раствора. Константу ячейки рассчитывают по формуле
K Sl R ,
где K – константа ячейки,
– удельная электропроводность раствора (справочные данные), R – измеренное сопротивление раствора, Ом.
2.5.2.Порядок измерения сопротивления на приборе Р-38
1.Переключатель гальванометра (6) и переключатель питания
(7)установите в среднее положение и только после этого включите прибор в сеть. При включении загорается индикаторная лампа (4). Убедитесь, что стрелка гальванометра (5) совпадает с нулевым делением шкалы.
2.Подсоедините к клеммам Rx (9) проводники от электродов. Электроды поместите в ячейку с анализируемым раствором. Переключатель питания (7) переведите в положение «~», а переключатель гальванометра в положение «Грубо». Сбалансируйте мост ручкой регулирования плеч (3) так, чтобы стрелка гальванометра была в нулевом положении. Затем переключатель (6) поставьте в положение «Точно» и проведите балансировку ручкой (3). Снимите показания со шкалы отсчета отношения плеч (2), учитывая множитель R на переключателе (8). После завершения работы переключатели (6) и (7) установите в среднее положение.
54
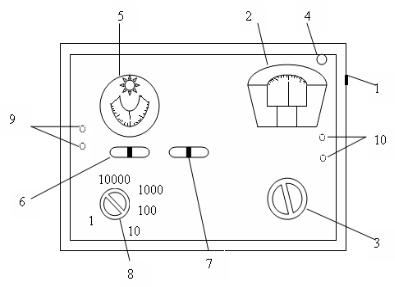
Рис. 2.15. Реохордный мост Р-38: 1 – гнездо для включения прибора в сеть переменного тока; 2 – шкала отсчета отношения плеч; 3 – ручка регулирования отношения плеч; 4 – индикаторная лампа; 5 – нуль-гальванометр; 6 – переключатель гальванометра; 7 – переключатель питания; 8 – переключатель сопротивления сравнительного плеча (R); 9 – зажимы для подключения электролитической ячейки; 10 – клеммы для подключения внешнего сопротивления.
2.5.3. Порядок измерения электропроводности на приборе «Мультитест КСЛ»
1.Подключите кондуктометрический датчик к разъему «ДК» на боковой панели и датчик температуры к разъему «ДТ» на задней панели.
2.Подсоедините прибор к сети и переведите переключатель питания на задней панели в положение «1». После окончания автотестирования прибор автоматически переходит в основное меню с активным пунктом «Измерение».
3.Опустите кондуктометрический датчик и датчик температуры в исследуемый раствор.
55

4.Для измерения величины удельной электрической проводимости нажмите клавишу «ввод», для выхода из режима измерения – клавишу «выход» (рис. 2.16).
5.После завершения работы отключите прибор от сети, отсоедините кондуктометрический датчик и тщательно промойте его дистиллированной водой.
Рис. 2.16. Передняя панель прибора «Мультитест»
2.5.4. Математическая обработка данных кондуктометрического титрования
Для кондуктометрического титрования зависимость аналитического сигнала от объѐма добавленного титранта Е=f(V) имеет вид двухфазной линейной зависимости (рис. 2.4), VKTT для которой определяется по их пересечению (т.е. требуется решить уравнение f1(V)=f2(V) относительно V). Оценки параметров линейных зависимостей f1(V) и f2(V) можно найти при помощи линейного метода наименьших квадратов (МНК). Для этой цели удобно использовать табличные редакторы со встроенной функцией МНК, такие как MicrosoftOffice Excel и Openoffice.org Calc. В
упомянутых выше редакторах функции по реализации МНК называются ЛИНЕЙН и LINEST соответственно. Для получения более полной информации по работе предложенных функций воспользуйтесь разделом Справка <F1> для выбранного редактора.
Пример записи функции МНК по расчѐту оценок параметров линейной зависимости в редакторе MicrosoftOfficeExcel: ЛИНЕЙН(B1:B5;A1:A5;1;1), где B1:B5 массив данных оси абсцисс, A1:A5 массив данных оси ординат, 1;1 – логические константы для для использования функции вида y=a+b·x и вывода подробной информации линейного регрессионного анализа. Для использования
56
упомянутых функций в режиме обработки массивов данных используйте сочетание клавиш <Ctrl> + <Shift> + <Enter>.
2.5.5.Кондуктометрическое титрование
2.5.5.1.Лабораторная работа 4. Определение хлороводородной
кислоты
Цель работы:
1.Получение навыков измерения электропроводности раствора на приборе «Мультитест КСЛ» или сопротивления на приборе Р–38.
2.Сравнение методов визуальной и кондуктометрической индикации конечной точки титрования.
Сущность методики.
Аликвоту контрольного раствора хлороводородной кислоты титруют раствором щелочи (С = 0.10 моль/л), следя за изменением электропроводности (Мультитест КСЛ) или сопротивления (Р–38) раствора. Конечную точку титрования находят по излому кривой кондуктометрического титрования. Для сравнения проводят аналогичное титрование с визуальной индикацией конечной точки титрования.
Обоснование методики анализа
1.На основании уравнения реакции и данных о подвижности ионов нарисуйте предполагаемый вид кривой титрования в координатах W – V(NaOH).
2.Какие факторы должны поддерживаться в процессе кондуктометрического титрования на постоянном уровне?
3.На что влияет изменение объема раствора в процессе титрования?
4.Проведите обоснование выбора кислотно-основного индикатора при определении конечной точки титрования с визуальной индикацией.
Экспериментальная часть Оборудование:
реохордный мост Р–38 или кондуктометр Мультитест КСЛ;
57
кондуктометрический датчик (или система из двух платиновых электродов, жестко закрепленных на определенном расстоянии);
магнитная мешалка;
штатив лабораторный с двумя лапками;
стакан на 200 мл;
бюретка на 25 мл;
пипетка градуированная 0 – 5 мл;
колба для титрования коническая;
колба мерная на 50 мл для приготовления контрольного раствора.
Реактивы:
рабочий раствор NaOH (c = 0.01 моль/л);
контрольный раствор HCl;
индикатор – метиловый оранжевый или смешанный.
Порядок выполнения работы:
1.Внимательно ознакомьтесь с инструкцией к прибору.
2.Согласно инструкции проведите калибровку прибора.
3.В колбу для титрования внесите 5 мл контрольного раствора, добавьте 2–3 капли индикатора и проведите титрование раствором NaOH до перехода окраски индикатора. Титрование проведите минимум 3 раза, данные занесите в лабораторный журнал.
4.В стакан для кондуктометрического титрования внесите 5 мл контрольного раствора, добавьте ~150 мл дистиллированной воды и опустите кондуктометрический датчик таким образом, чтобы платиновые электроды были полностью покрыты раствором. Раствор перемешайте магнитной мешалкой. Далее проведите титрование, добавляя титрант порциями по 0.5 мл и измеряя при этом электропроводность или сопротивление раствора. Для более точного определения конечной точки титрования объем титранта должен быть примерно в 2 раза большим по сравнению с его количеством, затраченным при индикации к.т.т. с визуальной индикацией.
5.Результаты всех измерений занесите в таблицу:
Таблица 2.1. Результаты кондуктометрического титрования HCl
V, NaOH, мл |
R, Ом |
W, См |
|
|
|
58
6.По полученным данным постойте кривую
кондуктометрического титрования в координатах
WV (NaOH) и по пересечению прямых найдите Vк.т.т..
7.Проведите статистическую обработку результатов анализа.
Обсуждение результатов
1.Сравните полученную на опыте зависимость W V (NaOH) с теоретически ожидаемой.
2.Сравните два способа (визуальный и кондуктометрический) индикации к.т.т. (точность, правильность, экспрессность).
3.Сделайте краткие выводы по работе.
2.5.5.2. Лабораторная работа 5. Определение сульфат-ионов методом осадительного титрования
Цель работы:
1.Получение навыков измерения электропроводности раствора на приборе «Мультитест КСЛ» или сопротивления на приборе Р–38.
2.Сравнение методов визуальной и кондуктометрической индикации конечной точки титрования.
Сущность методики.
Аликвоту контрольного раствора Na2SO4 титруют раствором BaCl2 (С=0.10 моль/л), следя за изменением электропроводности (Мультитест КСЛ) или сопротивления (Р–38) раствора. Конечную точку титрования находят по излому кривой кондуктометрического титрования. Для сравнения проводят аналогичное титрование с визуальной индикацией конечной точки титрования.
Обоснование методики анализа
1.На основании уравнения реакции и данных о подвижности ионов нарисуйте предполагаемый вид кривой титрования в координатах W V (BaCl2 ) .
2.Как зависит ход кривой титрования от Ks для данного осадка, от подвижности ионов, от скорости осаждения?
3.Какими способами можно увеличить скорость реакции осаждения?
Экспериментальная часть Оборудование:
реохордный мост Р–38 или кондуктометр Мультитест КСЛ;
59
кондуктометрический датчик (или система из двух платиновых электродов, жестко закрепленных на определенном расстоянии);
магнитная мешалка;
штатив лабораторный;
стакан на 200 мл;
бюретка на 25 мл;
пипетка градуированная 0 – 5 мл;
колба для титрования коническая;
колба мерная на 50 мл для приготовления контрольного раствора.
Реактивы:
рабочий раствор BaCl2 (С1/2 = 0.2 моль/л);
контрольный раствор Na2SO4;
сухая соль BaSO4;
индикатор – 0.2 М K2CrO4.
Порядок выполнения работы:
1.Внимательно ознакомьтесь с инструкцией к прибору.
2.Согласно инструкции проведите калибровку прибора.
3.В колбу для титрования внесите 5 мл контрольного раствора, добавьте 2–3 капли индикатора и проведите
титрование раствором BaCl2 (С1/2=0.2 моль/л) до появления кирпично красной окраски раствора с осадком. Титрование проведите минимум 3 раза, данные занесите в лабораторный журнал.
4.В стакан для кондуктометрического титрования внесите 5 мл контрольного раствора, добавьте ~ 40 мл
дистиллированной воды и немного сухого BaSO4. Опустите кондуктометрический датчик таким образом, чтобы платиновые электроды были полностью покрыты раствором. Раствор перемешайте магнитной мешалкой. Далее проведите титрование, добавляя титрант порциями по 0.5 мл и измеряя при этом электропроводность или сопротивление раствора. При титровании определенная величина электропроводности раствора устанавливается не сразу, а по истечении некоторого времени, особенно вблизи точки эквивалентности. Для ускорения реакции был добавлен BaSO4. Добавление титранта ведите до тех пор,
60
