
echma_2011 (1)
.pdf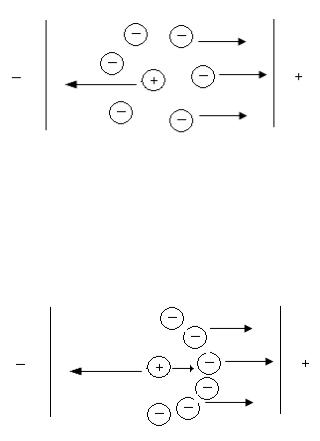
Рис. 2.1. Электрофоретический эффект
Релаксационный эффект объясняется тем, что вокруг движущегося иона ионная атмосфера разрушается и вновь возникает по мере его движения. При этом ион оказывается несимметрично расположен в своей ионной атмосфере. Ионная Атмосфера не успевает полностью сформироваться при движении иона и, имея заряд, противоположный иону, тормозит его движение.
Рис. 2.2. Релаксационный эффект
На практике электропроводность в зависимости от концентрации проходит через максимум.
41
ﭏ
HCl
KCl
CH3COOH
C, моль/л
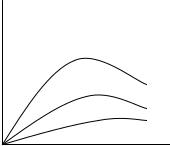
Рис. 2.3. Влияние концентрации на электропроводность раствора
Для слабых электролитов с увеличением концентрации удельная электропроводность возрастает, так как растет число частиц носителей заряда, но одновременно уменьшается – степень диссоциации, поэтому удельная электропроводность ( ) тоже будет уменьшаться.
Для сильных электролитов с ростом концентрации удельная электропроводность ( ) возрастает, так как растет число заряженных частиц. Затем скорость движения ионов уменьшается за счет увеличения ионной силы раствора.
Влияние природы растворенного вещества на электропроводность
Природа растворенного вещества влияет на величину электропроводность за счет двух факторов:
1.Характер связи. Чем более ионной является связь в молекуле, тем больше степень диссоциации, и тем выше удельная электропроводность.
2.Размер сольватированных ионов. Чем больше радиус сольватированного иона, тем ниже удельная электропроводность.
Влияние температуры
При повышении температуры электропроводность растворов увеличивется:1) за счет увеличения степени диссоциации, 2) за счет уменьшения вязкости растворителя, что приводит к повышению λ0.
В справочниках подвижность ионов обычно приводят при 25˚С. Для пересчета подвижности при другой температуре можно воспользоваться выражением
42
|
(t) |
(25 C)[1 (t 25)] , |
(1.7) |
0i |
0i |
|
|
где α – температурный коэффициент электропроводности, зависящий от природы ионов и растворителя.
Величина температурного коэффициента при средних температурах в водных растворах для большинства ионов изменяется в пределах 0.02÷0.025, поэтому увеличение удельной и эквивалентной электропроводности раствора при повышении температуры на 1˚ составляет примерно 2–2,5%. Так как погрешность измерения электропроводности при изменении температуры высока, при проведении кондуктометрических исследований растворы необходимо термостатировать.
2.3. Кондуктометрическое титрование
Кондуктометрическое титрование основано на измерении электропроводности раствора, меняющейся в процессе химической реакции между исследуемым веществом и титрантом. Точку эквивалентности фиксируют по резкому излому кривой титрования.
Например, пусть определяемое вещество AB и титрантCD в растворе полностью диссоциируют на ионы, а в результате реакции
образуется малодиссоциируемое вещество AD:
A+ + B- + C+ + D- = AD + C+ + D-.
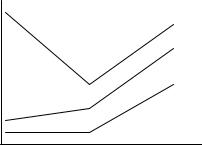
Вследствие изменения состава раствора в процессе титрования происходит изменение электропроводности раствора электролита. При этом до точки эквивалентности возможен различный характер изменения электропроводности в зависимости от соотношения подвижности ионов A+ и С+. Схематичный вид кривых титрования представлен на рис. 1.2.
43
W |
|
|
|
|
|
1 |
|
1.U A UC |
|||
|
2 |
2.U |
|
U |
|
|
|
A |
C |
||
|
|
|
|
||
|
3 |
3.U |
|
U |
|
|
|
A |
C |
||
|
|
|
|
||
|
V, мл |
|
|
|
|
Рис. 2.4. Кривые кондуктометрического титрования |
|
|
|
||
Чем острее угол на кривой титрования, тем точнее можно определить точку эквивалентности.
В кондуктометрическом титровании можно использовать реакции нейтрализации, осаждения, комплексообразования. Окислительно-восстановительные реакции используют крайне редко (в основном в полуводных растворителях) из-за того, что протекают они в сильнокислых или сильнощелочных средах, на фоне которых трудно зафиксировать малое изменение электропроводности за счет основной реакции.
2.3.1. Реакции нейтрализации
Воснове кислотно-основных реакций лежит процесс
взаимодействия протона с гидроксид-ионом:
H+ + OH-H2O
При титровании кислот основаниями происходит замена высокоподвижных ионов водорода (гидроксония) ионами с намного меньшей подвижностью. При титровании кислот необходимо учитывать общее правило: чем более диссоциирована кислота, тем ближе отвечает точке эквивалентности минимум электропроводности на кривой кондуктометрического титрования.
44

Титрование сильной кислоты сильным основанием
Хлороводородная кислота титруется гидроксидом натрия:
H+ + Cl- + Na+ + OH- = Na+ + Cl- + H2O
До точки эквивалентности высокоподвижные ионы водорода замещаются на менее подвижные ионы натрия, поэтому наблюдается уменьшение электропроводности. После точки эквивалентности в раствор добавляется избыток титранта (сильный электролит), поэтому электропроводность резко возрастает. Вклад всех ионов участвующих в реакции отображен на рис. 2.5, а результирующая кривая – на рис. 2.6.
С |
|
|
|
|
W |
|
|
|
|
|
|
1 |
|
|
|
|
1 |
|
|
[H+] |
|
[Na+] |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
[Cl-] |
|
[OH-] |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Vктт. |
V, мл |
|
|
|
Vктт |
V(NaOH), |
|||
Рис. 2.5. Изменение концентрации |
Рис. |
2.6. |
Результирующая |
кривая |
|||||
кондуктометрического |
титрования HCl |
||||||||
ионов в процессе |
титрования |
HCl |
|||||||
раствором NaOH |
|
|
|||||||
раствором NaOH |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||
Титрование слабой кислоты сильным основанием
Уксусная кислота титруется гидроксидом натрия:
CH3COOH + Na+ + OH- = CH3COO- + Na+ + H2O.
Так как уксусная кислота частично диссоциирует на ионы, то в начальный момент титрования происходит незначительное уменьшение электропроводности за счет замещения в растворе высокоподвижных ионов водорода на менее подвижные ионы натрия. Далее электропроводность начинает медленно возрастать, так как в присутствии одноименных ионов (ацетат-ион) диссоциация уксусной кислоты уменьшается, и в растворе накапливаются ионы титранта. После точки эквивалентности
45
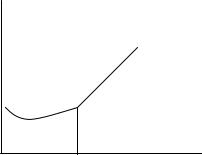
электропроводность резко возрастает за счет избытка титранта (сильный электролит). Кривая титрования представлена на рис. 2.7.
W
1
Vк.т.т. |
V(NaOH), мл |
Рис. 2.7. Кривая титрования уксусной кислоты раствором гидроксида натрия
Титрование слабой кислоты слабым основанием
Реакции данного типа в кондуктометрии не используются из-за слабо выраженного изменения электропроводности в растворе в процессе титрования.
Титрование смеси сильной и слабой кислот сильным основанием
Смесь хлороводородной и уксусной кислот титруется
гидроксидом натрия.
H+ + Cl- + Na+ + OH- = Na+ Cl- + H2O
CH3COOH + Na+ + OH- = CH3COO- + Na+ + H2O.
Сначала будет титроваться сильная кислота, так как диссоциация слабой кислоты подавлена. На кривой (рис. 1.6 участок 1) наблюдается резкое уменьшение электропроводности за счет связывания свободных протонов в воду. Второй участок кривой отвечает процессу титрования слабой кислоты, данный участок практически прямолинеен. После того, как будет достигнута вторая точка эквивалентности, электропроводность раствора резко возрастает из-за избытка титранта в системе (участок 3).
46

W
1
1
3
2
Vк.т.т.1 Vк.т.т.2 |
V(NaOH), мл |
Рис. 2.8. Кривая титрования смеси HCl и CH3COOH раствором NaOH
Титрование многоосновных кислот
При титровании многоосновных кислот сильным основанием вид кривой аналогичен титрованию смеси сильной и слабой кислоты (рис. 2.8). Результат титрования и ход кривой зависит от соотношения констант различных ступеней диссоциации.
Титрование сильного основания слабой кислотой
Гидроксид натрия титруется уксусной кислотой:
Na+ + OH- + CH3COOH = CH3COO- + Na+ + H2O.
До точки эквивалентности наблюдается резкое уменьшение электропроводности, вызванное заменой высокоподвижных гидроксильных ионов менее подвижными ацетат-ионами. После точки эквивалентности электропроводность практически не меняется, так как диссоциацию титранта (CH3COOH) подавляют присутствующие в растворе ацетат-ионы (рис. 2.9).
47
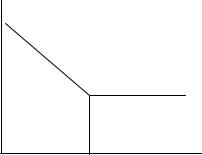
W |
|
|
1 |
Vк.т.т. |
V(CH3COOH), мл |
Рис.2.9. Кривая титрования гидроксида натрия уксусной кислотой |
|
Титрование сильного основания сильной кислотой
При титровании сильных оснований сильными кислотами вид кривой титрования аналогичен кривой титрования сильной кислоты сильным основанием (рис. 2.6).
Титрование солей подвергающихся гидролизу
Титрование хлорида алюминия гидроксидом натрия:
Al3+ + 3Cl- + 3Na+ + 3OH- = Al(OH)3 + 3Na+ + 3Cl-.
Хлорид алюминия – соль, образованная слабым основанием и сильной кислотой. Данная соль в водном растворе подвергается гидролизу по катиону. Для предотвращения гидролиза раствор перед анализом, как правило, подкисляют. При титровании на начальном этапе будет идти процесс нейтрализации ионов водорода в кислом растворе соли (рис. 2.10 участок 1), в результате чего электропроводность будет резко уменьшаться. Второй участок кривой отвечает процессу связывания ионов алюминия в малорастворимый гидроксид. На данном участке происходит лишь незначительное изменение электропроводности, так как ионы алюминия и натрия по подвижности достаточно близки (Na+ – 52, Al3+ – 62). После токи эквивалентности (участок 3) наблюдается повышение электропроводности, обусловленное избытком титранта.
48
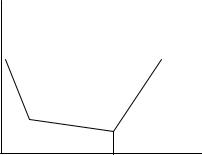
W |
|
1 |
|
1 |
|
2 |
3 |
|
|
Vк.т.т. |
V(NaOH), мл |
Рис. 2.10. Кривая титрования раствора AlCl3 гидроксидом натрия |
|
По методу нейтрализации можно определять все вещества, участвующие в протолитических реакциях.
2.3.2.Реакции осаждения
Впроцессе титрования по методу осаждения изменение электропроводности будет зависеть от соотношения подвижности ионов, участвующих в реакции (рис. 2.4). Чем меньше подвижность иона, который замещает в растворе реагирующий ион, тем острее угол на кривой титрования и тем точнее можно установить точку эквивалентности. Если растворимость осадка значительна, то при титровании рекомендуется охладить анализируемый раствор или внести в систему спирт (уменьшить S).
2.3.3.Реакции комплексообразования
Вкачестве лигандов при титровании по методу комплексообразования используют NH3, F-, CN-, комплексоны.
Рассмотрим вид кривой комплексонометрического титрования методом кондуктометрии на примере титрования различных ионов раствором ЭДТА.
ЭДТА (трилон Б, комплексон III) образует устойчивые
комплексы с большинством ионов металлов состава 1:1.
49
Собственные константы ионизации этилендиаминтетрауксусной кислоты:
рК1=2.0; рК2=2.6; рК3=6.16; рК4=10.16.
Константы устойчивости комплексов (рК) меняются от 7.31 у Ag+ до 37.8 у Tl3+. Для повышения устойчивости комплексов титрование проводят в щелочных средах (чаще всего используют аммиачные буферные растворы), однако если комплекс достаточно прочный, то титрование можно проводить в нейтральной и даже кислой среде. Поэтому вид кривой титрования будет определяться не только природой определяемого иона, но и наличием буферной смеси в растворе. Возможно два вида кривых комплексонометрического титрования.
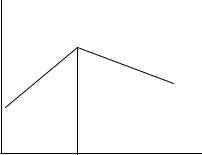
Титрование ионов Fe3+ раствором ЭДТА (H2Y2-) при рН 2:
Fe3+ + H2Y2- = FeY- + 2H+.
До точки эквивалентности ионы железа вытесняют в раствор двунатриевой соли этилендиаминтетрауксусной кислоты высокоподвижные ионы водорода, в результате чего электропроводность возрастает. После точки эквивалентности при
добавлении избытка титранта будет идти его протонирование:
H2Y2- + H+ = H3Y-,
т. е. накопившиеся в растворе при протекании первой реакции ионы водорода будут связываться в слабодиссоциируемую этилендиаминтетрауксусную кислоту. В результате этого процесса электропроводность раствора будет уменьшаться (рис. 2.11).
W |
|
|
1 |
Vк.т.т. |
V(H2Y2-), мл |
Рис. 2.11. Кривая титрования ионов Fe3+ раствором ЭДТА |
|
50
