
-

ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
БАШКИРСКИЙ ГОСУДАРСТВЕННЫЙ АГРАРНЫЙ
УНИВЕРСИТЕТ
Кафедра химии
Методические указания
для выполнения домашнего задания (эссе)
по дисциплине
Б2.В.1 ОСНОВЫ ОБЩЕЙ И НЕОРГАНИЧЕСКОЙ ХИМИИ
Модуль 1 Теоретические основы общей химии
направление подготовки бакалавра
260200 Продукты питания животного происхождения
Уфа - 2013
УДК
Рекомендовано к изданию методической комиссией
факультета пищевых технологий
(протокол №_______ от «______» ________________________ 2013 г.)
\
Составитель: доцент Ганиева Е.С.
Рецензент:
доцент кафедры химии Шабаева Г.Б.
Ответственный за выпуск:
заведующий кафедрой химии профессор Исламова Р.М.
ВВЕДЕНИЕ
Данное методическое указание составлено для студентов 1 курса факультета пищевых технологий направления подготовки 260200 Продукты питания животного происхождения для выполнения домашней работы (эссе) по дисциплине Б2.В.1 Основы общей и неорганической химии. Оно включает в себя теоретический материал и контрольные задачи по темам «Эквивалент. Моль - эквивалент. Молярная масса эквивалента» и «Основные закономерности химических процессов», которые входят в «Модуль 1. Теоретические основы общей химии». Данные задания помогут усвоить теоретический материал и подготовиться к рубежной контрольной работе по модулю 1.
Для выполнения этих заданий необходимо проработать лекционный материал и учебные пособия. Студент выполняет задания своего варианта, номер которого укажет преподаватель. Работа оформляется на бумаге формата А4, причем приводится условие задачи и подробное решение задачи. В конце работы необходимо привести список использованной литературы.
Модуль 1 Теоретические основы общей химии
СОДЕРЖАНИЕ
1.1 Эквивалент. Моль - эквивалент. Молярная масса эквивалента.
Закон эквивалентов. с.5
1.2 Основные закономерности химических процессов с.14
1.2.1 Основы химической термодинамики с.14
1.2.2 Основы химической кинетики с.21
1.2.3 Основы химического равновесия с.24
1.2.4 Основы фазового равновесия с.27
ПРИЛОЖЕНИЕ с.35
ЛИТЕРАТУРА с.37
1.1 Эквивалент. Моль - эквивалент. Молярная масса эквивалента.
Закон эквивалентов.
Эквивалент- одно из стехиометрических понятий химии, указывает наравноценность количественных отношенийисходных и образующихся веществ в химической реакции. Такая равноценность обуславливается равенством числа разрывающихся химических связей в исходных веществах и образующихся - в продуктах реакции.
Пример:
Fe(OH)3+ 3HCl→FeCl3+ 3H2O
1 моль 3 моль 1 моль 3 моль
В графической форме:
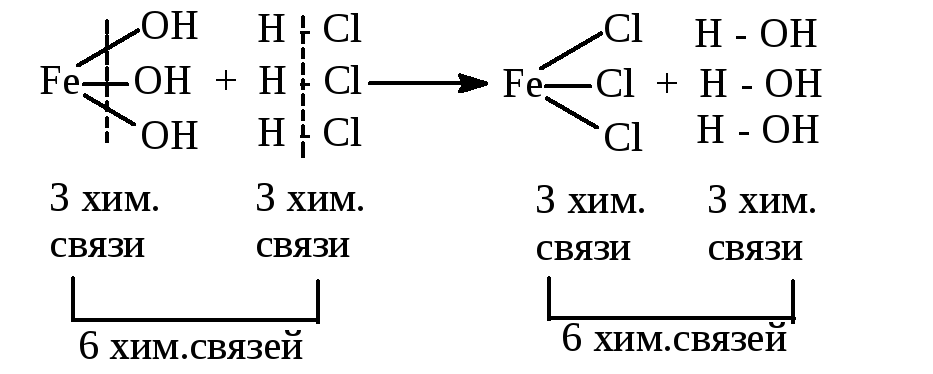
1Fe(OH)3, 1HCl, 1FeCl3, 1HOН содержат различное число реакционно-способных химических связей и в этом смысле указанные количества этих веществ не равноценны, не эквивалентны.
Реакция произойдет, если на 3 разрывающиеся химические связи в Fe(OH)3будет приходиться 3 связи вHCl, что соответствует 3HCl. Как показывает приведенное выше уравнение, равноценными (другими словами, эквивалентными) по числу связей будут 1Fe(OH)3, 3HCl, 1FeCl3, 3HOН. Эквивалентными будут и такие доли молекул веществ, которые соответствуют возможности образования одной химической связи. Для 1 моля сложного вещества эта доля определит 1 моль-экв.
![]()
Масса одного моль – эквивалента сложного вещества, называемая молярной массой эквивалента, равна:
![]()
Число реакционноспособных химических связей в зависимости от состава и строения вещества можно выразить более конкретно:
-
Типы соединений
nх. св.
Кислоты
nH+
Основания
nOH-
Соли
nkt · Zkt = nAn · ZAn
Оксиды
nэлем. · Zэлем. = nO · ZO
В рассматриваемой реакции:


Значения масс эквивалентов сложных
веществ можно выразить через массы
эквивалентов, элементов или ионов его
составляющих. Заменив в выражении
![]() молярную массу на численно равную
относительную молекулярную (Мr),
молярную массу эквивалента – на
эквивалентную (Э), получим:
молярную массу на численно равную
относительную молекулярную (Мr),
молярную массу эквивалента – на
эквивалентную (Э), получим:
![]()
Эквивалентность реагирующих и образующихся веществ отражает закон эквивалентов, которому можно придать различные математические выражения:
nЭ,1 =nЭ,2=nэ,3= …
nЭ– число моль-эквивалентов
![]()
m– масса;
V– объем;
VЭ– объем одного моль-эквивалента газообразного вещества.
2)
![]()
3)
![]()
Объем 1 моль - эквивалента газов имеет различные значения:
![]()
1
 моль Н222,4 л х
= 11,2 л
моль Н222,4 л х
= 11,2 л
1 моль-экв→ ½ моль х л
моль-экв→ ½ моль х л


1 моль О222,4л х = 5,6 л
моль О222,4л х = 5,6 л
1 моль-экв → ¼ моль х л
моль-экв → ¼ моль х л
![]()
Перед решением задач необходимо вспомнить:
простое и сложное вещество;
валентность элемента;
основные классы неорганических соединений;
номенклатура неорганических соединений;
графические формулы неорганических соединений;
понятие основность кислоты;
понятие кислотность основания;
электролитическая диссоциация неорганических соединений;
относительная атомная масса элемента;
относительная молекулярная масса вещества;
молярная масса вещества;
эквивалент;
моль – эквивалент,
молярная масса эквивалента;
закон эквивалентов.
