
- •Лекция 5
- •4.6. Ионные связи и поляризация
- •4.7. Теории металлической связи
- •4.9. Водородные связи
- •4.10. Межмолекулярные силы Ван-дер-Ваальса
- •4.11. Комплексные соединения. Определения, составные части и классификация
- •4.12. Равновесие в растворах комплексных соединений
- •4.13. Химическая связь в комплексных соединениях
4.12. Равновесие в растворах комплексных соединений
При диссоциации в растворах и многих химических реакциях комплекс сохраняется:
[Ni(NH3)4]SO4 [Ni(NH3)4]2+ + SO42,
[Ni(NH3)4]SO4 + BaCl2 = [Ni(NH3)4]Cl2 + BaSO4 .
Обычно комплексные соединения в растворах диссоциируют на внешнюю и внутреннюю координационные сферы практически полностью по типу сильных электролитов (первичная диссоциация). Комплексные соединения обладают различной прочностью внутренней координационной сферы. Наряду с соединениями, внутренняя сфера которых отличается значительной прочностью и для которых диссоциация ничтожно мала, существуют соединения с крайне непрочной внутренней сферой. Растворы этих соединений практически не содержат комплексных ионов, так как они полностью диссоциируют на свои составные части (двойные соли). Диссоциация внутренней координационной сферы носит название вторичной, является обратимым процессом и проходит по типу слабых электролитов. Момент наступления равновесия характеризуется константой равновесия, которая в случае комплексного иона носит название константы нестойкости (КН).
Пример 8. Напишите процессы диссоциации и выражение для константы нестойкости комплексной соли К4[Fe(CN)6].
Решение. Если комплексная соль гексацианоферрат (III) калия, являясь сильным электролитом, в водном растворе практически полностью диссоциирует на ионы внешней и внутренней сфер:
K4[Fe(CN)6] = 4K+ + [Fe(CN)6]4 ,
то комплексный ион диссоциирует в незначительной степени на составляющие его частицы:
[ Fe(CN)6]4
Fe2+
+ 6CN
.
Fe(CN)6]4
Fe2+
+ 6CN
.
Константа равновесия этой реакции в данном случае является константой нестойкости (КН) комплекса:
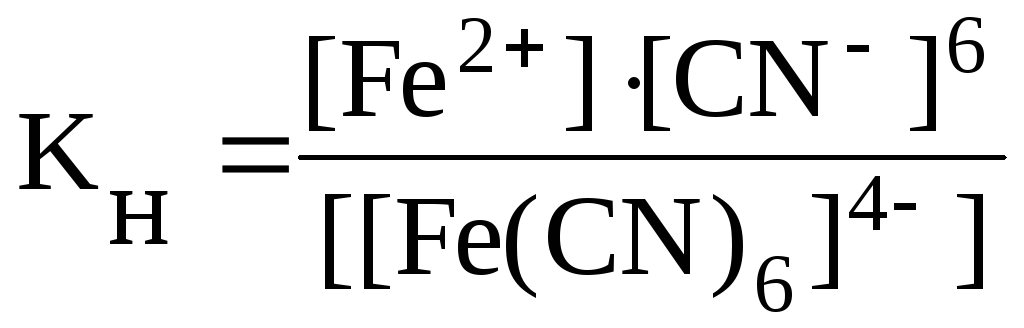 .
.
Значения констант нестойкости различных комплексных ионов колеблются в широких пределах и могут служить мерой устойчивости комплекса.
Чем меньше значение Кн, тем более прочен данный комплекс.
Сравним, например, константы нестойкости и устойчивость ряда комплексов серебра [Ag(NO2)2], [Ag(NH3)2]+, [Ag(S2O3)]3 и [Ag(CN)2]. Для них Кн: 1,3·103 ; 5,7·108; 2,5·1014 и 8,0·1021, соответственно. Следовательно, можно прийти к выводу, что наименее устойчивым из этих ионов является первый, а наиболее устойчивым последний. Очевидно также, что при одной и той же молярной концентрации комплексного соединения концентрация ионов Аg+ будет больше в растворе первого соединения и меньше в растворе последнего.
4.13. Химическая связь в комплексных соединениях
Для объяснения образования и свойств комплексных соединений в настоящее время применяется теория валентных связей (ВС), теория кристаллического поля (ТКП) и теория молекулярных орбиталей (МО). Мы ограничимся методом ВС.
Теория ВС для комплексных соединений. Пространственная структура комплексных частиц может быть объяснена с позиций метода (ВС). Согласно этому методу связь между центральным атомом и лигандами образуется за счет донорно-акцепторного взаимодействия: лиганд донор, а центральный атом акцептор электронной пары. При этом ковалентная -связь образуется в результате перекрывания вакантной орбитали центрального атома или иона комплексообразователя с заполненными, т.е. содержащими неподеленные пары электронов, орбиталями лигандов. Максимально возможное число -связей определяет координационное число комплексообразователя. Поскольку при одинаковых лигандах образующиеся -связи равноценны, то образование комплексной частицы сопровождается гибридизацией акцепторных орбиталей комплексообразователя. Критерием для определения типа гибридизации могут служить опытные данные о магнитных свойствах образующихся комплексов.
Пример 9. Определить пространственную структуру и устойчивость комплексных ионов: а) парамагнитного [CoF6]3 и б) диамагнитного [Co(NH3)6]3+.
Решение. а) [CoF6]3 координационное число Co равно 6, степень окисления () Co = +3; электронное строение атома Co …3d74s2, иона Co3+ ....3d64s04p04d0; для F ..2s22p5, для иона F .. 2s22p6.

(Крестом обозначена неподеленная пара электронов от лиганда иона F).
Из показанной схемы ВС следуют выводы:
Co3+ акцептор 6-ти электронных пар;
АО Co3+ гибридизованы, тип гибридизации sp3d2 – октаэдричес-
кий;
комплекс имеет 4 неспаренных электрона, он парамагнитен;
комплекс внешнеорбитальный, т.к. в образовании донорно-акцепторных связей принимают участие внешние 4d-АО (3d-АО внутренние орбитали). Использование внешних d-орбиталей требует затраты энергии, поэтому комплекс неустойчив.
б) [Co(NH3)6]3+ координационное число Co равно 6, степень окисления ()Сo = +3. Электронное строение NH3 таково, что каждая молекула имеет неподеленную электронную пару, за счет которой эта молекула будет донором. Так как комплекс диамагнитен, то все шесть d-электронов спарены, поэтому схему ВС для этого комплекса можно изобразить так:
![]()
Из этой диаграммы следуют выводы:
Co3+ акцептор 6-ти электронных пар;
АО (Co3+) гибридизованы по типу d2sp3 они образуют октаэдр;
комплекс диамагнитен, все электроны спарены;
комплекс внутриорбитальный, так как акцепторами являются внутренние 3d-атомные орбитали, он устойчивее, чем внешнеорбитальный.
Из приведенных примеров видны следующие особенности применения теории ВС к комплексам:
Для построения схемы ВС используются атомы и ионы с зарядом, соответствующим степени окисления.
Для образования химической связи не используются электроны центрального атома; используются лишь его пустые АО и электронные пары лигандов. (Однако возможен дополнительный учет дативного взаимодействия между парами d-электронов металла и пустыми (акцепторными) орбиталями лигандов).
Вопрос о расположении электронов на d-АО (и вопрос о магнитных свойствах) в теории ВС не решается, используются экспериментальные данные или данные других теорий (например, теория кристаллического поля ТКП).
В методе ВС вопросы геометрии комплекса, гибридизации АО, устойчивости решаются по схемам ВС.
