
- •Запорізька державна інженерна академія
- •1 Паливо
- •2 Горіння палив
- •3 Ентальпія димових газів
- •Ентальпія теоретичного об'єму повітря
- •Ентальпія теоретичного об'єму димових газів
- •Ентальпія дійсного об'єму димових газів
- •4 Контроль топкового процесу
- •5 Кінетика хімічних реакцій горіння
- •6 Кінетика ланцюгових реакцій
- •7 Займання газоповітряних сумішей
- •8 Поширення полум'я
- •9 Методи спалювання газа
- •10 Спалювання рідкого палива
- •11 Горіння твердого палива
- •12 Схеми організації топкового процесу
- •Перелік посилань
2 Горіння палив
2.1 Поняття про горіння палив
Горіння палива є окислювальним процесом, що протікає між горючими речовинами палива і окислювачем, яким найчастіше використовується кисень повітря. При розгляді процесів горіння приймаємо, що у склад повітря входять (об'ємних відсотків) 21 % O2 і 79 % N2 кисню і азоту відповідно.
Горіння палив протікає з великими швидкостями з виділенням величезної кількості теплоти, чим і відрізняється від окислювального процесу при гнитті органічних речовин.
Становлення науки про горіння пов'язане з розвитком хімії, фізики і фізичної хімії. У 1661 році Роберт Бойль пояснював горіння як передачу вогненної матерії випалюваному металу. На початку XVIII ст. М.В.Ломоносов показав, що в горінні бере участь повітря. У 1773 р. Лоран Лавуазье показав, що повітря складається з азоту, який не бере участь в горінні, і кисню, який з'єднується з речовиною в процесах горіння. З тих пір горіння отримало теоретичну основу, на базі якої розвивається в даний час.
Подальший розвиток науки про горіння пов'язаний з роботами Менделєєва, який створив методи розрахунку процесів горіння. У розвитку сучасної теорії горіння видне місце належить радянським ученим: Н.Н.Семенову, А.С. Предводітельову, Г.Ф. Кнорре, Л.Н. Хитріну.
Під керівництвом академіка Семенова Н.Н. розробляється теорія ланцюгових реакцій, теорія горіння і детонації газів. Кнорре Г.Ф плідно працював в області вивчення топкових процесів. Предводітельовим А.С. успішно велися роботи в області горіння вуглецю.
Не дивлячись на досвід в області горіння, питання горіння ще вимагають значного вивчення.
2.2 Основні стехіометричні рівняння повного і неповного горіння
Для забезпечення горіння палива необхідно витримати особливі умови, якими є:
- підтримка в зоні горіння високої температури;
- забезпечення безперервної подачі в зону горіння палива і повітря;
- забезпечення хорошого їх перемішування;
- організація безперервного відведення продуктів згорання із зони горіння.
У загальному випадку процес окислення горючих складових палива представляє складне явище, точний опис якого простими рівняннями не представляється можливим. Проте, основні величини, що цікавлять нас, такі як: необхідна кількість повітря, що бере участь в горінні; кількість продуктів згорання, що утворилися; кількість теплоти, що виділилася, можуть бути представлені стехіометричними рівняннями хімічних реакцій.
Стехіометричні рівняння є залежностями, що визначають окислення горючих складових палива киснем повітря.

При неповному згоранні:
![]()
![]() .
.
В
результаті горіння палива утворюються
об'єми вуглекислого газу
![]() сірчистого газу
сірчистого газу
![]() водяної пари
водяної пари
![]() ;
а оскільки окислення здійснюється
повітрям, то утворюється ще об'єм азоту
;
а оскільки окислення здійснюється
повітрям, то утворюється ще об'єм азоту
![]() Таким чином об'єм димових газів
визначається
Таким чином об'єм димових газів
визначається
![]() - при
повному згоранні;
- при
повному згоранні;
![]() - при
неповному згоранні.
- при
неповному згоранні.
Задачею
є звести
![]() до нуля.
до нуля.
![]() - об'єми
трьохатомних газів.
- об'єми
трьохатомних газів.
Теоретичні об'єми позначаються індексом «0», тобто
![]() -
при повному згоранні;
-
при повному згоранні;
![]() - при
неповному згоранні
- при
неповному згоранні
2.3 Визначення витрати повітря і виходу продуктів згорання
2.3.1 Визначення теоретичних об'ємів витрати повітря і виходу продуктів згорання при спалюванні кілограма твердого або рідкого палива
Визначення теоретичної витрати повітря відбувається на основі стехіометричних рівнянь горіння, написаних для одного кіломоля даної речовини.
1 кіломоль - це кількість речовини в кг, рівна його молекулярній масі.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Для
спалювання 1
кг
![]() витрачається:
витрачається:
![]() ;
;
![]() ;
;
![]() .
.
Таким
чином, для спалювання 1 кг
![]() потрібно було б
потрібно було б
![]() , а оскільки паливо містить
, а оскільки паливо містить
![]()
![]()
![]()
![]()
![]()
![]() ,то
для спалювання 1кг палива буде потрібна
наступна кількість кисню:
,то
для спалювання 1кг палива буде потрібна
наступна кількість кисню:
![]()
 ;
;
![]()
 .
.
Оскільки
в топку подається повітря, до складу
якого входить 21%,
![]() то
то
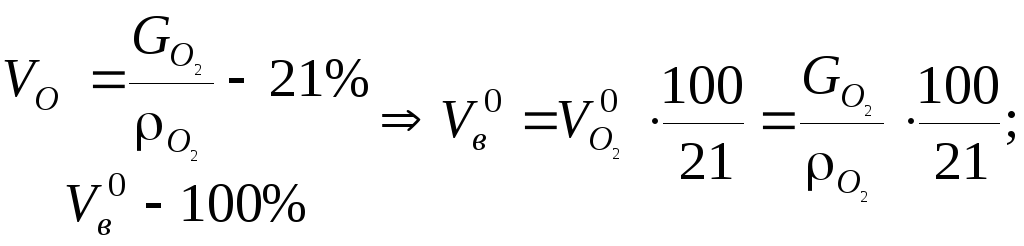


Якщо до складу палива входить кисень, то на окислення палива буде потрібно менше кисню, а, отже, і повітря. Тому для таких палив


Об'ємна
витрата повітря визначається щільністю
![]() ,
яка у свою чергу визначається температурою
і тиском по рівнянню стану
,
яка у свою чергу визначається температурою
і тиском по рівнянню стану
![]() .
У зв'язку з цим виходить безліч рішень.
Умовилися об'єм повітря визначати за
нормальних умов
.
У зв'язку з цим виходить безліч рішень.
Умовилися об'єм повітря визначати за
нормальних умов
![]() 760
760![]() У зв'язку з цим за нормальних умов
У зв'язку з цим за нормальних умов
![]()
![]() .Враховуючи
.Враховуючи
![]()
![]() ,
отримаємо наступну залежність за
визначенням теоретичної витрати повітря
,
отримаємо наступну залежність за
визначенням теоретичної витрати повітря
Тверде і рідке паливо:
![]()

Приклад.
1. Визначити теоретичний об'єм повітря необхідний для спалювання 1 кг твердого палива.
Паливо: вугілля кузнецького басейну.
Елементарний склад робочої маси палива занесений до таблиці 2.1
Таблиця 2.1 - Елементарний склад робочої маси палива, (%)
|
Wp |
Ap |
Spop |
Spk |
Cp |
Hp |
Np |
Op |
|
13,0 |
21,8 |
1,5 |
1,5 |
49,3 |
3,6 |
1,0 |
8,3 |
Теоретичний об'єм повітря
V0в=0.0889(Cp+0.375Spop+k)+0.265Hp-0.0333Op м3/кг
V0в=0.0889(49,3+0,375*3,0)+0,256*3,6-0,0333*8,3=5,16м3/кг
2. Визначити теоретичний об'єм повітря необхідний для спалювання 1 кг рідкого палива.
Паливо: мазут малосірчистий
Таблиця 2.2. - Елементарний склад робочої маси палива, (%)
|
Wp |
Ap |
Spop+k |
Cp |
Hp |
Np+Op |
|
3,0 |
0,05 |
0,3 |
84,65 |
11,7 |
0,3 |
Теоретичний об'єм повітря
Vов = 0,0889 (Ср + 0,375Spop+k) + 0,265Hp - 0,0333Op м3/кг
Vов = 0,0889 (84,65 + 0,375*0,3) + 0,256*11,7 – 0,0333*0,3 = 10,62 м3/кг.
2.3.2 Визначення теоретичних об'ємів витрати повітря і виходу продуктів згорання при спалюванні газоподібного палива
При
спалюванні газоподібного палива
теоретично необхідна кількість повітря
визначається з рівнянь реакцій горіння.
Наприклад,
![]() - показує, що для спалювання 1 об'єму
метану потрібно 2 об'єми кисню, внаслідок
чого виходить 1 об'єм вуглекислого газу
і 2 об'єми водяної пари.
- показує, що для спалювання 1 об'єму
метану потрібно 2 об'єми кисню, внаслідок
чого виходить 1 об'єм вуглекислого газу
і 2 об'єми водяної пари.
Проте при спалюванні газу використовується не чистий кисень, а повітря, до складу якого входить азот. Тоді рівняння горіння метану матиме вигляд:
![]()
де
![]()
Для етану:
![]() .
.
Якщо
вуглеводні виразити формулою
![]() ,
то:
,
то:
![]() .
.
В результаті отримуємо наступне підсумкове рівняння для визначення витрати повітря при горінні газу:
![]()
 .
.
Приклад.
Визначити теоретичний об'єм повітря необхідного для спалювання 1 м3 природного газу.
Паливо: природний газ газопроводу Саратов - Москва
Таблиця 2.3 - Елементарний склад робочої маси палива
|
CH4 |
C2H6 |
C3H8 |
C4H10 |
C5H12 |
N2 |
CO2 |
|
84,5 |
3,8 |
1,9 |
0,9 |
0,3 |
7,8 |
0,8 |
Теоретичний об'єм повітря
Vов = 0,0476[0,5СО+0,5Н2+1,2Н2S+ (m+n/4) CmHn-O2] м3/м3
Vов = 0,0476[ (1+4/4)*84,5 +(2+6/4)*3,8+(3+8/4)*1,9 +(4+10/4)*0,9+ +(5+12/4)*0,3] =9,52 м3/м3
2.4 Розрахунок теоретичних об'ємів продуктів згорання
Розрахунок теоретичних об'ємів продуктів згорання визначаться так само на підставі реакцій горіння. Так, ми бачимо, що
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() ,
где
,
где
![]()
![]()
Волога
з паливом: ;
![]() ;
;
![]()
 ;
;
де
![]() - вологовміст повітря, 10
- вологовміст повітря, 10![]()
![]() —теоретичний
об'єм повітря;
—теоретичний
об'єм повітря;
![]()
![]()
![]()
![]()
Волога дуття форсунки:
![]()
![]() .
.
Таким чином
![]()
![]()
 ;
;
де
![]() -
витрата пари на розпилювання мазуту
-
витрата пари на розпилювання мазуту
![]()
![]()
![]()
![]()
![]()
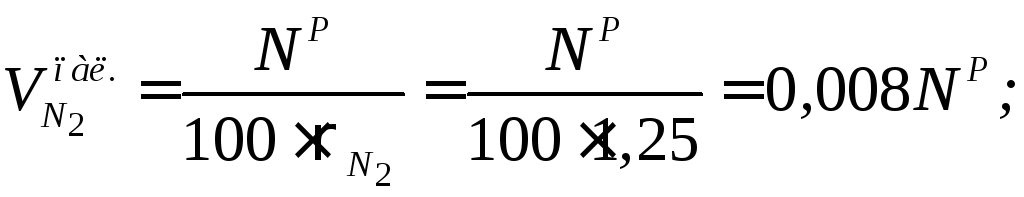
![]() тоді
тоді
![]()

![]()
При спалюванні газоподібного палива:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Приклади:
1 Теоретичний об'єм продуктів згорання: твердого палива
- об'єм азоту
VoN2=0,79Voв+0,8Np/100 м3/кг
VoN2=0,79*5,16+0,8*1,0/100=4,08м3/кг
- об'єм трьохатомних газів
VoRO2=0.01866(Cp+0.375Spop+k) м3/кг
VoRO2=0.01866(49,3+0,375*3,0)=0,94м3/кг
- об'єм водяної пари
VoH2O=0.111Hp+0.0124Wp+0.0161Voв м3/кг
VoH2O=0.111*3,6+0,0124*13,0+0,0161*5,16=0,64м3/кг
- об'єм димових газів
Voг=VoN2+VoR02+VoH2O м3/кг
Voг=4,08+0,94+0,64=5,67м3/кг
2 Теоретичний об'єм продуктів згорання: мазут
- об'єм азоту
VoN2=0.79Voв+0.8Np/100 м3/кг
VoN2=0.79*10,62 + 0,8*0,3/100 = 8,39 м3/кг
- об'єм трьохатомних газів
VoRO2=0.01866(Cp+0.375Spop+k) м3/кг
VoRO2 = 0.01866(84,65 + 0,375*0,3) = 1,58м3/кг
- об'єм водяної пари
VoH2O = 0.111Hp+0.0124Wp+0.0161Voв м3/кг
VoH2O = 0.111*11,7 + 0,0124*3 + 0,0161*10,62 = 1,51 м3/кг
- об'єм димових газів
Voг=VoN2+VoR02+VoH2O м3/кг
Voг = 8,39 + 1,58 + 1,51 = 11,48 м3/кг
3 Теоретичний об'єм продуктів згорання: природний газ
- об'єм азоту
VoN2 = 0.79Voв+Np/100 м3/м3
VoN2=0.79*9,96 + 7,8/100 = 7,6 м3/м3
- об'єм трьохатомних газів
VoRO2 = 0.01(CO2+CO+H2S+mCmHn) м3/м3
VoRO2 = 0.01(0,8+1*84,5+2*3,8+3*1,9+4*0,9+5*0,3) = 1.04м3/м3
- об'єм водяної пари
VoH2O = 0.01(H2S+H2+ n/2CmHn+ 0,124dг.тл)+0.0161Voв м3/м3,
де dг.тл - вологовміст газу, приймаємо dг.тл=1,9г/м3
VoH2O= 0,01*(4/2*84,5+6/2*3,8+8/2*1,9+10/2*0,9+12/2*0,3 + 0,124*1,9) + +0,0161*9,52 = 2,1 м3/м3
- об'єм димових газів
Voг=VoN2+VoR02+VoH2O м3/м3
Voг = 7,6 + 1,04 + 2,1 = 10,73 м3/м3
2.5 Розрахунок дійсної кількості повітря і продуктів згорання
Отримані
нами
![]() і
і
![]() є теоретичними об'ємами, оскільки
визначені на підставі стехіометричних
рівнянь горіння.
є теоретичними об'ємами, оскільки
визначені на підставі стехіометричних
рівнянь горіння.
Як
показала практика спалювання палива,
подані в топку такі кількості повітря,
є недостатніми, тому в топку подають
повітря дещо більше, а реально поданий
об'єм називається дійсним і позначається
![]() .
.
Дійсний
об'єм повітря відрізняється від
теоретичного коефіцієнтом
надлишку повітря
![]() ,
який є відношенням дійсно поданого в
топку повітря до теоретично необхідного:
,
який є відношенням дійсно поданого в
топку повітря до теоретично необхідного:
![]()
![]() визначається
видом спалюваного палива та видом
топкового пристрою. Так, для спалювання
газу і мазуту
визначається
видом спалюваного палива та видом
топкового пристрою. Так, для спалювання
газу і мазуту
![]() ;
а для твердого палива при факельному
спалюванні
;
а для твердого палива при факельному
спалюванні
![]() ;
при шаровому спалюванні
;
при шаровому спалюванні
![]() .
.
При
відомому
![]() дійсна кількість поданого в топку
повітря
дійсна кількість поданого в топку
повітря
![]()
 (н.у.)
(н.у.)
Якщо
спалюється
![]()
![]()
![]() палива, то загальна кількість поданого
за нормальних умов повітря визначається:
палива, то загальна кількість поданого
за нормальних умов повітря визначається:
![]()
![]() (н.у.)
(н.у.)
2.6 Визначення дійсного об'єму димових газів
Дійсний
об'єм димових газів визначається при
![]() .
У зв'язку з тим, що в топку подається
більше повітря, змінюється склад димових
газів на величину надлишкового повітря,
поданого в топку
.
У зв'язку з тим, що в топку подається
більше повітря, змінюється склад димових
газів на величину надлишкового повітря,
поданого в топку
![]()
![]()
![]()
![]()
![]()
![]()
При
![]()
![]()
![]()
![]()

![]()

Зазвичай
газовий тракт котла працює під
розрідженням, у зв'язку з цим
![]() змінюється по газоходах. Присос повітря
в топку складає 5% від
змінюється по газоходах. Присос повітря
в топку складає 5% від
![]() :
:![]() .
У газоходах котла при розміщенні в них
змієвикових поверхонь нагріву величина
присосів складає
.
У газоходах котла при розміщенні в них
змієвикових поверхонь нагріву величина
присосів складає
![]() і в трубчастих повітропідігрівачах
і в трубчастих повітропідігрівачах
![]() приймається при розрахунках. Коефіцієнт
присоса повітря за поверхнею нагріву
визначається сумою коефіцієнта присоса
повітря перед поверхнею нагріву і
коефіцієнта присосів в ній, як показано
на рисунку 2.1
приймається при розрахунках. Коефіцієнт
присоса повітря за поверхнею нагріву
визначається сумою коефіцієнта присоса
повітря перед поверхнею нагріву і
коефіцієнта присосів в ній, як показано
на рисунку 2.1

![]()
![]()
![]()
![]()
Рисунок 2.1
![]()
Середні
об'єми повітря і продуктів згорання
розраховуються по середньому коефіцієнту
![]() .
.
Зазвичай
для камерних топок котлів
![]() призначається по нормах теплового
розрахунку на виході з топки
призначається по нормах теплового
розрахунку на виході з топки
![]() (перед фестоном), тоді коефіцієнт надлишку
повітря на вході в топку визначається
по формулі:
(перед фестоном), тоді коефіцієнт надлишку
повітря на вході в топку визначається
по формулі:
![]() .
.
Середні значення коефіцієнтів надлишку повітря по інших поверхнях нагріву визначаються аналогічно. Зрештою отримуємо:
![]() .
.
Розрахунки
дійсних об'ємів продуктів згорання
здійснюються для вибраної по рекомендаціях
![]() і присосів холодного повітря
і присосів холодного повітря
![]() в окремих ділянках газового тракту
котла.
в окремих ділянках газового тракту
котла.
