
- •Титульный лист Оглавление
- •Список вопросов на экзамен на бакалавра
- •Тмп и физ. Химия
- •Металлургия цветных металлов
- •Качественная схема обогащения руды
- •Украинский деловой язык
- •Пояснювальна записка
- •Стандартизация и метрология
- •Экономика
- •Охрана труда и безопасность жизнедеятельности
- •Вопрос 10: Категории помещений по пожарной и взрывопожарной опасности.
- •Вопрос 11: Защита от вибрации. Защита от общей и локальной вибрации.
- •Вопрос 13. Защита от тепловых воздействий: теплоизоляция, экранирование, другие способы.
- •Вопрос 14.Защита от электрического тока: защита от прикосновения к токоведущим частям, заземление, зануление, сиз.
- •Вопрос 15. Искусственное освещение, его виды, системы, нормирование.
- •Вопрос 16. Вентиляция. Ее назначения, виды.
- •Вопрос 17. Воздушная среда. Микроклимат и чистота воздуха.
- •Вопрос 18. Технические нормативы: конструктивные, габаритно – планировочные, параметрические.
- •Вопрос 19. Гигиенические нормативы. Санитарные нормы.
- •Вопрос 20. Проведение работ. Система допусков, когда применяется, что включает в себя.
- •Вопрос 21. Классификация методов охраны труда. Организационные, санитарные, технические методы, индивидуальная защита.
- •Вопрос 22. Вредные и опасные факторы производства. Последствия
- •Вопрос 23. Дать определение инженерной охране труда. Основные определения. Несчастные случаи, травмы, увечья, проф. Заболевания.
- •Вопрос 24. Требования охраны труда к территории предприятия. Санитарно-защитная зона. Ее размеры для различных классов предприятия.
- •Вопрос 25. Нервная система как система защиты от опасности. Анализаторы: зрительный, слуховой, тактильный.
- •Металлургия чёрных металлов
- •Вопрос № 2. Методы загрузки доменной печи.
- •История Украины Вопрос № 1. Происхождение славян.
- •Вопрос № 1. Культура Киевской Руси.
- •Основы экономической теории
- •Задания
- •Тема: Термодинамические свойства индивидуальных веществ
- •Варианты заданий:
- •Тема: Тепловой эффект химических реакций.
- •Тема: Расчет константы химического равновесия и равновесного состава газовой фазы
- •Варианты химических реакций и температур, в результате протекания которых достигаются равновесные состояния
- •Тема: Термодинамика реакций восстановления оксидов металлов газами со и н2
- •Варианты заданий
- •Тема: Диаграммы фазовых равновесий в двухкомпонентных системах
Варианты химических реакций и температур, в результате протекания которых достигаются равновесные состояния
|
Т=900 К |
Т=1200 К |
Реакция |
|
3.1 |
3.6 |
Fe3O4 + CO = 3FeO + CO2 |
|
3.2 |
3.7 |
PbS + O2 = Pb + SO2 |
|
3.3 |
3.8 |
C + CO2 = 2CO |
|
3.4 |
3.9 |
C + 2H2 = CH4 (газ) |
|
3.5 |
3.10 |
1/3Sb2S3 (тв.) + H2 = 2/3Sb(тв) + H2S |
Для заданного варианта вычислить равновесный состав газовой фазы в объемных %. Общее давление в реакционном пространстве поддерживается постоянным и равным Р = 1атм.
ЗАДАНИЕ 4
Тема: Термодинамика реакций восстановления оксидов металлов газами со и н2
Газы СО и Н2 , а также смеси СО - СО2 (Н2 - Н2О) широко используются при восстановлении мало- и среднепрочных оксидов. При выборе состава восстановительной газовой смеси необходимо знать состав равновесной. Например, в случае среднепрочных оксидов равновесная кривая реакции:
МеО + СО = Ме + СО2 (1)
имеет вид
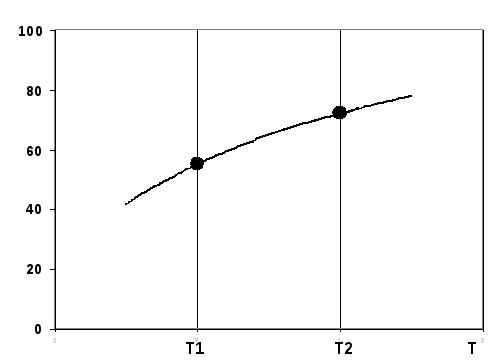
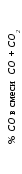
Точки 1 и 2 соответствуют равновесным газовым смесям при температурах Т1 и Т2. Рассчитываются составы равновесных газовых смесей из уравнений:
![]() (2)
(2)
![]() (3)
(3)
В случае одинаковости стехиометрических коэффициентов перед СО и СО2:
![]() (4)
(4)
Величину
![]() находим одним из следующих методов: как
разность энтальпий и энтропий веществ
участников реакции при заданной
температуре; энтропийным методом: на
основе уравнений с использованием
первого, второго приведенных потенциалов
или с использованием полной энтальпии;
на основе графика зависимости
находим одним из следующих методов: как
разность энтальпий и энтропий веществ
участников реакции при заданной
температуре; энтропийным методом: на
основе уравнений с использованием
первого, второго приведенных потенциалов
или с использованием полной энтальпии;
на основе графика зависимости![]() реакций образования оксидов или с
помощью табличных данных о значениях
реакций образования оксидов или с
помощью табличных данных о значениях![]() для разных температур.
для разных температур.
Вычислив константу равновесия определяем %СО и %СО2 (или %Н2 и %Н2О) в равновесной газовой фазе. Имеем при этом ввиду, что :
(%СО + %СО2) = 100%
(%Н2 + %Н2О) = 100%
Варианты заданий
|
Вариант |
Реакция |
Температура, К | ||
|
Т1, К |
Т2, К |
Т1 |
Т2 | |
|
4.1 |
4.6 |
PbO + CO = Pb + CO2 |
800 |
1000 |
|
4.2 |
4.7 |
Ni + CO = Ni + CO2 |
800 |
1000 |
|
4.3 |
4.8 |
Fe3O4 + CO = 3FeO + CO2 |
1000 |
1700 |
|
4.4 |
4.9 |
FeO + CO = Fe + CO2 |
1000 |
1700 |
|
4.5 |
4.10 |
MnO + CO = Mn + CO2 |
1100 |
1300 |
Для заданного варианта:
Выбрать самостоятельно метод расчета величины
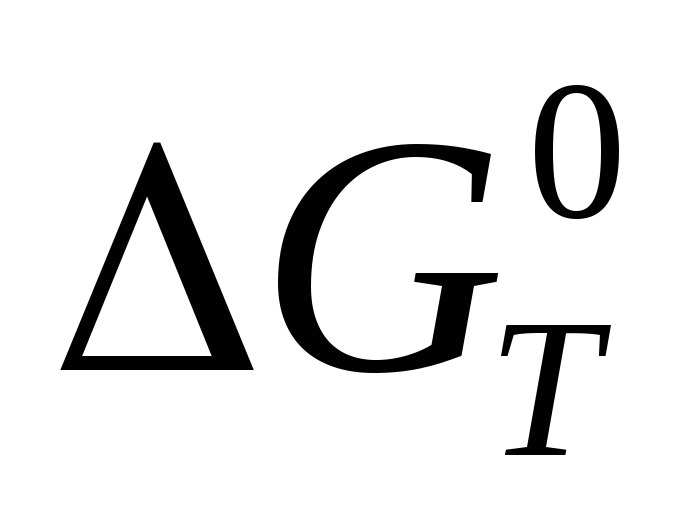 для заданной реакции и температуры;
для заданной реакции и температуры;Рассчитать константу равновесия и равновесные концентрации;
Выбрать состав восстановительной газовой смеси и рассчитать количество восстановленного оксида и полученного металла. Объем восстановительной газовой смеси 1м3, общее давление Р = 1атм.
ЗАДАНИЕ 5
Тема: Диаграммы фазовых равновесий в двухкомпонентных системах
Исходный состав и температура двухкомпонентного раствора заданы на диаграмме состояния соответствующей точкой. Масса раствора 30 кг.
|
№ п/п |
Диаграмма состояния |
Вариант (точка на диаграмме) | ||
|
1 |
Al - Si |
1 |
2 |
- |
|
2 |
SiO2 - FeO |
1 |
2 |
3 |
|
3 |
SiO2 - Al2O3 |
1 |
2 |
3 |
|
4 |
Zn - Pb |
1 |
2 |
- |
Выполнить следующее:
1 Охарактеризовать агрегатное состояние раствора, его состав в вес. % и температуру. Выразить состав раствора в мольных долях (мольных %);
2 Описать все фазовые изменения и равновесия при понижении температуры раствора от исходной до наинизшей на диаграмме состояния.
Для изотермических выдержек (Ті), показанных на диаграмме, и, имеющих отношение к заданному раствору, указать составы фаз, находящихся в равновесии. Определить с помощью правила отрезков (правила «рычага») массу находящихся в равновесии фаз.
3 Для одной изотермической выдержки выполнить расчет материального баланса: определить вначале массу каждого компонента в исходном растворе, затем в обеих равновесных фазах и проверить на основании расчетов сохранение массы веществ после понижения температуры от исходной до принятой в расчетах.
4 Укажите каким будет фазовый состав системы по завершении охлаждения
