
fcf04e01_an_himiya_dlya_zaochnikov
.pdf
рН = –lg[Н+] = 2,79.
Рассчитаем концентрации муравьиной кислоты и формиата натрия после смешивания растворов:
с(HCOOH ) |
0,015 20 |
0,0067моль / л |
|
|
20 25 |
|
|||
|
|
|
||
с(HCOONa ) |
25 0,01 |
0,0055моль / л |
|
|
20 25 |
|
|||
|
|
|
|
|
При добавлении формиата натрия диссоциация муравьиной кислоты по- |
||||
давлена, следовательно [HCOO–]=c(HCOONa)=0,0055 моль/л |
||||
H Ka HCOOH |
1,77 10 4 0,0067 |
2,16 10 4 моль / л |
||
|
||||
HCOO |
0,0055 |
|
||
рН=3,67.
При добавлении формиата натрия рН раствора повышается за счет подавления диссоциации муравьиной кислоты в присутствии одноименного иона.
Тема III. Протолитические равновесия в растворах солей. Степень и константа гидролиза. Расчет рН в растворах гидролизующихся солей.
В водных растворах соли, содержащие катионы слабых оснований, и анионы слабых кислот подвергаются гидролизу, то есть взаимодействуют с протонами или гидроксильными группами нейтральных молекул воды. В растворах устанавливается гидролитическое равновесие, которое характеризуется константой гидролиза (Кh). При изучении этой темы необходимо обратить внимание на правильное написание уравнений реакций гидролиза в ионном виде и выражение константы гидролиза. Уметь выводить расчетные формулы степени гидролиза (h) и рН растворов гидролизующихся солей, знать факторы, влияющие на гидролиз.
Пример 1. Вычислить [H+] и pH 0,005 M NH4NO3, а также степень и константу гидролиза NH4NO3.
Решение: Составляем уравнение реакции гидролиза:
NH4+ + H2O = NH4OH + H+.
Рассчитываем концентрацию H+-ионов по формуле:
H |
|
|
KH2O Cс |
|
;K |
|
|
1,76 10 5 . |
|
|
||||
|
|
|
в |
|
|
|||||||||
|
|
|
|
K |
|
|
|
|
|
|
|
|||
|
|
|
|
в |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||||||
H |
|
10 14 |
5 10 3 |
|
|
|
|
|||||||
|
|
2,84 10 12 |
1,69 10 6 моль / л |
|||||||||||
|
|
1,76 10 5 |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|||||
pH lg1,69 10 6 5,77. |
|
H |
||||||||||||
Степень гидролиза h рассчитываем по формуле: h |
||||||||||||||
Cсоли |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
h |
1,69 10 6 |
3,37 10 4 . |
|
|
||||||||||
5 |
10 3 |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|||||
11

Константу гидролиза Кг |
рассчитываем по формуле: Кг |
КH O |
|||||||
2 |
|||||||||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
Кв |
|
К |
|
|
|
10 14 |
5,68 10 10 . |
|
|||
г |
1,76 |
10 5 |
|
||||||
|
|
|
|
|
|||||
|
|
|
|
|
|
||||
Тема IV. Гетерогенные равновесия в аналитической химии. Произведение растворимости (константа растворимости). Условия образования осадков. Влияние на полноту осаждения одноименного иона, рН раствора, постороннего электролита («солевой эффект»).
Гетерогенные равновесия устанавливаются на границе раздела фаз (осадок – насыщенный раствор над осадком). Данное равновесие характеризует константа растворимости (Ks) или произведение растворимости (ПР). Используя значения ПР (Ks) необходимо уметь рассчитывать молярные (моль/л) и массовые (г/л) концентрации ионов в растворе малорастворимого соединения в воде и в присутствии одноименных ионов. Следует знать условие образования осадков и уметь решать вопрос о возможности их образования при смешивании растворов.
Пример 1. Рассчитать молярную (моль/л) и массовую (г/л) растворимость сульфата кальция, если ПP(CaSO4)=2,5·10–5.
Решение:
Запишем равновесие в рассматриваемой системе:
CaSO4→Са2+ + SO42–.
Обозначим молярную концентрацию соли в насыщенном растворе (растворимость) – s (моль/л), тогда [Са2+] = [SO42–] = s.
Запишем выражение ПР:
ПР=[Са2+][SO42–] = s2, s 
 ПР
ПР 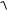
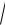 2,5 10 5 5 10 3 моль / л .
2,5 10 5 5 10 3 моль / л .
Массовая растворимость сульфата кальция будет равна:
S(г/л)=s(моль/л)·M(CaSO4)=5·10–3·136=0,68 г/л.
Пример 2.
Смешали 500 мл 0,002 М раствора хлорида бария и 500 мл 0,001 М раствора сульфата калия. Выпадет ли в этих условиях осадок сульфата бария?
ПР(BaSO4)=1,1·10–10.
Решение: Условие образования осадков: произведение концентрации ио-
нов должно быть больше произведения растворимости ПКИ>ПР.
ПКИ = с(Ва2+)·c(SO42–).
При смешивании равных объемов растворов, концентрации ионов
уменьшаются в 2 раза, следовательно: [Ва2+] = с(ВаСl2) = 0,001 моль/л
[SO42–] = c(K2SO4)=0,0005 моль/л
ПКИ = 0,001·0,0005 = 5·10–7, ПКИ>ПР, осадок выпадает.
Пример 3. Рассчитать растворимость фосфата серебра в 0,02 М растворе фосфата натрия. ПР(Ag3PO4) = 1,3·10–20.
12

Решение: Запишем уравнения равновесий для данной системы:
Ag3PO4 ↔ 3Ag+ + PO43–
Na3PO4 → 3Na+ + PO43– ПР(Ag3PO4) = [Ag+]3[PO43–].
Обозначим растворимость фосфата серебра в насыщенном растворе через s, тогда [Ag+]=3s, в присутствии одноименного иона растворимость фосфата серебра понижается, поэтому равновесная концентрация фосфат-иона будет определяться концентрацией фосфата натрия [PO43–]=c(Na3PO4)=0,02 моль/л. Подставим эти обозначения в выражение ПР:
ПP(Ag3PO4) = s3·c(Na3PO4)
|
|
|
|
|
|
|
|
|
|
1,3 10 20 |
|
|
|
||
|
|
ПР(Ag |
3 |
PO |
4 |
) |
|
|
20 |
|
|||||
s 3 |
|
|
|
|
|
3 |
|
|
|
4,16 10 |
моль / л . |
||||
|
|
|
|
|
|
|
|
||||||||
|
|
9 |
c(Na3PO4 ) |
|
|
|
9 0,02 |
|
|
||||||
Тема V. Равновесия в растворах комплексных соединений. Константы устойчивости и нестойкости. Влияние избытка лиганда, разрушение комплексных соединений.
В водных растворах комплексных соединений устанавливается равновесие, которое характеризуется константой устойчивости (Куст.) или величиной, обратной ей, константой нестойкости (Кн). Пользуясь величиной соответствующей константы, необходимо уметь рассчитывать равновесные концентрации ионов в растворе комплексных соединений в присутствии избытка лиганда и без избытка лиганда. Следует знать способы разрушения комплексов и уметь проводить расчеты, связанные с разрушением комплексов за счет образования малорастворимых соединений.
Пример 1. Рассчитать равновесную концентрацию ионов Zn2+ в 1 М рас-
творе [Zn(NH3)4]Cl2lgКуст. = 8,7.
Решение:
[Zn(HN3)4]Cl2→[Zn(HN3)4]2+ + 2Cl– |
||
[Zn(HN3)4]↔ Zn2+ + 4NH3 |
||
Zn(NH3 )4 2 |
||
К уст. Zn 2 NH |
3 |
4 |
|
|
|
Куст. = 108,7 = 2,0·109.
Обозначим [Zn2+]=x моль/л, тогда [NH3]=4x моль/л. Величина х<<1, ею можно пренебречь, поэтому равновесная концентрация [Zn(NH3)4]2+ = c([Zn(NH3)4]2+) = 1 моль/л. Подставим равновесные концентрации ионов в выражение константы устойчивости:
2 109 |
|
1 |
|
|
|
1 |
|
|
|||
|
|
|
|
|
|
||||||
x (4x) |
4 |
|
256x |
5 |
|
||||||
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
x 5 |
|
|
1 |
|
|
7,2 10 3 моль / л . |
|||||
|
|
|
|
|
|||||||
2 109 256 |
|||||||||||
|
|
|
|
|
|
||||||
13
Пример 2. Будет ли выпадать осадок оксалата цинка при добавлении к 0,001 М раствору [Zn(NH3)4]2+ 0,1 моль/л оксалата натрия, если равновесная
концентрация аммиака в растворе составляет 0,1 моль/л?
ПР(ZnC2O4) = 2,75·10–8, Куст.([Zn(NH3)4]2+) = 2,0·109
Решение: Осадок будет образовываться, если выполняется условие:
ПКИ>ПР
ПКИ = с(Zn2+) с(CO2O42–)
c(CO2O42–) = c(Na2C2O4) = 0,1 моль/л.
Равновесную концентрацию ионов цинка рассчитаем из константы устой-
чивости аммиакатного комплекса цинка [Zn(NH3)4]2+↔Zn2+ + 4NH3 |
||||
К уст. |
Zn(NH3 )4 2 |
|
||
Zn 2 NH |
3 |
4 |
||
|
|
|
|
|
В растворе присутствует избыток аммиака, следовательно, равновесие |
||||
сдвинуто в сторону образования комплекса, диссоциация комплекса подавлена
[NH3] = 0,1 моль/л.
Zn 2 |
Zn NH |
3 |
|
2 |
|
0,001 |
5 |
10 9 моль / л |
|
|
4 |
|
|
||||||
К уст. NH3 |
4 |
2,0 109 0,14 |
|||||||
|
|
|
|
||||||
ПКИ = 0,1·5·10–9 = 5·10–10
ПКИ<ПР, осадок в данных условиях не образуется.
Тема VI. Окислительно-восстановительные системы. Стандартный и реальный окислительно-восстановительные потенциалы. Уравнение Нернста. Влияние рН комплексообразования и осаждения на величину окислительно-восстановительного потенциала. Направление, последовательность протекания и константа равновесия окислительновосстановительных реакций.
Количественной характеристикой окислительно-восстановительной способности редокс-пары являются значения стандартного и реального окисли- тельно-восстановительного потенциала. Реальный окислительновосстановительный потенциал рассчитывается по уравнению Нернста. При изучении этой темы следует обратить внимание на правильное написание уравнения Нернста для различных случаев окислительно-восстановительных систем: с участием твердых веществ, с участием ионов водорода и гидроксидионов и т.д., а также на расчет потенциала с учетом равновесных концентраций. Уравнения окислительно-восстановительных реакций необходимо составлять электронно-ионным методом. Молекулярные уравнения составлять не следует. На основании стандартных окислительно-восстановительных потенциалов уметь определять направление протекания реакций. Обратить особое внимание, как меняется величина потенциала системы при образовании комплексного и малорастворимого соединения.
14
Пример 1. Составить уравнение реакции между перманганат-ионом и пероксидом водорода в кислой среде электронно-ионным методом и записать уравнения Нернста для окислительно-восстановительных систем.
Решение: |
|
|
MnO4– + 8H+ + 5e → Mn2+ + H2O |
x2 |
|
Н2О2 – 2е → O2 + 2H+ |
|
x5 |
|
|
|
2МnО4– + 5Н2О2 + 6H+ → 2Mn2+ + 5О2 + 8Н2О
Составляем уравнения Нернста для окислительно-восстановительных
систем: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
MnO |
|
H 8 |
|
|
|
|
|
|
0 |
|
|
|
|
|
0,059 |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
EMnO4 / Mn2 EMnO4 / Mn2 |
|
|
|
|
lg |
|
|
|||||||||||
|
5 |
|
Mn 2 |
|||||||||||||||
E |
|
|
|
E0 |
|
|
|
0,059 |
|
lg |
|
H 2 |
|
|
|
|||
O / H O |
|
|
|
|
|
|
|
H2O2 |
|
|
||||||||
|
|
O / H O |
|
|
2 |
|
|
|
|
|
|
|||||||
|
2 |
2 |
2 |
2 |
2 |
2 |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Пример 2. Можно ли в кислой среде действием дихромата калия окислить: a) Fe2+ до Fe3+; б) Мn2+ до МnО4–?
Решение: Для решения вопроса необходимо сравнить стандартные окис- лительно-восстановительные потенциалы окислительно-восстановительных систем. Более сильным окислителем будет окисленная форма той системы, стандартный окислительно-восстановительный потенциал которой больше.
E0 |
|
/ Cr 3 |
1,33в |
Cr O 2 |
|
||
2 |
7 |
|
|
E0Fe3 / Fe2 0,77в E0MnO4 / Mn2 1,51в
Потенциал системы Cr2O72–/Cr3+, больше, чем потенциал системы Fe3+/Fe2+ и меньше, чем потенциал системы МnО4–/Мn2+, следовательно, Fe2+ можно окислить до Fe3+ действием дихромата калия, а Мn2+ до МnО4– не окисляется.
15
5. КОНТРОЛЬНЫЕ ЗАДАНИЯ по теме: «Теоретические основы аналитической химии и качественный анализ»
(контрольная работа № 1)
1.По каким принципам объединяют вещества в аналитические группы? Групповые реагенты и группы катионов в кислотно-основном методе анализа.
2.Составьте схемы дробного и систематического анализа смеси катионов: Pb2+, Al3+, Fe3+, Ni2+. Напишите уравнения реакций обнаружения этих катионов (в молекулярной и ионной формах).
3.Можно ли действием дихромата калия в кислой среде окислить Fe2+ до Fe3+, AsО33– до AsО43–, Мn2+ до МnО4–, SО32– до SО42–, SО42– до S2О82–. Написать уравнения протекающих реакций с помощью электронно-ионного метода.
4.Составьте схемы дробного и систематического анализа смеси катионов: NH4+, Ca2+, Mn2+. Напишите уравнения реакций обнаружения этих катионов (в молекулярной и ионной формах).
5.Составьте схемы дробного и систематического анализа смеси катионов: Ag+, Cu2+, Fe3+. Напишите уравнения реакций обнаружения этих катионов (в молекулярной и ионной формах).
6.К раствору, содержащему ионы AsО33– и SО32–, в кислой среде добавили пероксид водорода. Какой из этих анионов будет окисляться в первую очередь? Написать реакции окисления-восстановления и уравнять их электронноионным методом.
7.Составьте уравнения окислительно-восстановительных реакций элек- тронно-ионным методом, если на раствор, содержащий ион марганца (II), подействовали: а) висмутатом натрия в присутствии азотной кислоты, б) пероксидисульфатом аммония, в) оксидом свинца (IV).
8.Смесь сухих солей: нитрат ртути (I), хлорид хрома (III), нитрат цинка растворили в воде. Какие соединения будут в осадке, какие ионы будут в растворе? Составьте схему анализа, уравнения реакций в ионном виде для разделения, растворения образующихся осадков и обнаружения присутствующих в растворе катионов.
9.Составьте уравнения реакций в ионном виде, происходящие при действии иодида калия на раствор, содержащий: a) Bi(NO3)3, б) CuCl2, в) Na2HAsO4.
10.Смесь сухих солей: нитрат серебра, нитрат ртути (П), хлорид хрома (III), нитрат марганца (II), нитрат свинца растворили в воде. Какие соединения будут в осадке, какие ионы будут в растворе? Составьте схему хода анализа, уравнения реакций в ионном виде для разделения, растворения образующихся осадков и обнаружения присутствующих в смеси катионов.
11.Смесь сухих солей: нитрат серебра, хлорид бария, нитрат хрома (III), хлорид сурьмы (III) растворили в воде. Какие соединения будут в осадке, какие ионы будут в растворе? Составьте схему анализа, уравнения реакций в ионном виде для разделения, растворения образующихся осадков и обнаружения присутствующих в смеси катионов.
12.Составьте уравнения окислительно-восстановительных реакций элек- тронно-ионным методом, если на раствор, содержащий а) ионы Cr3+, подейст-
16
вовать пероксидом водорода в щелочной среде, б) ионы Cr2O72–, подействовать пероксидом водорода в кислой среде.
13.Смесь сухих солей: сульфат калия (недостаток), хлорид аммония, нитрат стронция, хлорид кальция, хлорид бария растворили в воде. Какие соединения будут в осадке, какие ионы будут в растворе? Составьте схему хода анализа, уравнения реакций в ионном виде разделения, растворения образующихся осадков и обнаружения присутствующих в смеси катионов.
14.Смесь сухих солей: сульфат калия, хлорид аммония, нитрат стронция, хлорид кальция, хлорид бария растворили в воде. Какие соединения будут в осадке, какие ионы будут в растворе? Составьте схему хода анализа, уравнения реакций в ионном виде разделения, растворения образующихся осадков и обнаружения присутствующих в смеси катионов.
15.Составьте уравнения реакций в ионном виде, если на раствор, содержащий ионы Pb2+, Sn2+, Al3+, Zn2+, Cd2+, подействовали: а) избытком гидроксида натрия, б) избытком раствора аммиака.
16.Смесь сухих солей: карбонат калия, хлорид хрома (III), хлорид железа (III), нитрат меди (II) растворили в воде. Какие соединения будут в осадке, какие ионы будут в растворе? Составьте схему анализа, уравнения реакций в ионном виде разделения, растворения образующихся осадков и обнаружения присутствующих в смеси катионов и анионов.
17.Составьте уравнения окислительно-восстановительных реакций элек- тронно-ионным методом, если на раствор, содержащий ионы хрома (III), подействовали: а) раствором перманганата калия в кислой среде, б) бромом в щелочной среде.
18.Смесь сухих солей: хлорид сурьмы (III), нитрат висмута, нитрат свинца (II), хлорид марганца (II), хлорид меди (II) растворили в воде. Какие соединения будут в осадке, какие ионы будут в растворе? Составьте схему хода анализа и уравнения реакций в ионном виде разделения, растворения образующихся осадков и обнаружения присутствующих в смеси катионов.
19.Рассчитать константу гидролиза, степень гидролиза и рН в 0,09 M растворе бромида аммония. Выведите формулы для расчета.
20.Рассчитайте равновесные концентрации ионов железа (III) и фторидионов в водном растворе, содержащем комплекс К3[FeF6] с концентрацией 0,1
моль/л. Полная константа нестойкости комплексного аниона [FeF6]3– равна
10–16,1.
Ответ: [Fe3+]=7,76·10–4 моль/л; [Fe–]=4,66·10–3 моль/л.
21. Рассчитайте концентрационные константы устойчивости и нестойкости КН комплексного аниона [PbJ4]2–, если в водном 1,0 моль/л растворе ком-
плекса К2[PbJ4] равновесные концентрации ионов свинца (II) и иодид ионов равны: [Pb2+] = 0,054 моль/л, [J–] = 0,216 моль/л.
Ответ: =8,51·103, КН=1,18·10–4.
22.В 12 л воды растворили 0,01 г бромида калия и прибавили 1 мл 0,1 М раствора нитрата серебра. Будет ли образовываться осадок бромида серебра?
23.Рассчитать молярную растворимость (моль/л) и массовую растворимость (г/л) фосфата бария в 0,025 М растворе фосфата натрия.
17
24.Образуется ли осадок сульфата свинца, если к насыщенному раствору хлорида свинца прибавить равный объем 0,2 М раствора серной кислоты.
25.Выпадет ли осадок сульфата бария, если смешать 0,15 мл 0,1 М раствора сульфата натрия и 2 мл 0,001 М раствора хлорида бария?
26.Рассчитать сколько молей серебра находится в 500 мл насыщенного раствора хромата серебра.
27.Рассчитать молярную (моль/л) и массовую (г/л) растворимость сульфата кальция.
28.Рассчитать растворимость фосфата серебра в 0,05 М растворе нитрата
калия.
29.Рассчитайте рН водного раствора, содержащего в 1 л 3,0 г ортоборной
кислоты H3BO3. Константа диссоциации этой кислоты по первой ступени KI =
7,1·10–10; pKI = 9,15.
Ответ: рН = 5,23.
30.Рассчитайте ионную силу растворов, содержащих в 1 л: а) 0,01 моль
калия хлорида КСl; б) 0,01 моль железа (III) FeCl3; в) 0,01 моль алюминия сульфата Al2(SO4)3.
Ответ: 0,01; 0,06; 0,15.
31.Рассчитайте ионную cилу водного раствора, содержащего в 1 л по 0,05
моль стронция нитрата Sr(NO3)2, калия хлорида KCl и уксусной кислоты
CH3COOH.
Ответ: 0,2.
32.Сколько граммов хлорида аммония нужно прибавить к 500 мл 0,137 М раствора гидроксида натрия, чтобы получить раствор с рН 10,3?
33.Чему равна концентрация ионов водорода в 0,05 М растворе бензойной кислоты? Во сколько раз присутствие 0,1 М бензоата натрия понижает эту концентрацию?
34.При какой концентрации сульфид-иона начнется выпадение осадка сульфида кадмия из раствора, содержащего 0,05 моль/л [Cd(CN)4]2– и 0,1 моль/л цианида калия.
35.Рассчитать концентрацию бромид-ионов в 0,002 М растворе аммиачного комплекса серебра [Ag(NH3)2]+, содержащем 0,005 моль/л аммиака, которую надо создать, чтобы образовался осадок бромида серебра.
36.Буферный раствор содержит 0,5 моль/л гидроксида аммония и 0,25 моль/л нитрата аммония. Рассчитать рН раствора. Как изменится рН этого раствора при добавлении к 1 л а) 0,2 моль хлороводородной кислоты, б) 0,25 моль гидроксида натрия?
37.Вычислите константы устойчивости и нестойкости КН комплексного катиона [Co(NH3)6]3+ в водном растворе, если равновесные концентрации реагентов в этом растворе равны: [Co(NH3)6]3+=0,10, [Co3+]=1,5·10–6, [NH3]=9,0·10–6
моль/л. Ответ: =1,3·1035, КН=7,7·10–36.
38.Образуется ли осадок сульфата стронция, если к 02 М раствору хлорида стронция прибавить равный объем сульфата кальция?
39.Определите объем 25, 10,%-го водного раствора гидроксида натрия, необходимого для растворения 9,94 г гидроксида цинка Zn(OH)2. Плотность
18
указанного раствора гидроксида натрия равна 1,275 г/мл при температуре 200 С. Ответ: 25 мл.
40.Выясните, образуется ли осадок иодида серебра AgJ, если к водному
раствору комплекса [Ag(NH3)2]NO3 с концентрацией 0,2 моль/л прибавить равный объем 0,2 моль/л водного раствора иодида натрия NaJ. Полная константа
нестойкости комплексного катиона [Ag(NH3)2]+=10–7,23. Произведение растворимости иодида серебра = 8,3·10–17.
Ответ: образуется.
41.Определите, как изменится равновесная концентрация ионов цинка в 1,0 моль/л водном растворе комплекса Na2[Zn(OH)4], если рН раствора увели-
чить от 11 до 12. Полная константа нестойкости комплексного аниона равна
10–14.
Ответ: уменьшится в 104 раз.
42. Рассчитайте равновесную концентрацию ионов алюминия в 1,0 моль/л водном растворе комплекса Na[Al(OH)4] при рН=11. Полная константа нестой-
кости комплексного аниона равна 10–33. Ответ: 10–21 моль/л.
43. Рассчитайте равновесную концентрацию ионов кадмия [Cd2+] в 0,1 моль/л водном растворе комплекса К2[Cd(CN)4], содержащем цианид калия
КCN при концентрации c(KCN)=1,0 моль/л. Полная константа нестойкости комплексного аниона [Cd(CN)4]2– равна 10–17,11, pK=17,11.
Ответ: 7,8∙10–19 моль/л.
44. Рассчитайте равновесные концентрации ионов меди (II) [Cu2+] и аммиака [NH3] в водном растворе комплекса [Cu(NH3)4]2+ с его исходной концен-
трацией 0,1 моль/л. Полная концентрационная константа нестойкости комплексного катиона [Cu(NH3)4]2+ равна 10–12,03, рК=12,03.
Ответ: [Cu2+]=8∙10–4 моль/л, [NH3]=3,2∙10–3 моль/л.
45.В водном растворе присутствуют сульфат-ион SO42– и оксалат-ион C2O42– в одинаковых концентрациях. К этому раствору медленно прибавляют водный раствор хлорида кальция CaCl2. В какой последовательности будут осаждаться из раствора сульфат-ион и оксалат-ион?
46.Как изменится растворимость оксалата кальция при прибавлении в его
насыщенный водный раствор хлорида калия KCl до концентрации с(KCl)=0,1 моль/л? Произведение растворимости оксалата кальция равно 2,3∙10–9.
Ответ: увеличится в 2,3 раза.
47.Рассчитайте произведение растворимости свежеосажденного гидро-
ксида магния Mg(OH)2, если в 500 мл его насыщенного раствора содержится 1,55∙10–2 г этого соединения.
Ответ: 6,01∙10–10.
48.Рассчитайте концентрацию формиат-ионов HCOO– в водном растворе
муравьиной кислоты НСООН с концентрацией кислоты, равной 0,05 моль/л. Константа диссоциации муравьиной кислоты равна 1,8∙10–4.
Ответ: 3∙10–3 моль/л.
19
49. Какая масса свинца (в г) содержится в 1 л насыщенного водного рас-
твора сульфата свинца PbSO4, если его произведение растворимости равно
1,6∙10–8.
Ответ: 2,61∙10–2 г.
50.Рассчитайте константу гидролиза, степень гидролиза и рН водного
раствора ацетата натрия CH3COONa с концентрацией c(CH3COONa)=0,1 моль/л. Константа диссоциации уксусной кислоты равна Кa=1,74∙10–5; рКa=4,76.
Ответ: 5,7∙10–10.
51.Рассчитайте рН буферного раствора, один литр которого содержит 0,1
моль уксусной кислоты и 0,01 моль ацетата натрия. Константа диссоциации уксусной кислоты Ка=1,74∙10–5; рКа=4,76.
Ответ: рН=3,76.
52.Рассчитайте значение рН водного раствора ацетата аммония
CH3COONH4 при концентрации последнего, равной 0,01 моль/л. Для уксусной кислоты Ка=1,74∙10–5; рКа=4,76; для аммиака Кв=1,76∙10–5 и рКв=4,76.
Ответ: pH=7.
53.Рассчитайте отношение молярных концентраций муравьиной кислоты HCOOH и ее натриевой соли HCOONa в формиатном буферном растворе,
имеющем pН=3,15. Константа ионизации муравьиной кислоты равна Ка = 1,8∙10–4; рКа=3,75.
Ответ: Са/Св=4.
54.Определите, как изменится рН водного раствора формиата натрия
HCOONa с концентрацией с(HCOONa)=0,10 моль/л, если раствор разбавить водой в 10 раз. Константа кислотности муравьиной кислоты Ка=1,8∙10–4, рКа=3,75.
Ответ: уменьшится на 0,5 единиц.
55.Рассчитайте значение рН водного раствора цианида аммония NH4CN, гидролизующегося по катиону и аниону. Концентрация раствора равна 0,1 моль/л. Для синильной кислоты HCN и аммиака, образующихся при гидролизе,
pКа=9,3 и рКв=4,76 соответственно.
Ответ: 9,27.
56.Рассчитайте рН аммиачного буфера, в 1 л которого содержатся 0,1
моль аммиака и 0,2 моль нитрата аммония NH4NO3. Константа основности ам-
миака Кв=1,76∙10–5; рКв=4,76.
Ответ: 8,93.
57.Рассчитайте произведение растворимости магнийаммонийфосфата NH4MgPO4, если в 1 л его насыщенного раствора содержится 8,6∙10–3 г
NH4MgPO4.
Ответ: 2,5∙10–13.
58.Рассчитайте молярную концентрацию катионов свинца [Pb2+] и иодид-
ионов [J–] в насыщенном растворе иодида свинца PbJ2, если его произведение растворимости равно 1,1∙10–9.
Ответ: [Pb2+]=6,5∙10–4, [J–]=1,3∙10–3.
59.Образуется ли осадок сульфата стронция SrSO4 при смешивании равных объемов водных растворов хлорида стронция SrCl2 и сульфата калия
20
