
Вопрос 1. Приведите характеристику элемента на основании его положения в периодической системе.
S – находится в IV периоде VI группы главной подгруппы, следовательно она относится к р-семейству.
+16S 1s22s22p63p23p4 ↓↑ ↑ ↑
+16S…3s23p4 ↓↑ K=II
↑
↑ ↑ ↑
+16S*…3s23p33d1 ↓↑ K=IV
↑ ↑
↑ ↑ ↑
+16S*…3S13p33d2 ↑ K=IV
С. О. – 2 , 0 , +2, +4 , +6
С. О. + 2 для серы мало характерна
С. О. – 2 0 +4 +6
H2S S8 SO2 SO3
H2SO3 H2SO4
Na2SO3 Na2SO4
NaHSO3 NaHSO4
Вопрос 2.
Укажите тип связи в данных молекулах:
Na2O, Cl2, CCl4
Na2O ∆X=3,5 – 0,93= 2,57, т.к. ∆X › 2, то связь ионная
Cl2 ∆X=0 – следовательно связь ковалентная неполярная
CCl4 ∆X=2,83 – 2,5=0,33, т.к. ∆X ‹ 2, то связь ковалентная полярная.
Вопрос 3. По мвс постройте молекулы BeF3.
F—Ве—
F
│
F
+ 5 В…2s22р1 К = I
+ 5 В…2s12р2 K = III
3p
3s

+17 F…2s22p5 K = I
2p
2s
Задание 3
|
№
|
Составьте уравнение диссоциации следующих соединений
|
Напишите молекулярные и ионные уравнения реакций
| |
|
Обмена |
Гидролиза солей | ||
|
1 |
3 |
4 |
5 |
|
1 |
H2SO4, Zn(OH)2 |
AlCl3 + 2NaOH → AgNO3 + KCl →
|
NaHS, Zn (NO3 )2, Fe2 (CO3)2 |
|
2 |
CH3COOH, H3PO3 |
ZnO + NaOH → BaCl2 + K2SO4 → |
NiSO4, Na2SiO3, K2S
|
|
3 |
H2S, NaH2PO4 |
Cr(OH)3 + KOH → MgCl2 + K2SiO3 →
|
K2 SO 3, CrCl3, Al (NO2)3
|
|
4 |
Ba(OH)2, H2Se |
Cu(NO3)2 + NaOH → K2S + Pb(CH3COO)2 →
|
NaHCO3,Al2 (SO4) 3, NH4NO2
|
|
5
|
Ca(HCO3)2, Cr(OH)3
2
|
NaCrO2 + H2SO4 → SnCl2 + Na3PO4 →
|
Cr(NO3)3, K2SO3, Pb(NO3 )2 |
|
6 |
Al(OH)3, Ni(HS)2 |
Al2(SO4)3 + 2KOH → CuCl2 + K2S →
|
Na2SiO3, Сu(NO3)2, (NH4)2SO3
|
|
7 |
NaHSO3, H3PO4 |
CH3COOH + Na2CO3 → CaI2 + Na3PO4 →
|
MnSO4, Na2S, Na2HPO4 |
|
8 |
Cr(OH)3, NH4OH |
Cr(NO3)3 + 2NaOH → BaBr2 + K2SiO3 →
|
NaHSO4, Fe2(SO4)3, K3PO4
|
|
9 |
Zn(OH)2, H2Te |
BeCl2 + KOH(изб) → MnSO4 + Na2S3 →
|
Bi(NO3)3, Mg(NO2)2, NiCl2
|
|
10 |
Mg(NO2)2, H3AsO4 |
Cr2O3 + KOH → Na2SiO3 + MnSO4 →
|
NH4Cl, NaH2PO4, FeCI3 |
|
11 |
Na3PO4, Mg(HCO3)2 |
Al2(SO4)3 + KOH(изб) → AgNO3 + NaBr → |
NaNO2, Al2(SO4)3 Cr2S3
|
|
1 2 |
H3AsO3, Zn(OH)2 |
CrCl3 + NaOH(изб) → Hg(NO3)2 + KI →
|
Na2SiO3, Al2(SO4)3, NiCl2
|
|
13 |
H2S, Cr(OH)3 |
Ca(HCO3)2 + H2SO4 → MnSO4 + Na2S → |
Pb(NO3)2, K2SiO3, Al2(SO4)3 |
|
14 |
Na2SiO3, Cr(OH)3 |
Pb(NO3)2 + CuSO4 → Be(NO3)2 + KOH(изб) →
|
NiSO4, Na2SO3 SnCI4,
|
|
15 |
NH4HCO3, Al(OH)3 |
CrCl3 + NaOH(изб) → CaCl2 + Na2SO3 → |
K2SiO3, ZnSO4, (NH4)2S |
|
16 |
H2Se, Ca(HCO3)2 |
HNO2 + NH4OH → BaS + K2CO3 →
|
Fe((NO3)3, NaHSO4 , Cr2S3 |
|
17 |
Al(OH)3, Mg(NO2)2 |
Mg(OH)2 + H2SO4 → Fe(NO3)3 + Na3PO4 →
|
Mn(NO3)2, Na2CO3, Bi(NO3)3
|
|
18 |
Zn(OH)2, CH3COOH |
FeO +HNO3 → Na3PO4 + Pb(NO3)2 → |
K2S, Al2(SO4)3, CrCl3. |
|
19 |
Ni(OH)2, H2SO3 |
MnSO4 + NaOH → CuSO4 + Ba(NO3)2 → |
Cr2(SO4)3, KNO2, (NH4)2SO3 . |
|
20 |
Cr(OH)3, Na2CO3
|
Al2(SO4)3 + NaOH(изб) → CrCl3 + Na3PO4 → |
KNO2, NiCl2, Na2CO3 |
Пример выполнения задания 3.
1.Составьте уравнение диссоциации следующих соединений Ве(OH)2, CrCl3:
Н++НВеО2-→Ве(OH)2 →ВеOH+ + OH-
Н+ + ВеО2 2 - Ве2+ +OH-
CrCl3 →Cr 3+ + 3Cl-
2. Напишите молекулярные и ионные уравнения реакций :
ZnS + 2HCI = ZnCI2 + H2S
ZnS + 2H+ = Zn2+ + H2S
Al2(SO4)3 + 2H2O→ 2AlOHSO4 + H2SO4
Al3+ + HOH → AlOH 2+ + H+ , pH 7
Задание 5
Решите задачи
Реакция образования оксида азота (ΙV) выражается уравнением 2NO+O2=2 NO2. Как изменится скорость прямой и обратной реакций, если увеличить давление в 2 раза, а температуру оставить постоянной? Вызовет ли это изменение скоростей смещение равновесия? (Ответ: скоростьпрямой реакции увеличилась в 8 раз, скорость обратной реакции увеличилась в 4 раза).
Во сколько раз изменится скорость прямой и обратной реакции в системе 2SO2(г)+О2(г)=2SO3(г), если объем газовой смеси уменьшить в 3 раза? В какую сторону сместится равновесие системы? (Ответ:в 27 раз;в 9 раз).
Константа равновесия гомогенной системы CO(г)+Н2O(г)=CO2(г)+H2(г) при 850ºС равна 1. Вычислите концентрации всех веществпри авновесии, если исходные концентрации: [CO]исх.=3 моль/л, [Н2О]исх.=2 моль/л. (Ответ:[CO2]р=1,2 моль/л; [Н2]р=1,2 моль/л; [CO]р=1,8 моль/л; [Н2О]р=0,8 моль/л.
При 393 К реакция заканчивается за 10 мин. Сколько врмени будет продолжаться реакция при393 К, если температурный коэффициент этой реакции равен 3? (Ответ:4,5 ч.)
При синтезе аммиака N2+3H2=2NH3 равновесие установилось при следующих концентрациях реагирующих веществ: СN2=4 моль/л; СH2=2 моль/л; СNH3=6 моль/л. Рассчитайте константу равновесия этой реакции и исходные концентрацииазота и водорода. (Ответ: 1,1; СN2=7 моль/л; СH2= 11моль/л).
Содержание сульфата железа (ІІ) в растворе (ρ=1,122 г/см3) составляет 12 мас. долей,%. Вычислите молярную и нормальную концентрацию сульфата железа (ІІ) в растворе. (Ответ: 0,886 моль/л; 1,772 г-экв/л)
Растворимость Ag3PO4 в воде при 20ºС равна 0,0065 г/л. Рассчитайте величину произведения растворимости. (Ответ: 1,77·10-18)
Произведение растворимости MgS при t=25ºС равно 2,0·10-15. Образуется ли осадок сульфида магния при смешивании равных объемов 0,004 н раствора нитрата магния и 0,0006н раствора сульфида натрия. Степени диссоциации этих электролитов приняты за 1.
Реакция протекает по уравнению 4HCl+O2=2H2O+2Cl2. В сторону какой реакции сместится химическое равновесие, если концентрации всех реагирующих веществ увеличить в 3 раза.
В воде массой 100 г при температуре 10ºС растворяется соль массой 5 г, а при температуре 60ºС — массой 8 г. Рассчитайте массу соли, которая выпадает в осадок, если раствор соли массой 200 г, насыщенный при температуре 60ºС , охладить до 10ºС .(Ответ: 5,56 г)
Вычислите нормальность, молярность10%-го раствора CuSO4,плотность которого ρ=1107 кг/м3. (Ответ: См=0,693 моль/л, Сн=1,386 г-экв/л)
Сколько литров 30%-го раствора HNO3 ( ρ=1180 кг/м3) требуется для приготовления 20 л 0,5М раствора этой кислоты. (Ответ: 1,78 л 30%-го раствора HNO3)
Вычислите массу SO3, которую надо добавить к 120 мл 30%-го раствора H2SO4 (ρ=1,2 г/мл),чтобы получить 40%-й раствор H2SO4 в воде. Ответ: 17,5 г.
Вычислите массовую долю H2SO4 в растворе, полученном сливанием 300 г 30%-го и 200 г 15%-го раствора H2SO4. Ответ: 24%.
Вычислите массы 40%-го и 20%-го растворов HCl, которые нобходимы для приготовления 200 г раствора с массовой долей HСl 25%. Ответ: 50 г 40%-го раствора и 150 г 25%-го раствора.
Вычислите число ионов в растворе, содержащем 3,42 г сульфата алюминия. Ответ: 3∙1022
Определите степень гидролиза 0,001 н раствора соли CH3COOK и pH этого раствора, если константа диссоциации уксусной кислоты равна 1,754∙10-5. Ответ: β=0,755∙10-3, pH=7,9
Вычислите: а)процентную (С%); б) молярную (См); нормальную или эквивалентную (Сн) концентрации раствора H3PO4, полученного при растворении 18 г кислоты в 282 мл воды. Если плотность его 1,031г/мл. Чему равен титр Т этого раствора? Ответ: С%=6%, См=0,63 моль/л, Сн=1,89 г-экв/л, Т=0,06186 г/мл
Рассчитать константу гидролиза хлорида аммония NH4Cl, если константа диссоциации NH4OH равна 1,77∙10-5. Ответ: 5,65∙10-10
Определите водородный показатель рН водного раствора гидроксида калия, содержащего 4,2∙10-3 моль/л КОН. Степень диссоциации равна 1. Ответ: рН=11,62
Задание 4.
|
№ варианта |
закончить уравнения окислительно-восстановительных реакций, указать окислитель и восстановитель |
|
1 |
NaCrO2 + Br2 + NaOH ; J2+NaOH ; KMnO4 + H2O2 + H2 SO4 ; Cu + HNO3 разб. |
|
2 |
KJ+H2O2+H2SO4 ; Zn + HNO3 разб.; FeSO4+KMnO4+H2SO4 ; Cl 2+ Са(ОН)2 |
|
1 |
2 |
|
3 |
Cl 2+KOH холод. ; Na2S+Na2SO4 + H2SO4 ; PbO2+Mn(NO3)2+HNO3 HMnO4 + …; Mg + H2SO4 конц. |
|
4 |
S+NaOH ; KMnO4+MnSO4+H2O ; KBrO3 + KBr +H2SO4 ; Cu + H2SO4 конц. |
|
5 |
CI2 + Br2 + H2O ; H2S+KMnO4+H2SO4 Zn+ H2SO4 конц. ; КCrO4 + Br2 + NaOH |
|
6 |
Na2S +Na2SO3 +H2SO4 ; Na2S 2O3 + l2 ; KMnO4 + NaNO2 + H2 SO4 AI + NaOH + H2O |
|
7 |
KMnO4+Na2SO3 +H2SO4 ; Sn + HNO3 конц ; Na3 [ Cr (OH)6] + Br2 + NaOH ; CI2 + Br2 + H2O |
|
8 |
P + NaOH ; K2 Cr2O7 + KI + H2SO4 ; KMnO4+Na2SO3 +H2O ; Zn + NaOH + H2O
|
|
9 |
K2S 2O3 +Cl2+ H2O ; K2MnO4+H2O K2Cr2O7 + Na2 S2O 3 + H2SO4 ; Bi + HNO3 разб. |
|
10 |
H2S+KMnO4+H2SO4 ; CI2 + NaOH; NH2OH +FeSO4 + H2SO4 ; Hg + HNO3 разб. |
|
11 |
K2Cr2O7 + H2O2 + H2SO4 ; I2 + HNO3 ; Ca(OH) 2 +Cl2 ; Hg + HNO3 конц. |
|
12 |
KMnO4 + Na NO 2 + KOH ; Mg + HNO3 разб. ; NH2OH +FeSO4 + H2SO4 ; Zn + NH4СI + H2O |
|
13 |
K2Cr2O7 + HCl ; Na2S + Na2SO3 +H2SO4 ; KMnO4 + Na NO 2 + KOH ; Zn + HNO3 разб.
|
|
14 |
K2Cr2O7 + NaNO2 + H2SO4 ; MnO2 +НС1 конц. ; P + NaOH Cu + HNO3 разб. |
|
15 |
Bi (NO3 )3 + Na2 Sn (OH)4 + NaOH ; S + HNO3разб. KI + H2O2 + H2SO4 ; K2Cr2O7 + (NH4)2S + Н2О |
|
16 |
Br2 + Cr2O3 +NaOHконц. ; Zn + H2 S O4 конц. ; KI + KIO3 + H2SO4 ; KMnO4 + NH2OH + H2SO4 |
|
17 |
H2S+KMnO4+H2SO4 ; Zn + K2СO3 + H2O; NH2OH + I2 +NaOH ; Mg + H NO разб.; |
|
18 |
As2S3 + HNO3 ; KMnO4 + Сu + H2SO4 Bi (NO3 )3 + Na2 Sn (OH)4 + NaOH ; |
|
19 |
KJ+KJO3+H2SO4 ; AI + NaOH + H2O; As2S3+HNO3 ; KMnO4+ MnSO4 +H2O |
|
20 |
K2Cr2O7 + NaNO2 + H2SO4 ; J2+KOH Mg + H2SO4 конц. KMnO4+NaNO2 +H2SO4 |
Пример выполнения задания 4.
I …5s25р 5 , следовательно I2 проявляет свойства и окислителя и восстано- вителя 5 I + е = I-
1 I - 5е + 6 OН- = IO3 - + 3H2O 5I + I + НO - = 5I- + IO3 - + 3H2O
Задание 5 . Комплексные соединения
|
№ п/п |
Составьте координационные формулы ком-плексных соединений. Для одного из них в молекулярном и ионном виде напишите реак-цию его получения, выражение для определе-ния Кнест . Как можно разрушить данный комплекс |
По методу валент-ных связей постро-йте комплексный ион, охарактери-зуйте его свойства |
|
1 |
2 |
3 |
|
1 |
СrCI3 • 6 NH3; AI (OH)3 • 3 NaOH |
[Pt CI6 ] 2- |
|
2 |
CuSO4 • 4 NH3; FeCI3 • 6 H2O |
[ Cu (H2O) 4 ] 2+ |
|
3 |
Fe CN3 • 3KCN ; AuCI3• HCI |
[ Co (CN) 6] 3- |
|
4 |
СrCI3 •6H2O; Pt CI2 •2NH3 |
[ CoF6 ] 3- |
|
5 |
Co(SCN) 3 •3KSCN ; Au(CN)3 • KCN |
[ Mn (H2O) 6 ] 2+ |
|
6 |
FeCI3 • 6 H2O ; Co (CN) 3 3KCN |
[ AuCN4 ] - |
|
7 |
Pt CI4 6NH3; СrCI3 •3H2O |
[AuCI4 ] - |
|
8 |
HgI2 •2KI ; FeCI3 • 4NH3 |
[Fe (CN)6 ] 4- |
|
9 |
FeCI2 • 4KCN ; СrCI3 • 4H2O |
[ Fe (CN)6 ] 3- |
|
10 |
Sn (OH)4 • 2 NaOH; СrCI3 • 5NH3 |
[ Co (CN) 6] 3- |
|
11 |
MnCI2 •KCI ; Ni (CN)2 •2KCN ; |
[Pt (NH3 )6 ]4+ |
|
12 |
Pt CI4 •2NH3; CoBr3 • 5H2O |
[ Cu (H2O )4 ] 2+ |
|
13 |
AgCI • 2NH3 ; Pt CI4 • 4 NH3 |
[ Co (NH3) 6 ] 3+ |
|
14 |
Be (OH)2 • 2 NaOH ; AuCI3 • 4NH3 |
[HgI4 ] 2- |
|
15 |
FeCI3 •3KCI ; Ni CI2 •4NH3 ; |
[Ni ( NH3 )4 ] 2+ |
|
16 |
Pb(OH)2 • 2NaOH; СrCI3 •3NH3; |
[ Сr( NH3)6 ] 3+ |
|
17 |
Pt CI2 •4NH3; Ni (NO2) 2 • 3K NO2 |
[ Сr (H2O ) 6 ] 2= |
|
18 |
CuSO4 • 4H2O; Co( CN)3 • 3KCN |
[ Pt (CN)6 ] 2- |
|
19 |
Fe CI2 • 2KCI; Au(CN)3 •KCN |
[ Pt (CN)4 ] 2- |
|
20 |
Zn(OH)2 • 2NaOH; Fe (CN)2 • 4KCN |
[Сo (NH3) 6 ] 3+ |
Пример выполнения задания :
а) Fe(CN)2 • 4KCN - K4 Fe(CN)6 - гексацианоферрат (II) калия .
Co CI2 • 4 NH3 - Co (NH3 )4 CI2 – хлорид тетрааквакобальта (II) .
Co CI2 + 4NH3 = Co (NH3 )4 CI2
Сo 2+ + 4 NH3 = [Сo (NH3) 4 ] 2+
Co (NH3 )4 CI2 [Сo (NH3) 4 ] 2+ + 2CI-
[Сo (NH3) 4 ] 2+ Сo 2+ + 4 NH3
[Сo 2+ ] [NH3 ] 4
Кн =
[ [Сo (NH3) 4 ] 2+ ]
![]() [Сo
(NH3)
4
]CI2
+
Na2S
= CoS + 4NH3
+ 2NaCI
[Сo
(NH3)
4
]CI2
+
Na2S
= CoS + 4NH3
+ 2NaCI
[Сo (NH3) 4 ] 2+ + S2- = CoS + 4NH3
Кн > Пр CuS
б) По методу валентных связей постройте комплексный ион AuCI4 - , охарактеризуйте его свойства : 79 Au 0 . . . 5d104s1
Au
3+.
. . 5d8




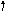
 __
__ __
__
__ __
__ 6p
Au 3+ . . . __ __ __ __ __ 6s
5d
sp3 – гибридизация , тетраэдрический, внешнеорбитальный, реакцион-носпособный, неустойчивый, парамагнитный
Задание 6. Химия элементов
Напишите уравнения реакций с помощью которых можно осуществить превращения :
1. Fe SO4 Fe2(SO4)3 Fe (OH)3 FeCl3 К3 [ Fe(CN )6]
Н2О К2Fe O4
1. MnSO4 KMnO4 MnO2 К2MnO4 KMnO4
3. CuSО4 (CuOH)2 SО4 Cu(OH)2 KCuO2 Cu(OH) 2[Cu(NH3)4 ] (OН)2
4. Ni(OH)2 Ni(OH)3 Ni(NO3)2 Ni(OH )2 [ Ni(NH3)4 ]CI2
напишите уравнение диссоциации комплекса, выражение для определения Кн , как можно его разрушить?
5. К3[Cr(OH)6] К2CrO4 К2Cr2O7 Cr 2(SO4)3 Cr(OH)3
+NaOH
6. CoSO4 «A» Co(OH)3 Co SO4 напишите реакции получения аква - , аммино-, ацидо- комплексов Cо ( II ), назовите их.
7. MnС12 Na2MnO4 MnO2 НMnO4 MnС12
8. К2MnO4 КMnO4 MnO2MnС12 Mn (ОН)2
9. Fe2(SO4)3 Fe SO4 Fe (OH)2Fe (OH)3 Na2FeO4 Fe(ОН)3
10. Ni(OH)3 NiSО4 NiСI2 Ni(OH)2 Ni(OН)3 NiСI2
11. MnSО4 MnО2 КMnO4 К2MnO4 MnО2
12. КCrO2 К2CrO4 2 Cr2O7 2- Cr 3+ напишите реакции получения гидроксо - , ацидо- комплексов Cr ( III ), назовите их.
13.NiSО4 NiСI2 Ni(OH)2 Ni(OH)3 Ni(NO3)2 получите комплексные соединения катионного и анионного типа, назовите их, напишите выражения для определения Кн
14. К2Cr2O7 Cr 2(SO4)3 К3[Cr(OH)6] К2CrO4 Cr(OH)3
15. FeSO4 Fe2(SO4)3 Fe(OH)3 Fe2O3 Na2FeO4
|
напишите уравнение полного гидролиза соли
16. К2CrO4 Cr(OH)3 К2Cr2O7 CrСI 3 К3[Cr(OH)6]
|
напишите уравнение полного гидролиза соли
17. Co(OH)3 Co( NO3 )3 Co(OH)2 Co(OH)3 CoCI 2 напишите реакции получения аква - , аммино-, ацидо- комплексов Cо(II ), назовите их.
MnO2 НMnO4 KMnO4 К2MnO4 MnO2 MnCI 2 напишите реакции получения аква - , аммино-, ацидо- комплексов, назовите их.
19. [Cu(NH3)4 ](OН) 2 CuS Cu(NО3 )2 Cu(OH)2 KCuO2 Cu(OH) 2
по методу ВС постройте комплексный ион
(NH4 )2Cr2O7 Cr2O3 КCrO2 К2CrO4 К3[Cr(OH)6] К2CrO4 К2Cr2O7
