
Карцев В.Г.Избранные методы с-за и модифик. гетероциклов т.2 , 2003
.pdf
E-2-фенацилиден-2,4-дигидро-1Н-3,1-бензоксазин-4-он
Востров Е.С., Масливец А.Н.
Пермский государственный университет
O
O |
|
1. |
OH |
O |
|
|
NH2 |
|
|
|
O |
|
O |
|
|
|
|
||
Ph O |
|
2. (C6H11N)2C |
N |
|
H O Ph
Ph
1 |
2 |
Раствор 1.00 г (4.90 ммоль) диоксинона 1 и 0.67 г (4.90 ммоль) антраниловой кислоты в 10 мл m-ксилола кипятят 15 мин. Охлаждают, выпавший осадок отфильтровывают. Перекристаллизовывают из этанола, помещают в 20 мл абсолютного дихлорэтана, добавляют 0.80 г (3.90 ммоль) дициклогексилкарбодиимида и кипятят 1 час. Выпавший осадок дициклогексилмочевины отфильтровывают, маточник упаривают, остаток перекристаллизовывают из гептана. Получают 1.03 г бензоксазинона 2, светло-желтые кристаллы, выход 80%, Тпл 141–142°С. Структура соединения 2 доказана методами ИК (UR-20), ПМР (AM-400, Brucker) спектроскопии, а также элементным анализом.
Работа выполнена при финансовой поддержке РФФИ (гранты № 02-03-06605,
№ 02-03-96411, № 01-03-32641).
Генеральный спонсор и организатор – InterBioScreen Ltd. |
271 |
2,3:20,22-Диацетонид-(9-О-14-дегидро)-9,14-окса- 20-гидроксиэкдизон
Галяутдинов И.В., Веськина Н.А., Одиноков В.Н.
Институт нефтехимии и катализа АН Республики Башкортостан и Уфимского Научного Центра РАН
|
HO |
O |
HO |
O |
|
|
|
||
|
|
H O |
|
H O |
O |
|
Li/NH3 |
O |
O |
H OH |
ТГФ |
|
||
|
|
|
||
O |
|
O |
|
|
|
|
|
||
|
H O |
|
H O |
|
|
1 |
|
2 |
|
2,3:20,22-Диацетонид-(9-О-14-дегидро)-9,14-окса-20-гидроксиэкдизон (2). К раст-
вору 0.3 г (0.04 моль) Li в 30 мл свежеперегнанного NH3 при перемешивании прибавляют раствор 2.0 г (3.6 ммоль) соединения 1 в 10 мл абсолютного ТГФ. Смесь перемешивают 0.5 ч при –35°С и добавляют 4.0 г (0.08 моль) сухого NH4Cl. Реакционную смесь выдерживают при комнатной температуре до полного удаления NH3, продукт экстрагируют этилацетатом (3 × 50 мл). Экстракт высушивают, растворитель упаривают, остаток хроматографируют на колонке с SiO2 (60 г). Элюируют смесью хлороформ : метанол (30 : 1). После кристаллизации получают
1.9 г соединения 2, выход 94%, Тпл 120–121°С (из EtOAc), [α]D17 −37.8° (c 0.65, CHCl3).
272 |
Избранные методы синтеза |
Диспиро[андростан-17S,5'-оксазолидин-2',4''-пипери- дины] – синтетические аналоги стероидных алкалоидов
Гелла И.М.
Харьковский национальный университет им. В.Н. Каразина
|
O |
|
OH |
NH |
O |
|
|
|
|
||
|
|
|
|
|
N |
O |
MeNH2 |
O |
|
|
O |
|
|
|
|
||
O |
1 |
|
O |
|
|
|
|
2 |
|
|
|
|
O |
|
O |
|
|
|
N |
|
N |
|
|
|
O N |
H+ |
O N |
|
|
O |
|
O |
|
|
|
O |
|
|
|
|
|
3 |
|
4 |
|
|
|
|
|
|
|
17α-Метиламинометил-3,3-этилендиоксиандрост-5-ен-17β-ол (2). К раствору
1.72 г (5 ммоль) 3,3-этиледиоксиспиро[андрост-5-ен-17S,2'-оксирана] 1 [1] в 100 мл этанола прибавляют 10 мл 25% раствора метиламина и кипятят до исчезновения исходного оксирана. Выливают в воду, отфильтровывают выпавший осадок и сушат на воздухе. Получают 1.7 г соединения 2, которое используют без дополнительной очистки.
3,3-Этилендиокси-3'-метил-1''-ацетилдиспиро[андрост-5-ен-17S,5'-оксазолидин- 2',4''-пиперидин] (3). К 1.7 г соединения 2 (4.6 ммоль) в 150 мл толуола прибавляют 1.13 г (8 ммоль) N-ацетил-4-пиперидона, 0.1 г сульфосалициловой кислоты и кипятят с насадкой Дина–Старка 6 часов. Толуол отгоняют в вакууме, а остаток кристаллизуют из этилацетата. Получают 1.2 г соединения 3, выход 55%,
Тпл 188–190°С.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
273 |

3'-Метил-1''-ацетилдиспиро[андрост-4-ен-3-он-17S,5'-оксазолидин-2',4''-пипери-
дин] (4). К 0.47 г (1 ммоль) соединения 3 в 10 мл 95% ацетона прибавляют 0.1 мл конц. HCl и оставляют на ночь. Реакционную смесь разбавляют водой и экстрагируют этилацетатом. После отгонки этилацетата в вакууме и кристаллизации остатка из смеси гексан–этилацетат получают 0.2 г соединения 4, выход 44%,
Тпл 197–199°С.
Структура соединения 4 доказана с помощью ПМР спектроскопии.
1.Гелла И.М., Сергиенко Л.Ю., Черевко А.Н., Хим.-фарм. журн. 1994 (8) 25.
274 |
Избранные методы синтеза |
(3S,7S)-14,16-Диокси-3-метил-7-фенэтиламино- 3,4,5,6,7,8,9,10-октагидро-1H-2-бензоксацикло-
тетрадецин-1-он
Гелла И.М.
Харьковский национальный университет им. В.Н. Каразина
OH O |
|
OH |
O |
|
O |
PhCH2CH2NH2 |
|
O |
|
HO |
H+ |
HO |
|
|
1 |
O |
|
|
N |
|
|
|
|
|
|
|
|
1. NaBH4 |
Ph |
|
|
|
|
|
|
|
|
2. HCl |
|
|
|
OH |
O |
|
|
|
|
O |
− |
|
|
|
|
Cl |
HO
|
+ |
|
2 |
NH2 |
|
Ph |
||
|
К 3.18 г (10 ммоль) зераленона 1 в 100 мл толуола прибавляют 1.33 г (11 ммоль) 2-фенилэтиламина, 0.1 г сульфобензойной кислоты и кипятят с водоотделителем 3 ч. Толуол упаривают. Остаток растворяют в 100 мл абсолютного изопропанола, прибавляют 0.48 г NaBH4 и перемешивают при комнатной температуре 2 ч. Реакционную смесь выливают в 500 мл воды, экстрагируют этилацетатом (3 × 50 мл). К полученному экстракту прибавляют 1.5 мл конц. соляной кислоты и упаривают растворитель. Полученный остаток растворяют при нагревании в 25 мл ацетона и оставляют на ночь для кристаллизации. Выпавший мелкокристаллический продукт отфильтровывают, промывают ацетоном и высушивают на воздухе. Получают 2.0 г хлоргидрата 2, выход 75%, Тпл 282−284°С. Структура соединения 2 подтверждена данными ПМР спектроскопии, стереохимия установлена рентгеноструктурным анализом.
Работа выполнена при поддержке InterBioScreen.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
275 |
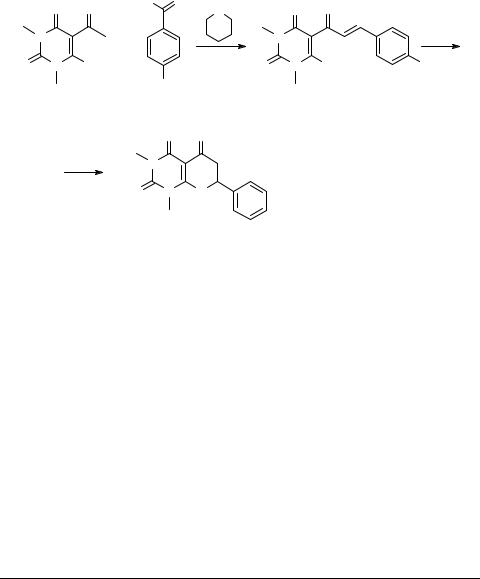
7-(4-Хлорфенил)-1,3-диметил-1,3,4,5,6,7-гексагидро- 2Н-пирано[2,3-d]пиримидин-2,4,5-трион
Горовой А.С., Краснов К.А.
Санкт-Петербургская Государственная медицинская академия им. И.И. Мечникова
O |
O |
H O |
H |
O |
O |
|
|
|
N |
|
|||||
N |
|
+ |
|
N |
|
|
|
O N |
OH |
AcOH |
N |
OH |
Cl |
||
|
|||||||
|
O |
||||||
|
|
Cl |
|
|
|
|
|
1 |
|
2 |
|
|
3 |
|
O O
H2SO4 N
O N O
4  Cl
Cl
5-[3-(4-Хлорфенил)-2-пропеноил]-6-гидрокси-1,3-диметил-1,2,3,4-тетрагидро- 2,4-пиримидиндион (3). Растворяют 1.5 г (7.6 ммоль) 1,3-диметил-5-ацетилбарби- туровой кислоты 1 и 1.1 г (7.6 ммоль) 4-хлорбензальдегида 2 в 20 мл ледяной уксусной кислоты. Прибавляют 2.0 г пиперидина и кипятят 3 часа с обратным холодильником. Затем реакционную смесь охлаждают до комнатной температуры. Выпавший осадок отделяют, промывают горячим этанолом, водой и сушат. Получают 1.0 г соединения 3, желтые кристаллы, выход 41.3%, Тпл 201–204°С.
7-(4-Хлорфенил)-1,3-диметил-1,3,4,5,6,7-гексагидро-2Н-пирано[2,3-d]пирими-
дин-2,4,5-трион (4). Растворяют 0.5 г (1.6 ммоль) соединения 3 в 5 мл концентрированной серной кислоты и оставляют на 24 часа при комнатной температуре. Прибавляют 20 г льда при перемешивании, выпавший осадок отделяют, промывают водой и сушат. Получают 0.16 г соединения 4, белые кристаллы, выход 32%,
Тпл 225°С.
Структура соединений 3 и 4 подтверждена методами ПМР спектроскопии
(АМ-500, Bruker).
276 |
Избранные методы синтеза |
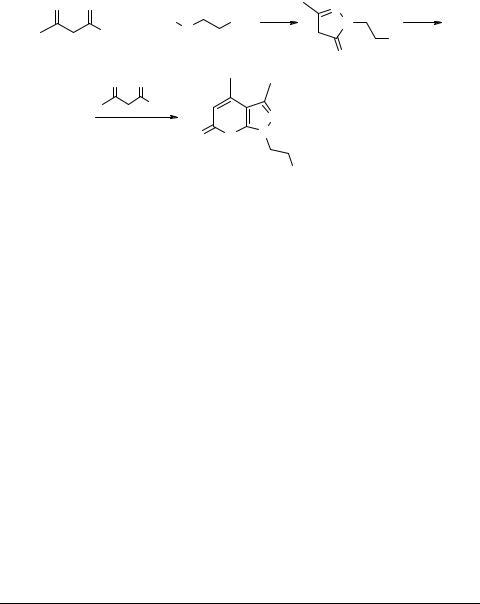
1-(β-Оксиэтил)-3,4-диметилпирано[2,3-c]пиразол-6-он
Грандберг И.И., Нам Н.Л.
Московская сельскохозяйственная академия им. К.А. Тимирязева
O O |
H2N |
|
OH |
N |
OEt + |
N |
N |
||
|
|
OH |
||
|
|
H |
1 |
|
|
|
|
|
O |
O O
OEt
N
O O N
2OH
Вколбу на 250 мл помещают 30.4 г (0.4 моль) свежеперегнанного β-оксиэтил- гидразина 1 и при размешивании медленно прикапывают (приблизительно за 1 час) 104 г (0.8 моль) свежеперегнанного ацетоуксусного эфира. Реакционную смесь оставляют на ночь. Затем смесь нагревают в открытой колбе на кипящей водяной бане в течение 2-х часов. Колбу переносят в металлическую баню и нагревают 3 ч
при температуре бани 140°С с отгонкой этанола и воды. Затвердевший осадок перекристаллизовывают из этилацетата. Получают 53 г пиранопиразола 2, выход 63.7%, Тпл 157–159°С, Rf = 0.21 (бензол : ацетон − 3 : 1, проявление иодом).
Структура соединения 2 доказана методоми ИК, УФ (Specord M-40) и ЯМР (Bruker AM-300) спектроскопии и элементным анализом.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
277 |
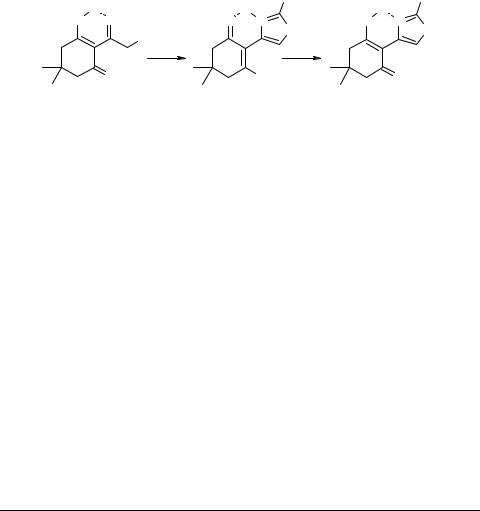
Посвящается 90-летию академика А.А. Ахрема
Хлорид 3-[2-амино-4-(2-гидрокси-4,4-диметил-6-оксо- 1-циклогексенил)-1,3-тиазолия] и 3-гидрокси-5,5-ди- метил-2-(2-амино-1,3-тиазолил-4)-2-циклогексен-1-он
Гулякевич О.В., Михальчук А.Л.
ГНУ Институт биоорганической химии Национальной Академии наук Беларуси
O H O |
|
Cl− |
NH2 |
|
H N |
NH2 |
O |
H N |
S |
O |
S |
||
|
Cl |
+ |
|
|
||
|
|
|
|
|
|
|
O |
|
OH |
|
|
O |
|
1 |
2 |
|
|
3 |
|
|
Хлорид 3-[2-амино-4-(2-гидрокси-4,4-диметил-6-оксо-1-циклогексенил)-1,3-тиа-
золия] (2). К раствору 3.25 г (15 ммоль) 2-хлорацетилдимедона 1 [1] в 10 мл этанола прибавляют раствор 1.2 г (15.8 ммоль) тиомочевины в 10 мл этанола и выдерживают при 60°С, следя за ходом реакции с помощью ТСХ. После завершения реакции (4.5 ч), реакционную смесь упаривают наполовину, разбавляют эфиром до слабого помутнения и оставляют при +5°С до завершения кристаллизации. Осадок перекристаллизовывают из смеси этанола и эфира, получают производное 2, бледно-желтые кристаллы, выход 82%, Тпл 154–156°С.
3-Гидрокси-5,5-диметил-2-(2-амино-1,3-тиазолил-4)-2-циклогексен-1-он (3). К
раствору 2.75 г (10 ммоль) хлорида 2 в 15 мл этанола прибавляют 0.85 мл (10.5 ммоль) пиридина и оставляют при 10–12°С на 16 ч. Выделившееся вещество отфильтровывают, промывают на фильтре холодным ацетоном и перекристаллизовывают из смеси этанола и ацетона. Получают 4-тиазолилдимедон 3, кремовые кристаллы, выход 91%, Тпл 252–254°С.
Строение производных 2 и 3 подтверждено методами ИК (UR-20), УФ
(Specord M-400), ЯМР 1Н и 13С (AC-200 Bruker) спектроскопии, масс-спект-
рометрии (Varian MAT-311) и элементным анализом.
1.Пшеничный В.Н., Гулякевич О.В., Хрипач В.А., ЖОрХ 1989 25 (3) 1882.
278 |
Избранные методы синтеза |
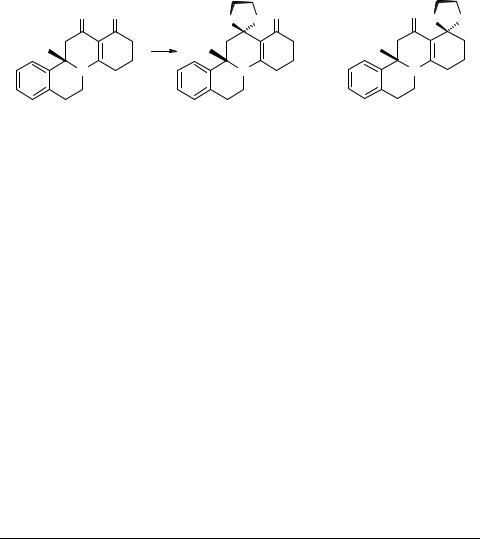
2,3,4,6,7,11b,12,13-Октагидро-1H-изохино- [2,1-a]хинолин-13-спиро[2'(1',3'-дитиолан)]-1-он и 2,3,4,6,7,11b,12,13-октагидро-1H-изохино[2,1-a]хинолин- 1-спиро[2'(1',3'-дитиолан)]-13-он
Гулякевич О.В., Михальчук А.Л., Ахрем А.А.
ГНУ Институт биоорганической химии Национальной Академии наук Беларуси
O O |
S S O |
O S S |
|
|
+ |
N |
N |
N |
1 |
2 |
3 |
Смесь 2.82 г (10 ммоль) 8-аза-D-гомогонана 1 [1], 0.88 мл (10.5 ммоль) этандитиола и 1 мл трифторуксусной кислоты в 50 мл хлороформа кипятят в атмосфере аргона с насадкой Сокслетта, заполненной гранулированным MgSO4, следя за ходом реакции с помощью ТСХ (Silufol UV-254, хлороформ−метанол, 9 : 1). После завершения реакции реакционную смесь нейтрализуют NaHCO3, фильтруют и упаривают. Остаток хроматографируют на силикагеле (Chemapol 5/40µ), элюируя хлороформом. Дитиолановое производное 2 перекристаллизовывают из смеси хлороформ−гексан (1 : 2), выход 40.4%, бледно-желтые игольчатые кристаллы, Тпл 209–212°С. Дитиолановое производное 3 перекристаллизовывают из смеси эфир−гексан (1 : 1), выход 56.5%, бледно-зеленые призматические кристаллы,
Тпл 229–232°С.
Структура соединений 2 и 3 подтверждена методами ИК (UR-20), УФ (Specord UV-VIS), ЯМР 1Н (WM-360 Bruker) спектроскопии, масс-спектрометрии (Varian MAT-311) и элементным анализом.
1.Михальчук А.Л., Гулякевич О.В., Ахрем А.А., ХГС 1993 (1) 86.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
279 |
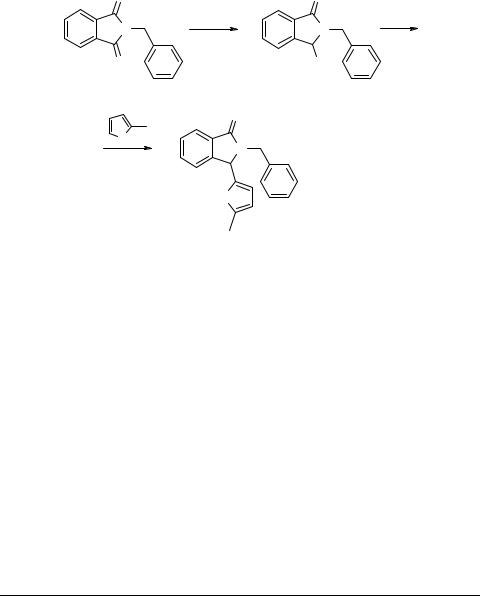
2-Бензил-3-(5-метил-2-фурил)-1-изоиндолинон
Дмитриев А.С., Абаев В.Т., Бутин А.В.
Кубанский государственный технологический университет
O |
|
O |
N |
NaBH4 |
N |
|
||
O |
|
OH |
1 |
|
2 |
O
O
N
TsOH
O
3
2-Бензил-3-гидрокси-1-изоиндолиндион (2). К 1.0 г (4.2 ммоль) 2-бензил-1,3-изо-
индолиндиона [1] в 10 мл этанола добавляют порциями 0.1 г (2.5 ммоль) боргидрида натрия. Суспензию доводят до кипения и оставляют на 10 мин, после чего выливают в воду. Выпавший осадок отфильтровывают, сушат и перекристаллизовывают из гексана. Получают соединение 2, бесцветные кристаллы, выход 89%,
Тпл 145–146°С.
2-Бензил-3-(5-метил-2-фурил)-1-изоиндолинон (3). К 0.9 г (3.8 ммоль) соедине-
ния 2 в 10 мл бензола добавляют 0.2 г (1.16 ммоль) п-толуолсульфокислоты и кипятят 2 мин, после чего прикапывают 1 мл (11 ммоль) 2-метилфурана. Реакционную смесь кипятят 20 мин, затем выливают в воду и нейтрализуют NaHCO3. Органический слой отделяют, промывают водой, сушат над Na2SO4 и пропускают через слой силикагеля. К бензольному раствору добавляют 5 мл гексана и оставляют для кристаллизации. Получают соединение 3, бесцветные кристаллы,
выход 81%, Тпл 137–138°С.
Структура соединений 2 и 3 доказана методами ИК, ПМР спектроскопии и элементным анализом.
1.Аграномов А.Е., Шабаров Ю.С., Лабораторные работы в органическом практикуме, М.: Химия, 1974, c. 91.
280 |
Избранные методы синтеза |
