
Карцев В.Г.Избранные методы с-за и модифик. гетероциклов т.1 , 2003
.pdf
|
|
|
Схема 2 |
O |
O |
|
HO O O |
|
|
||
|
OH |
|
H |
|
|
|
|
|
O |
1O |
O |
|
O |
|
|
|
2 |
|
|
|
OH |
|
OH |
16 |
17 |
|
9 |
В ряду производных клероданового типа широко представлены соединения с инсектицидной активностью, главным образом, антифидантным действием. Среди них фуранотерпеноиды простого строения, например 18 [3] и 19 [12], и продукты более глубокого превращения скелета: колумбин 20 [13] и корнутин А 21 [14].
O O
R |
|
O |
O |
|
|
|
|
||
18 R = Me, CH2OH |
|
|
19 |
O |
O |
|
|
O |
|
H |
O |
|
H O |
|
O |
|
O |
|
|
|
|
|
|
|
O OH |
|
O O |
OAc |
|
|
|
21 |
OAc |
|
20 |
|
|
|
|
Растения рода Salvia (шалфей) отличаются способностью проводить аномальные трансформации скелета. Так, Salvia reflexa продуцирует антифидант 22 [15]. Производных фураноклеродана, обладающих ценной для медицины биологической активностью, выявлено не очень много. Галлюциногенное действие отвара мексиканского вида шалфея Salvia divinorum, используемого аборигенами в ритуальных обрядах, вызвано наличием дивинорина А 23 [1].
Генеральный спонсор и организатор – InterBioScreen Ltd. |
107 |
Плаунол В 24, продуцируемый таиландским лекарственным растением Croton sublyratus, является фактором, определяющим противоязвенный эффект лечебного средства, приготавливаемого из растения [1].
|
|
|
O |
|
O |
|
H |
|
|
|
|
|
O |
|
|
O |
|
O |
O |
|
|
||
|
|
|
|||
|
|
|
|
O |
|
|
|
|
O |
O |
|
|
|
|
|
||
|
|
|
AcO |
|
O |
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
O |
|
|
CO2Me |
|
O |
|
|
|
|
|
|
|
|
22 |
|
23 |
|
24 |
Редкие хлорсодержащие метаболиты растения Teucrium africanum африканины А и В 25 (схема 3) определяют противогрибковую активность экстрактов [16]. В народной медицине стран Азии в качестве диуретиков и жевательных палочек дезинфицирующего и противомалярийного действия широко используются растения родов Polyalthia, Premna и Cyanthocalyx. Выделенные из них фуранотерпены 26, 27 были использованы для синтеза гидроксибутенолидов 28, 29, обладающих противораковой и противотуберкулезной активностью [17].
Схема 3
O |
|
|
|
|
O |
|
|
|
OAc |
|
|
R |
R = H2, O; R' = O, |
H |
|
HO |
OAc |
||
R' |
|||
Cl |
|
||
OAc |
|
||
25 |
|
O
O O
HO
1O2
26 |
28 |
108 |
Пленарные доклады |
O
O |
|
O |
|
HO |
|
H |
1O |
H |
|
|
|
|
2 |
|
R 27 |
R |
29 |
|
R = CH2OAc, CO2H |
|
Цембраноиды – обширный класс дитерпенов, продуцируемых растениями и морскими организмами [1]. Особый интерес представляют морские метаболиты.
Так, противоопухолевое действие обнаружили цембраноиды, содержащиеся в кораллах Pseudopterogorgia bipinnata 30 [18] и 31, 32 [19]. Характерна структура метаболита 32, содержащего фрагмент, образовавшийся в результате окислительного расщепления фуранового цикла. Среди фураноцембраноидов найдены сильно действующие токсины.
|
|
OH |
OH |
OH |
H |
|
|
H |
H |
O |
|
O |
O O |
|
|
|
|||
H O |
|
O |
O |
|
|
O |
|
O |
O |
|
30 |
|
31 |
32 |
|
|
|
|
N |
|
|
|
|
N |
|
O |
H |
|
|
|
|
|
|
|
H |
|
|
O |
O O |
O |
|
|
||
O |
|
|
|
|
O |
|
|
O |
|
|
|
|
||
|
|
|
|
|
|
O |
OAc |
O |
OH |
|
O |
|
|
|
|
|
34 |
CO2Me |
|
|
33 |
|
35 |
|
Генеральный спонсор и организатор – InterBioScreen Ltd. |
109 |
|||
Например, продуцируемый кораллами Lophogorgia лофотоксин 33 является селективно и необратимо действующим ингибитором никотиновых ацетилхолиновых рецепторов, вызывая паралич и удушье [20]. В число действующих веществ ядовитых выделений одного из бразильских видов муравьев входит цембраноид 34 [21]. В последнее время большой интерес вызвали противораковые метаболиты кораллов, имеющие скелет 4,7-оксаэуницеллана [22]. Один из них саркодиктин А 35 выделен из средиземноморского коралла Sarcodictyon roseum [23].
Губки являются продуцентами трициклических фуранодитерпенов 36, 37, ингибирующих рост вируса герпеса и клеток лейкемии Р 388 [24]. Растительные метаболиты 38 препятствуют развитию вируса парагриппа [25].
|
|
|
O |
R' |
|
O |
OAc |
|
|
|
|
|
|
|
R |
R |
|
|
H |
OH |
|
OAc |
|
|
|
||
|
|
OHOAc |
|
|
|
H |
|
|
36 R' = O, R = |
38 R = CH2, OH |
|
|
OH |
||
|
|
||
|
37 R = O, R' = |
H |
|
|
OH |
|
|
|
|
|
К иным структурным типам относятся суберсин 39, метаболит губки Jaspis splendes suberia, ингибирующий 15-липоксигеназу человека [26] и ингибитор связывания интерлейкина-8 (IL-8) фрондосин В 40 [27].
Перспективные биоактивные агенты найдены среди сестертерпенов. Алифатические терпеноиды, включающие как не измененные, так и моди-
фицированные фурановые циклы, образуют систему химической защиты морских губок. К ним относятся стробилин 41, дигидроирцинин 42 [1] и гипносноигин С 43 [28]. Производное гидроскибутанолида окинонеллин В 44, является цитотоксическим, противосудорожным и антибактериальным агентом [29].
HO
O
H |
O |
39 |
40 |
110 |
Пленарные доклады |
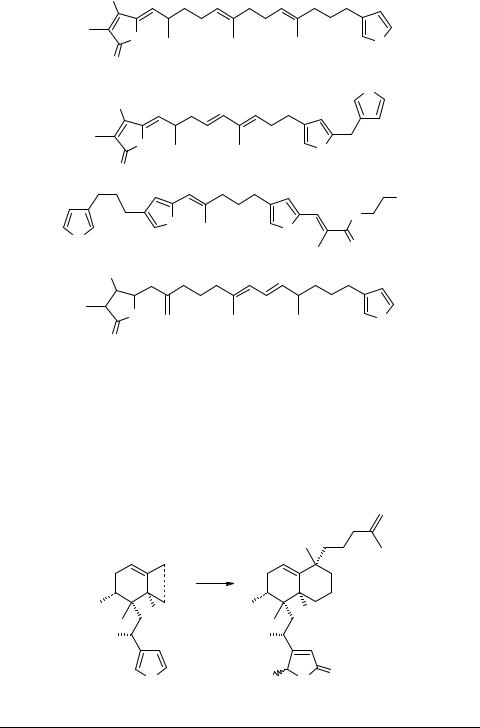
HO
|
O |
|
O |
|
|
|
|
O |
41 |
|
|
HO |
|
|
O |
|
|
|
|
|
O |
O |
|
|
|
|
|
O |
42 |
|
|
|
|
H |
NH2 |
|
O |
N |
|
O |
O |
|
|
43 |
|
||
O |
|
||
|
|
||
HO |
|
|
|
|
O |
O |
|
|
|
O |
|
44 |
Бициклический сестертерпеноид дизидиолид 45, выделяемый из карибской губки Dysidea etheria, обладает высокой активностью ингибитора протеинфосфатазы. Терпеноид рассматривается как перспективный противораковый агент. Осуществлен его полный синтез, завершающей стадией которого является фотоокисление фуранового предшественника 46 [30] (схема 4). Метаболиты черного коралла спонгианолиды 47, 48, ингибирующие протеинкиназу С, угнетают развитие клеток рака грудной железы МСF-7 [31].
Схема 4
1O2
H |
H |
|
HO |
HO |
|
O |
HO O |
O |
46 |
45 |
|
Генеральный спонсор и организатор – InterBioScreen Ltd. |
111 |
|
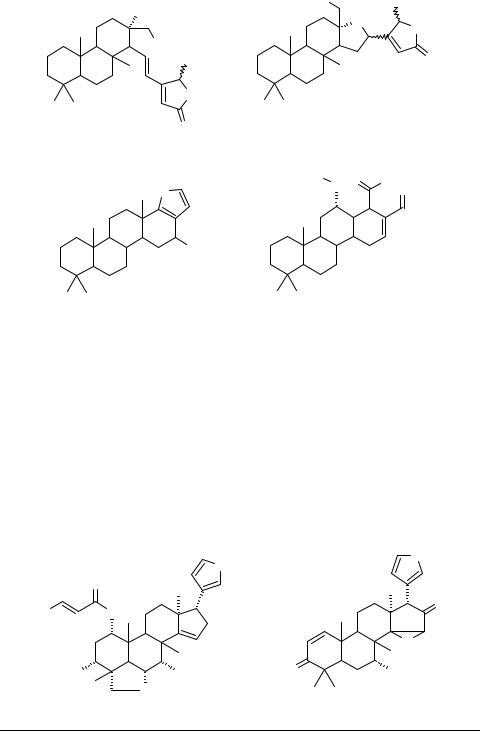
|
OH |
RO |
HO |
|
O |
|
|
|
|
O |
|
|
OR |
|
|
|
|
O |
|
|
OH |
|
|
|
O |
|
|
47 |
O |
48 |
|
|
R = Ac, COCH2CH(OH)Me |
|
|
|
O |
Ac O O |
H O |
 H
H
OAc
49 |
50 |
Тетрациклические сестертерпены 49, 50 способны подавлять рост клеток некоторых видов рака человека [32].
Среди фуранотерпеноидов особое место занимают лимоноиды и мелиацианины, отнесенные к группе тетранортритерпенов. Эти соединения, как правило, насыщены кислородсодержащими функциями и могут содержать как не измененную, так и глубоко деструктированную циклическую систему.
С позиций медицинской химии наибольший интерес представляют терпеноиды с сохраненными циклами.
Противораковую активность обнаружил мелиавокин 51, выделенный из коры тропического дерева Melia volkensis [33], тогда как эпоксиазадирадион 52 ингибирует репродукцию вируса ВИЧ-I [34]. Тусенданин 53 рассматривается как перспективное противоядие при отравлении ботулизмом [1]. В этом ряду найдены сильные токсины. Например, содержащиеся в плодах субтропического дерева Melia azederach мелиатоксины 54, являются причиной отравлений этими плодами [1].
|
|
O |
O |
|
|
|
|
|
O |
|
|
Ph |
O |
|
O |
|
|
||
|
|
|
O |
AcO |
OH |
O |
OAc |
|
O |
|
|
|
51 |
|
52 |
112 |
Пленарные доклады |
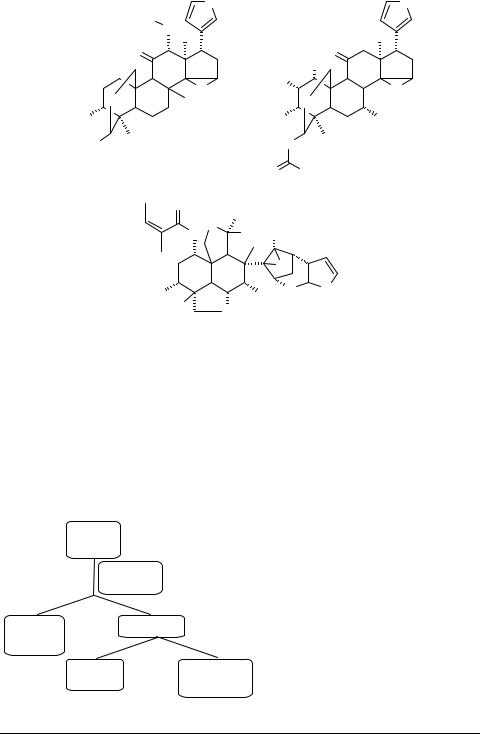
O |
|
|
O |
Ac O |
|
|
|
O |
|
|
OHO |
O |
|
AcO |
O |
|
|
||
O |
|
|
O |
AcO |
|
AcO |
OH |
HO |
|
O |
|
53 |
|
O |
C5H11 54 |
O |
|
CO2Me |
|
O O |
|
|
|
|
OH OH |
|
|
|
|
O |
|
AcO |
|
OH O |
O |
MeO2C |
O |
55 |
|
|
|
|
Описан целый ряд лимоноидов, имеющих глубоко измененный остов. Многие из них имеют мощную инсектицидную активность. Одно из них азадирахтин 55 продуцирует дерево Azadirachta indica, используемое в странах Азии для защиты плантаций от насекомых вредителей.
Масло азадирахты поступило на рынок как инсектицид [1].
Как следует из изложенного, продуцентами биологически активных фуранотерпеноидов преимущественно являются тропические и субтропические растения и морские организмы. Большинство метаболитов относится к труднодоступным соединениям, поэтому синтез их или их аналогов актуален. Интерес представляют также синтетические трансформации доступных метаболитов.
|
Живица |
|
кедра |
|
перегонка |
|
с паром |
летучая |
остаток |
часть |
|
|
кислоты |
Состав
(по данным хроматомасс-спектрометрии) летучаячасть: α-пинен, β-пинен, 3-карен, β-фелландрен; нейтральная часть: α-муролен, β-бисаболен,
δ-кадинол, α-бисаболол, цембрен, изоцемброл; кислоты: изопимаровая, ламбертиановая, абиетиновая, неоабиетиновая
(соотношение 1 : 1 : 2 : 0.5)
нейтральная
часть
Рис. 1. Схема разделения компонентов живицы кедра
Генеральный спонсор и организатор – InterBioScreen Ltd. |
113 |
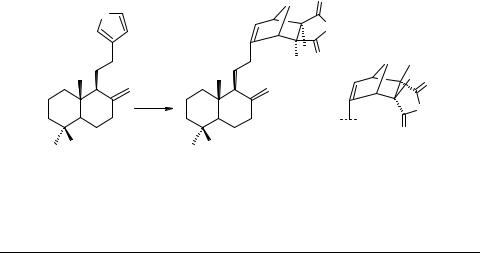
Флора Сибири и Алтая, не отличающаяся богатым выбором фуранотерпеноидов, тем не менее, представляет возможность использования такого доступного соединения, как ламбертиановая кислота (ЛК) 56.
Разработав технологичные методы выделения ЛК из хвои и живицы сибирского кедра (рис. 1), мы укрепились во мнении, что этот фуранотерпеноид может в случае необходимости производиться в опытно-промышленном масштабе.
В последнее время мы реализуем программу, включающую химические и фармакологические исследования [35–42] и направленную на поиск путей оптимального использования ЛК. Главное внимание мы уделяем производным, синтез которых предусматривает сохранение углеродного остова.
Ранее нами было показано, что введение азотсодержащих фрагментов в молекулу ЛК способствует усилению нейротропной активности. В связи с этим мы осуществляли синтез дитерпеновых алкалоидов нескольких структурных типов.
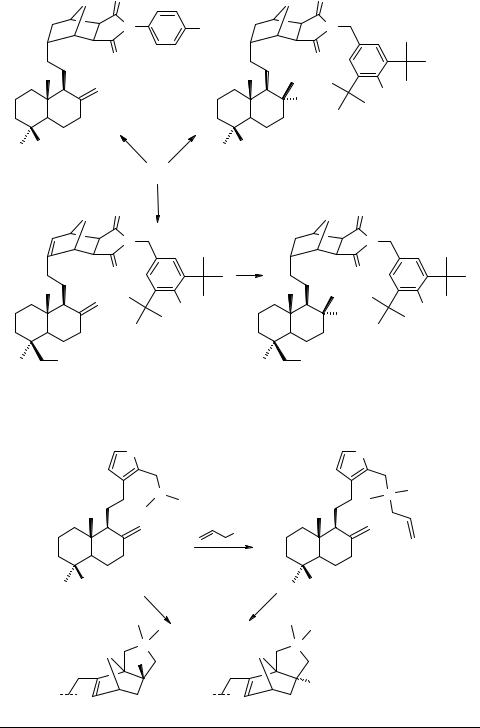
Показано, что циклоприсоединение N-замещенных малеинимидов к фурановому циклу ЛК приводит к дитерпеноидам, содержащим структурный фрагмент 10-окса-4-азатрицикло[5,2,1,02,6]дец-8-ена. Продуктом реакции является в каждом случае смесь экзо-(57) и эндо-(58) изомеров, которые в большинстве случаев удалось разделить (схема 5). Гидрирование на Pd/C проходит с параллельным насыщением обеих двойных связей, давая тетрагидроаддукты 59, 60. Характерно, что при гидрировании N-(4-бромфенил)-замещенных трицикланов удается сохранить экзометиленовую двойную связь и получить дигидропроизводное 61.
Восстановление аддуктов действием LiAlH4 приводит к пирролидинодитерпенам типа 62, гидрирование которых дает 63.
Изучение нейротропных свойств новых производных ЛК с применением тестов принудительного плавания и поведенческих реакций позволяет отнести их к классу антидепрессантов. Некоторые соединения проявляют выраженный седативный эффект. Выявлены агенты, способствующие преодолению стрессового состояния животных.
Схема 5
O |
O |
O |
|
|
|
||
|
|
NR |
|
|
|
|
|
|
H |
H O |
O H |
|
|
H O |
|
|
|
|
|
|
|
+ |
NR |
CO2H |
CO2R' |
|
O |
|
|
||
56 |
57 |
|
58 |
R = (CH2)3CO2H, BrC6H4, Bn, 4-OHC6H4(CH2)2, 4-OH-3,5-t-BuC6H2(CH2)2,
4-OH-3,5-t-BuC6H2(CH2)3; R' = H, Me
114 |
Пленарные доклады |
|
O |
O |
|
O |
O |
|
|
|
|
|
|
|
|
|
|
||
|
|
N |
Br |
|
|
N ( )n |
|
|
|
|
O |
|
|
O |
|
|
|
|
|
|
|
|
H |
|
|
OH |
|
|
|
|
|
|
|
|
|
CO2Me |
|
|
a a |
CO2H |
|
|
|
|
61 |
|
|
57, 58 |
59, 60 (n = 2, 3) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
O |
LiAlH4 |
|
|
O |
O |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
||
|
|
N |
( )3 |
|
|
|
|
N ( )3 |
|
|
O |
|
a |
|
|
O |
|
|
|
|
|
|
|
|
||
|
|
|
OH |
|
|
|
H |
OH |
|
|
|
|
|
|
|
|
|
OH |
|
62 |
a - H2, Pd/C |
|
OH |
|
63 |
|
|
|
|
|
|
|
|||
Алкалоиды с трициклическим фрагментом другого типа удается получить путем внутримолекулярной реакции Дильса–Альдера четвертичных аллиламмо-
ниевых солей типа 64 (схема 6). |
|
|
Схема 6 |
|
|
O |
|
O |
|
|
|
|
||
|
N |
|
+ |
|
|
|
N |
Br− |
|
|
|
Br |
|
|
|
|
20°C |
|
|
CO2Me |
|
|
CO2Me |
|
67 |
|
|
64 |
|
O |
N + Br− |
O |
N + Br− |
|
H |
|
|
||
|
|
|
|
|
|
+ |
|
H |
|
66 |
|
|
65 |
|
Генеральный спонсор и организатор – InterBioScreen Ltd. |
115 |
|||
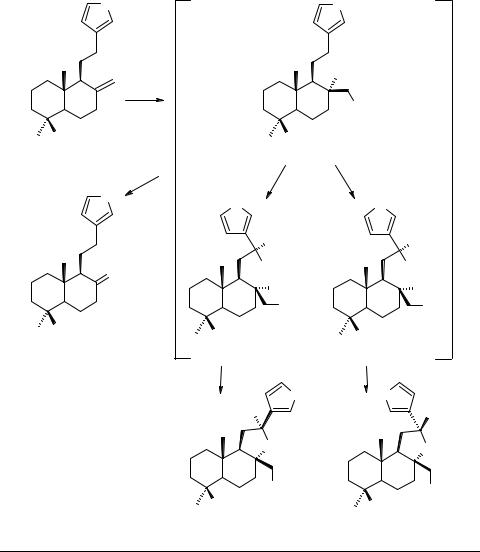
Так, при нагревании солей в ацетонитриле или бензоле образуется смесь 5S-(65) и 5R-(66)-диастереоизомеров. Эти соединения можно получить непосредственно из диметиламинопроизводного ЛК 67 и аллилбромида.
Дитерпеновые алкалоиды, содержащие фрагменты [3,4-b]-фураноазацикло- октана и [3,4-b]-фураноазациклононана, получены на основе соединений, образующихся при окислении метилового эфира ЛК 56а с помощью KMnO4 в присутствии катализатора фазового переноса. Это, ранее не описанное превращение, протекает нетривиально с образованием норкетона 68 (21%), (8R,12S)-оксида 69 (39%) и его
(8R,12R)-изомера 70 (11%) (схема 7).
Схема 7
O
a
CO2R
56a
O
O
CO2Me
68
CO2Me
71
O
H
OH
OH
OH
CO2Me
72
O
H
O
OH
CO2R
69
O
OH
OH
O
OH
H
OH
OH
CO2Me
73
O
H
O
OH
CO2R
70
116 |
Пленарные доклады |
