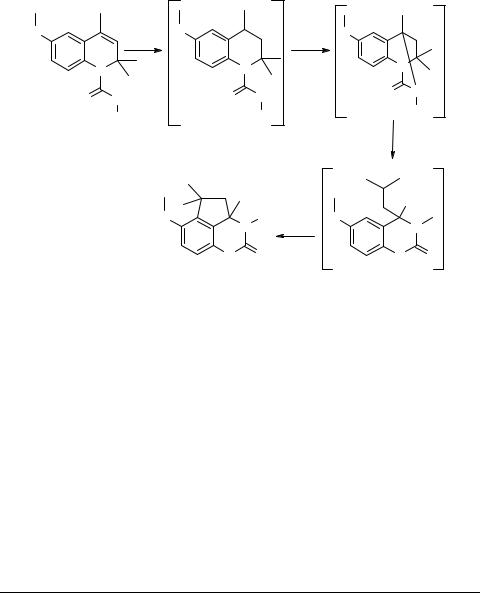
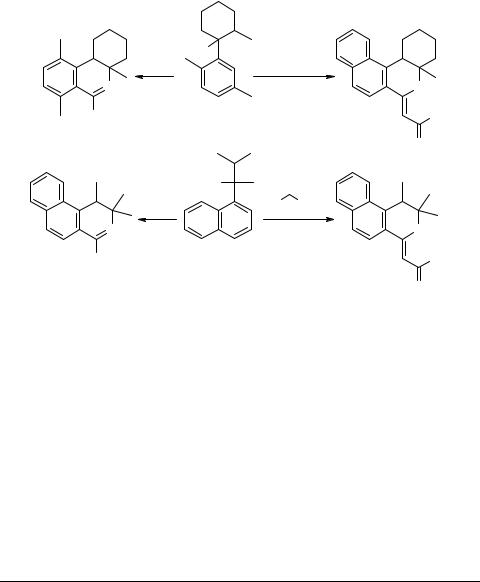
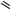Карцев В.Г. - Избранные методы синтеза и модификации гетероциклов. Том 1 (2003)(ru)
.pdf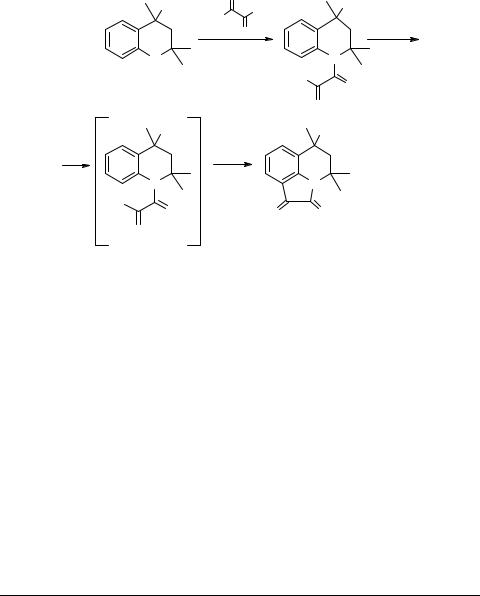
6-Фенил-5,6-дигидро-4,4,6-триметил- 4Н-пирроло[3,2,1-ij]хинолин-1,2-дион
Шихалиев Х.С., Лещева Е.В.
Воронежский государственный университет
|
Ph |
O |
Cl |
|
Ph |
|
EtO |
|
|||
|
|
|
|
||
|
|
|
|
PCl5 |
|
|
|
O |
|
|
|
N |
|
PhMe, ∆ |
|
N |
CCl4, ∆ |
H |
|
|
|
EtO |
O |
|
|
|
|
||
1 |
|
|
|
|
|
|
|
|
O 2 |
|
|
|
Ph |
|
|
Ph |
|
N |
|
−HCl |
|
N |
|
|
|
|
|
||
Cl |
O |
|
O |
O |
|
|
|
|
|||
O |
|
|
|
3 |
|
Этокси-(2,2,4-триметил-4-фенил-(1,2,3,4-тетрагидро-1-хинолил)оксалат (2). В
круглодонную колбу с обратным холодильником и хлоркальциевой трубкой помещают 2.5 г (0.01 моль) 4-фенил-2,2,4-триметил-1,2,3,4-тетрагидрохинолина 1 [1], 20 мл сухого толуола, прибавляют при охлаждении 0.011 моль этоксалилхлорида и кипятят в течение суток. Растворитель отгоняют при пониженном давлении, остаток кристаллизуют из изопропанола. Выход 64%, Тпл 156–158°C.
6-Фенил-5,6-дигидро-4,4,6-триметил-4Н-пирроло[3,2,1-ij]хинолин-1,2-дион (3).
К раствору 0.01 моль этоксалилпроизводного 2 в 30 мл сухого четыреххлористого углерода прибавляют при охлаждении 0.01 моль PCl5, выдерживают при комнатной температуре 30 мин, а затем кипятят в течение 1 ч. Растворитель и POCl3 отгоняют при пониженном давлении, остаток кристаллизуют из изопропанола.
Выход 65%, Тпл 173–174°С.
Структура соединений 2 и 3 доказана методами ИК, ПМР, масс-спектроскопии и элементным анализом.
1.Луговик Б.А., ХГС 1970 1512.
Избранные методы синтеза и модификации гетероциклов, том 1 |
611 |
6-Замещенные 4а,7,10-триметил-1,2,3,4,4а,10b-
гексагидрофенантридины и 4-замещенные 1,2,3-триметил-1,2-дигидробензо[f]изохинолины
Шкляев Ю.В., Нифонтов Ю.В.
Институт технической химии УрО РАН
HO
|
R1CN |
NCCH2COR2 |
|
|
N |
|
|
|
NH |
R1 |
1 |
4 |
R2 = OEt |
R2 |
2 R1 = Me |
|
|||
|
5 R2 = NH2 |
O |
||
3 R1 = SMe |
|
|||
|
|
|
||
|
HO |
|
|
|
|
R1CN |
CN CONH2 |
|
|
|
|
|
|
|
N |
|
|
|
NH |
R1 |
6 |
|
9 |
NH2 |
7 R1 = Me |
|
|
O |
|
|
|
|
||
8 R1 = SMe |
|
|
|
|
|
|
|
|
|
Общая методика синтеза 6-замещенных 4а-метил-1,2,3,4,4а,10b-гексагидро-
фенантридинов (2, 3, 4). Смесь 21.6 г (0.1 моля) карбинола 1 (получен из 2-бром- магний-пара-ксилола и 2-метилциклогексанона в эфире) и 0.1 моля нитрила прибавляют по каплям при охлаждении (0–10°С) и перемешивании к 50 мл концентрированной серной кислоты [1]. Перемешивают 30 мин, разбавляют 300 мл воды, экстрагируют 50 мл толуола, органический слой отбрасывают, остаток подщелачивают водным аммиаком до рН 8–9. Выделившийся осадок отделяют, промывают водой, сушат на воздухе и кристаллизуют. Соединение 2 охарактеризовано в виде салицилата.
4а,6-Диметил-1,2,3,4,4а,10b-гексагидрофенантридина салицилат (2).
Выход 39%. Тпл 127–128°С (этанол).
6-Метилтио-4а-метил-1,2,3,4,4а,10b-гексагидрофенантридин (3). Выход 53%.
Тпл 102–103°С (гексан).
Избранные методы синтеза и модификации гетероциклов, том 1 |
613 |

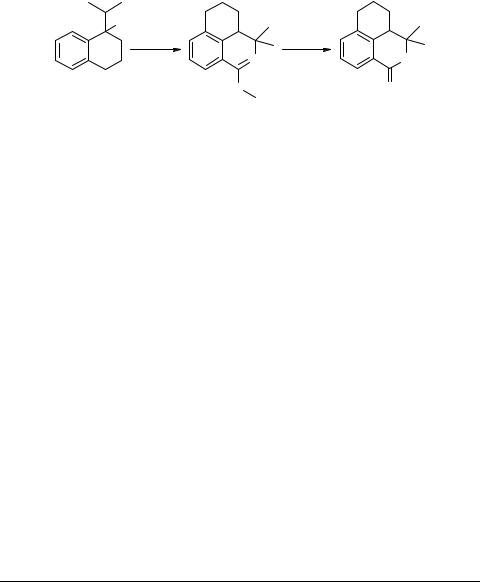
1-Метилтио-3,3-диметил-4,5-тетраметилен- 3,4-дигидроизохинолин и 3,3-диметил-4,5- тетраметилен-3,4-дигидроизокарбостирил-1
Шкляев Ю.В., Нифонтов Ю.В.
Институт технической химии УрО РАН
OH |
H |
|
H |
MeSCN |
|
AcOH |
|
H |
N |
−MeSH |
NH |
|
|||
|
S |
|
O |
1 |
2 |
|
3 |
1-Метилтио-3,3-диметил-4,5-тетраметилен-3,4-дигидроизохинолин (2). Смесь
19.1 г (0.1 моля) карбинола 1 и 7.3 г (0.1 моля) метилродана прибавляют по каплям при охлаждении (0–5°С) и перемешивании к 50 мл конц. серной кислоты. После прибавления перемешивают еще 30 мин, разбавляют 300 мл воды, экстрагируют 50 мл бензола. Органический слой отбрасывают, водный нейтрализуют карбонатом аммония, доводя рН до 8–9. Выделившийся продукт экстрагируют метилтретбутиловым эфиром, сушат б/в MgSO4. Растворитель отгоняют на водяной бане, остаток кристаллизуют из гексана. Выход 48%. Тпл 76–77°С.
3,3-Диметил-4,5-тетраметилен-3,4-дигидроизокарбостирил-1 (3). Раствор 2.45 г (0.01 моль) 1-метилтио-3,3-диметил-4,5-тетраметилен-3,4-дигидроизохинолина 2 в 20 мл уксусной кислоты кипятят в течение 2 ч, разбавляют 100 мл воды, подщелачивают аммиаком до рН 7–8. Выделившийся осадок отделяют, сушат на воздухе и кристаллизуют из этилацетата. Выход 80%. Тпл 191–192°С.
Структура синтезированных соединений доказана методами ИК, ПМР и массспектроскопии.
Работа выполнена при финансовой поддержке РФФИ (грант 01-03-96479 Урал).
1.Шкляев Ю.В., Нифонтов Ю.В., в сб. Перспективы развития естественных наук в высшей школе: Тр. междунар. конф., Пермь, 2001, т. 1 "Органическая химия", с. 61.
2.Шкляев Ю.В., Нифонтов Ю.В., в сб. Перспективы развития естественных наук в высшей школе: Тр. междунар. конф., Пермь, 2001, т. 1 "Органическая химия", с. 71.
Избранные методы синтеза и модификации гетероциклов, том 1 |
615 |
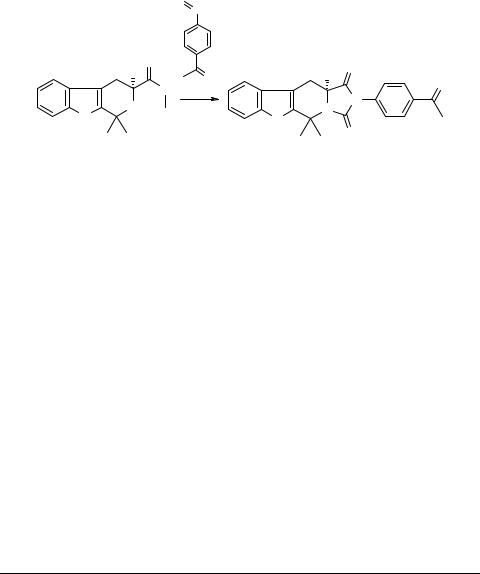
2-(4-Ацетилфенил)-5,6,11,11b-тетрагидро-11b-метил- 1H-имидазо[1',5':1,2]пиридо[3,4-b]индол-1,3(2H)-дион
Язловицкий А.В., Дыбенко А.Г.
Эксимед–Ай-Би-Скрин, Лаборатория синтеза физиологически активных соединений ИБОНХ НАН Украины
|
|
|
O |
|
|
|
O |
|
N |
|
|
|
|
2 |
|
|
|
|
|
|
|
H |
|
|
NH |
|
|
N |
|
N |
|
N |
N |
||
|
|
|
|
||
H |
|
|
H |
|
O |
O |
O |
|
|
O O |
|
1 |
|
O |
O |
3 |
O |
|
N |
N |
|
|
|
|
|
|
|
|
NH O
4
2-(4-Ацетилфенил)-5,6,11,11b-тетрагидро-11b-метил-1H-имидазо-[1',5':1,2]-
пиридо[3,4-b]индол-1,3(2H)-дион (4). К раствору 0.9 г (0.0035 моль) этилового эфира 1-метил-2,3,4,9-тетрагидро-1H-пиридо[3,4-b]индол-1-карбоновой кислоты 1 [1] в 35 мл сухого толуола при перемешивании на магнитной мешалке добавляют 0.56 г (0.0035 моль) изоцианата 2, растворенного в 15 мл сухого толуола. Немедленно после смешения выпадает бесцветный осадок мочевины 3. Дальнейшее кипячение суспензии приводит к постепенному растворению осадка. Через 3 ч нагревания отгоняют 35–40 мл толуола, а остаточный раствор после охлаждения до комнатной температуры приливают к 100 мл гексана. Сформировавшийся бесцветный осадок отфильтровывают и высушивают. После перекристаллизации из изопропанола получают 1.2 г (85%) соединения 4 в виде бесцветных крис-
таллов, Тпл 208–210°С.
Структура соединения 4 подтверждена спектрами ПМР (ДМСО-d6, Varian VXR-300) и элементным анализом.
1.Дуленко В.И. и др., β-Карболины. Химия и нейробиология, Киев: Наукова думка, 1992, с. 16.
Избранные методы синтеза и модификации гетероциклов, том 1 |
617 |


Т
Тадевосян Д.А. 534 Тимофеева З.Ю. 181 Толстиков Г.А. 418, 604 Толстикова Т.Г. 418 Трофимов Б.А. 600 Тугушева Н.З. 541
Ф
Фалалеев А.В. 450 Фофанов Г.М. 592, 593
Х
Харитонов Ю.В. 604
Ч
Чапышев С.В. 606 Чебанов В.А. 140 Чугунов Б.М. 548, 607
Ш
Шапошников А.Ю. 593 Швайка О.П. 279 Широкий Г.А. 609
Шихалиев Х.С. 450, 611, 612
Шкляев В.С. 531
Шкляев Ю.В. 478, 493, 529, 576, 577, 613, 615
Шмидт Е.Ю. 349, 565, 566, 567, 568
Шульц Э.Э. 418, 604
Я
Язловицкий А.В. 616, 617
620 |
Серия монографий InterBioScreen |